Среди всех онкологических заболеваний рак желудка (РЖ) исходно сопровождается наиболее высоким риском развития нутритивной недостаточности (НН), встречающейся у 87% пациентов, из которых около 15% уже на момент постановки диагноза имеют потерю более 10% массы тела за последние полгода [1-3], что может быть вызвано механической обструкцией пищеварительного тракта опухолями или синдромом анорексии-кахексии у онкологических больных [4-6]. До 70% пациентов, госпитализированных для проведения планового оперативного лечения новообразований пищевода и желудка, имеют высокий риск развития НН и нуждаются в проведении лечебного питания в периоперационном периоде, при этом, несмотря на объективные причины необходимости выявления и коррекции НН у данной группы пациентов, в 70—80% случаев НН остается недиагностированной и не принимается никаких мер для ее коррекции [7]. Показано, что показатели нутритивного статуса (НС), такие как баллы по шкале CONUT и предоперационный индекс нутритивного риска (NRI), влияют на непосредственные результаты при хирургическом лечении РЖ, являясь фактором независимого прогноза развития послеоперационных осложнений при радикальных операциях [8; 9]. Исследования показали также, что низкая масса скелетной мускулатуры – саркопения, в том числе на фоне ожирения, является неблагоприятным фактором для постгастрэктомических осложнений в хирургии РЖ [10-12]. НН и саркопения влияют не только на непосредственные результаты лечения, но и негативно сказываются на отдаленных результатах, снижая показатели безрецидивной и общей выживаемости [13-15]. Таким образом, оценка параметров НС и индикаторов мышечной массы у пациентов с РЖ как в пред-, так и в послеоперационном периоде имеет большое значение в улучшении как КЖ, так и непосредственных и отдаленных результатов лечения.
Цель исследования - оценка показателей нутритивного статуса и состояния мышечной системы у пациентов с РЖ I – III стадий, подвергшихся радикальному хирургическому лечению, и их потенциального значения в качестве предикторов послеоперационных осложнений.
Материалы и методы исследования. В ретроспективное исследование типа «случай-контроль» включены 116 пациентов с раком желудка I – III стадий, старше 18 лет, вне зависимости от пола, перенесших радикальное хирургическое лечение в отделении абдоминальной онкологии ГБУЗ «Клинический онкологический диспансер № 1» Министерства здравоохранения Краснодарского края (ГБУЗ «КОД № 1» МЗ КК) в период с 01.01.2016 г. по 31.12.2022 г. Сведения о пациентах извлекались из медицинской документации, на 1-м этапе выполнен отбор генеральной совокупности пациентов, соответствующих критериям включения, из госпитальных регистров; вторым этапом отобрана группа потенциальных «случаев» - пациенты с осложнениями в послеоперационном периоде, и группа госпитальных «контролей» - с неосложненным течением послеоперационного периода, в соотношении 1:2; третьим этапом осуществлен поиск и экстрагирование медицинской документации отобранных пациентов из архива и ее анализ. Поиск и извлечение КТ-сканов осуществлялся в госпитальной базе данных методов визуализации. Пациенты, не имевшие полного набора данных, в том числе архива КТ-сканов, исключались. В результате было отобрано 39 пациентов в группу «случай» и 78 – в группу «контроль», один пациент из группы «случай» был исключен на этапе регистрации данных в связи с обнаружением ошибочных сведений, в итоге анализу подверглись 38 пациентов с осложненным течением послеоперационного периода (I группа) и 78 пациентов без осложнений (II группа). Регистрацию осложнений проводили по записям в медицинской документации, для оценки послеоперационных осложнений использовали модифицированную классификацию ACCORDION [16]. Параметры НС включали регистрацию уровня общего белка и альбумина плазмы, абсолютного количества лимфоцитов крови. Данные КТ использовали для оценки 3 морфометрических параметров [17]: толщины перинефральной жировой клетчатки (ПНЖК), жировой клетчатки передней брюшной стенки (ЖКПБС), пощади поясничных мышц (ППМ). Измерения производили по аксиальным КТ-срезам на рабочей станции AW VolumeShare 5 General Electric (рис. 1). Рассчитывали индекс скелетных мышц (ИСМ, мм2/м2), как соотношение суммы площадей поясничных мышц на уровне позвонка L3 к площади поверхности тела [18]. Значения конечных точек для пациентов с саркопенией приняты 492 мм2/м2 для мужчин и 362 мм2/м2 для женщин [19]. Исследование выполнено в рамках комплексной темы НИР «Совершенствование методов реконструкции пищеварительного тракта после гастрэктомии и резекции желудка, оптимизация профилактики и хирургической коррекции послеоперационных гнойно-септических осложнений», тема одобрена Независимым этическим комитетом ФГБОУ ВО «Кубанский государственный медицинский университет» Минздрава Российской Федерации (протокол № 107 от 28.01.2022 года).
Для анализа данных применены: анализ четырехпольных и многопольных произвольных таблиц сопряженности с использованием критерия хи-квадрат (χ2) Пирсона, H-критерий Краскела-Уоллиса, t-тест для независимых выборок. Для нахождения независимых влияний ряда потенциальных предикторных переменных на исходы применили метод простого (однофакторного) и множественного логистического регрессионного анализа. Конечную оптимальную модель определяли при помощи процедуры автоматического пошагового обратного исключения параметров (Backward Stepwise). С целью оценки качества полученной прогностической модели, а также пороговых значений использован ROC-анализ с построением ROC-кривых и вычислением площади под кривой. Оптимальный порог отсечения был определен исходя из 80% чувствительности. Для показателя «Площадь под кривой» вычислялись 95% доверительный интервал для ROC-кривой, ее стандартная ошибка и значимость для каждого изучаемого показателя. Пороговым критерием статистической значимости принято значение p<0,05. Для статистического анализа использовали программный пакет для статистической обработки данных IBM® SPSS Statistics 23.0 для Windows (IBM, США).
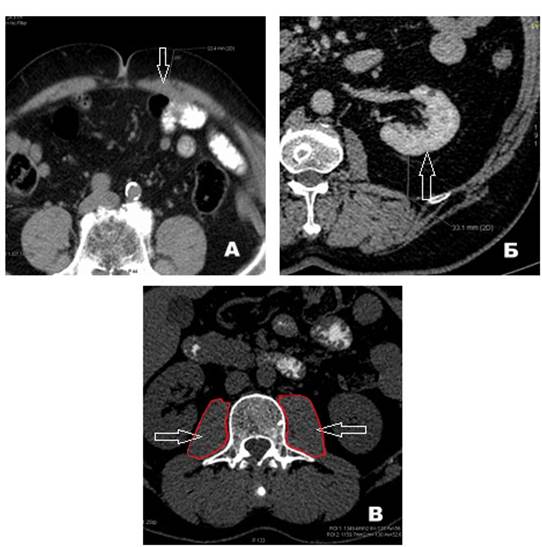
Рис. 1. КТ-морфометрия: А - толщина жировой клетчатки передней брюшной стенки (обозначена стрелкой); Б - толщина перинефральной жировой клетчатки (обозначена стрелкой); В - площади правой и левой поясничных мышц (обозначены стрелками, контуры выделены красным) на уровне позвонка L3
Результаты исследования и их обсуждение. По возрастному, половому составу, ИМТ пациенты обеих групп не имели статистически значимых различий. При сравнении групп выявлены статистически значимые различия по следующим параметрам: распределение по стадиям TNM (8-е издание), характеру примененных доступов, доле комбинированных операций, длительности операции, количеству исследованных лимфоузлов, частоте лимфоваскулярной и периневральной инвазии. По остальным параметрам (характер и частота сопутствующей патологии, тип операции, кровопотеря, гистологический тип и размер опухоли, частота R1 резекции, количество лимфоузлов с метастазами) статистически значимых различий между группами не было (табл. 1).
Таблица 1
Характеристика групп пациентов с осложненным и неосложненным течением послеоперационного периода
|
Показатель |
Осложненные (n=38) |
Неосложненные (n=78) |
p |
|
Возраст, лет; средн. (СО) |
62,3 (8,5) |
59,8 (11,3) |
0,236 |
|
Масса тела, кг; средн. (СО) |
72,8 (19,4) |
75,1 (15,8) |
0,493 |
|
ИМТ, средн. (СО) |
25,9 (6,5) |
26,7 (5,4) |
0,454 |
|
Пол, n (%) |
|||
|
М |
27 (71,1) |
47 (60,3) |
0,256 |
|
Ж |
11 (28,9) |
31 (39,7) |
|
|
Стадия по TNM, n (%) |
|
|
|
|
IA |
7 (18,4) |
9 (11,5) |
0,024 |
|
IB |
5 (13,2) |
11 (14,1) |
|
|
IIA |
9 (23,7) |
9 (11,5) |
|
|
IIB |
5 (13,2) |
14 (17,9) |
|
|
IIIA |
6 (15,8) |
18 (23,1) |
|
|
IIIB |
6 (15,8) |
12 (16,7) |
|
|
IIIC |
0 (0,0) |
4 (5,1) |
|
|
Сопутствующая патология, n (%) |
|||
|
сердечно-сосудистой системы |
20 (52,6) |
43 (55,1) |
0,125 |
|
дыхательной |
1 (2,6) |
4 (5,1) |
|
|
нервной |
0 (0,0) |
1 (1,3) |
|
|
пищеварительной |
2 (5,3) |
3 (3,8) |
|
|
сосудистой |
1 (2,6) |
2 (2,6) |
|
|
сочетание 2 |
13 (34,2) |
14 (17,9) |
|
|
сочетание 3 |
1 (2,6) |
0 (0,0) |
|
|
отсутствует |
0 (0,0) |
11 (14,1) |
|
|
Доступ, n (%) |
|||
|
лапаротомный |
36 (94,7) |
74 (94,9) |
0,048 |
|
лапароскопический |
2 (5,3) |
0 (0,0) |
|
|
абдомино-медиастинальный |
0 (0,0) |
4 (5,1) |
|
|
Тип операции, n (%) |
|||
|
ГЭ |
26 (68,4) |
41(52,6) |
0,105 |
|
СДРЖ |
12 (31,6) |
37 (47,4) |
|
|
Комбинированные операции, n (%) |
14 (36,8) |
11 (14,1) |
0,008 |
|
Длительность операции, минут; средн. (СО) |
204,3 (67,6) |
160,2 (31,2) |
<0,001 |
|
Кровопотеря, мл; средн. (СО) |
196,1 (70,1) |
206,4 (71,3) |
0,462 |
|
Гистологический тип опухоли, n (%) |
|||
|
аденокарцинома |
27 (71,0) |
50 (64,1) |
0,268 |
|
перстневидно-клеточный рак |
6 (15,8) |
21 (26,9) |
|
|
рак in situ |
0 (0,0) |
3 (3,8) |
|
|
нейроэндокринная опухоль |
2 (5,3) |
0 (0,0) |
|
|
железисто-плоскоклеточный рак |
0 (0,0) |
1 (1,3) |
|
|
недифференцированный рак |
3 (7,9) |
3 (3,8) |
|
|
Резекция R1, n (%) |
1 (2,6) |
1 (1,3) |
0,382 |
|
Размер опухоли, см; средн. (СО) |
3,3 (2,2) |
3,1 (2,1) |
0,665 |
|
Количество исследованных лимфоузлов, n; средн. (СО) |
9,4 (4,9) |
19,5 (7,5) |
<0,001 |
|
Количество лимфоузлов с метастазами, n; средн. (СО) |
1,6 (3,0) |
2,9 (4,8) |
0,122 |
|
Лимфоваскулярная инвазия, n (%) |
0 (0,0) |
8 (10,3) |
0,037 |
|
Периневральная инвазия, n (%) |
1 (2,6) |
9 (11,5) |
0,042 |
Характер зарегистрированных осложнений у пациентов I группы представлен в таблице (табл. 2), частота летальных исходов в группе составила 36,8%. Среди осложнений преобладали осложнения со стороны анастомозов с развитием перитонита, а также другие гнойно-септические осложнения.
Таблица 2
Характеристика осложнений у пациентов I группы (осложненного течения)
|
Осложнения |
Количество |
%% |
|
Класс осложнений по ACCORDION |
||
|
2 |
1 |
2,6 |
|
3 |
5 |
13,2 |
|
4 |
16 |
42,1 |
|
5 |
2 |
5,3 |
|
6 (летальный исход) |
14 |
36,8 |
|
Характер осложнений* |
||
|
несостоятельность эзофаго / гастроэнтероанастомоза |
13 |
34,2 |
|
несостоятельность межкишечных анастомозов |
4 |
10,5 |
|
несостоятельность культи ДПК |
4 |
10,5 |
|
острая язва культи желудка, перфорация |
1 |
2,6 |
|
панкреатит (без фистулы) |
4 |
10,5 |
|
панкреонекроз |
5 |
13,2 |
|
абсцесс |
5 |
13,2 |
|
кровотечение внутрибрюшное |
4 |
10,5 |
|
некроз тонкой кишки |
1 |
2,6 |
|
пневмония |
2 |
5,3 |
|
ТЭЛА |
2 |
5,3 |
Примечания: *проценты вычислены исходя из количества пациентов (38 человек) с учетом того, что у одного пациента могло присутствовать более чем 1 осложнение, в связи с чем сумма процентов не равна 100; ТЭЛА – тромбоэмболия легочной артерии.
Показатели общего сывороточного белка не имели статистически значимой разницы у пациентов обеих групп, при этом уровень альбумина оказался более высоким в контрольной группе (38,32±7,86 г/л в I группе против 44,48±5,87 г/л во II группе, р<0,001) (табл. 3). Сравнительный анализ данных КТ-морфометрии показал, что параметры, характеризующие состояние жировой ткани – ПНЖК и ЖКПБС – не имеют статистически значимых различий между группами осложненного и неосложненного течения. Показатели КТ-морфометрии, характеризующие состояние мышечной системы, оказались более низкими в I группе (пациентов с осложнениями): суммарная ППМ в I группе 1250,95±408,00 мм2 против 1692,28±524,04 мм2 во II группе (р<0,001); ИСМ 704,04±255,45 мм2/м2 против 907,14±248,23 мм2/м2 во II группе (р<0,001). Количество пациентов с показателями ИСМ, соответствующими критериям саркопении, в I группе оказалось 9 (23,7%), в то время как во II группе – 1 (1,3%) (р<0,001).
Таблица 3
Характеристика показателей НС пациентов с осложненным и неосложненным течением послеоперационного периода
|
Показатель |
Осложненные (n=38) |
Неосложненные (n=78) |
p |
|
Общий белок, г/л; средн. (СО) |
66,53 (6,42) |
66,81 (6,46) |
0,835 |
|
Альбумин, г/л; средн. (СО) |
38,32 (7,86) |
44,48 (5,87) |
<0,001 |
|
Лимфоциты, абс. число, тыс. в мкл; средн. (СО) |
1,84 (0,67) |
2,35 (3,40) |
0,362 |
|
ПНЖК слева, мм; средн. (СО) |
12,23 (8,82) |
13,82 (10,52) |
0,430 |
|
ПНЖК справа, мм; средн. (СО) |
12,49 (9,31) |
12,79 (10,18) |
0,880 |
|
ПНЖК сумма, мм; средн. (СО) |
23,40 (17,50) |
26,61 (19,98) |
0,401 |
|
ЖКПБС, мм; средн. (СО) |
24,68 (15,42) |
25,01 (11,65) |
0,900 |
|
ППМ слева, мм2; средн. (СО) |
658,25 (227,46) |
879,27 (277,53) |
<0,001 |
|
ППМ справа, мм2; средн. (СО) |
592,69 (196,29) |
813,01 (274,67) |
<0,001 |
|
ППМ сумма, мм2; средн. (СО) |
1250,95 (408,00) |
1692,28 (524,04) |
<0,001 |
|
ИСМ, мм2/м2; средн. (СО) |
704,04 (255,45) |
907,14 (248,23) |
<0,001 |
|
Саркопения, n (%) |
9 (23,7) |
1 (1,3) |
<0,001 |
Простой (однофакторный) логистический регрессионный анализ выявил следующие статистически значимые предикторные переменные: комбинированный характер операции, длительность операции, периневральная инвазия, уровень альбумина в плазме, ППМ (слева, справа, суммарная), ИСМ, саркопения (табл. 4).
С переменными, показавшими статистически значимую прогностическую ценность, проведен многофакторный логистический регрессионный анализ. В связи с тем что показатели ППМ, ИСМ и саркопения взаимосвязаны и не являются независимыми, для многофакторного регрессионного анализа была выбрана интегральная переменная «саркопения», определенная как категориальная (отсутствие или наличие), что упрощает конечную прогностическую модель.
Таблица 4
Простой (однофакторный) логистический регрессионный анализ взаимосвязей между потенциальными предикторными факторами и исходом (наличие осложнения)
|
Показатель |
В |
СО |
Вальд |
p |
ОР |
95% ДИ для ОP |
|
|
Ниж-ний |
Верх-ний |
||||||
|
Стадия по TNM |
-42,41 |
269,39 |
0,000 |
0,999 |
0,000 |
0,000 |
- |
|
Доступ |
-20,51 |
200,45 |
0,000 |
0,999 |
0,000 |
0,000 |
- |
|
Комбинированный характер операции |
-1,27 |
0,468 |
7,342 |
0,007 |
0,281 |
0,112 |
0,704 |
|
Длительность операции |
0,022 |
0,006 |
12,873 |
<0,001 |
1,022 |
1,010 |
1,035 |
|
Лимфоваскулярная инвазия |
-20,64 |
142,36 |
0,000 |
0,999 |
0,000 |
0,000 |
- |
|
Периневральная инвазия |
-2,98 |
1,042 |
8,163 |
0,004 |
0,051 |
0,007 |
0,393 |
|
Уровень альбумина в плазме |
-0,149 |
0,039 |
14,749 |
<0,001 |
0,861 |
0,798 |
0,929 |
|
ППМ слева |
-0,003 |
0,001 |
13,828 |
<0,001 |
0,997 |
0,995 |
0,998 |
|
ППМ справа |
-0,004 |
0,001 |
14,514 |
<0,001 |
0,996 |
0,994 |
0,998 |
|
ППМ сумма |
-0,002 |
0,001 |
15,093 |
<0,001 |
0,998 |
0,997 |
0,999 |
|
ИСМ |
-0,003 |
0,001 |
13,051 |
<0,001 |
0,997 |
0,995 |
0,998 |
|
Саркопения |
3,314 |
1,072 |
9,562 |
0,002 |
27,500 |
3,365 |
224,71 |
Примечания: B – коэффициенты в регрессии; СО – стандартная ошибка для коэффициента регрессии; Вальд – χ2 Вальда, проверяет нулевую гипотезу о том, что относительный риск смертельного исхода, связанный с данной переменной, равен единице; p – достигнутый уровень значимости для критерия χ2 Вальда; ОР – отношение рисков; 95% ДИ для OP – 95%-ный доверительный интервал для отношения рисков, нижний предел и верхний предел.
В результате выявлены следующие независимые факторы прогноза, влияющие на основной исход (наличие осложнения): длительность операции (ОР= 1,015 [95% ДИ: 1,002 - 1,028], p= 0,027), уровень альбумина в плазме (ОР= 8,859 [95% ДИ: 0,782 - 0,943], p= 0,001), саркопения (ОР= 7,383 [95% ДИ: 1,971 - 83,000], p= 0,012) (табл. 5).
Графики ROC-кривых для показателей сывороточного альбумина и для продолжительности операции представлены на рисунке (рис. 2). Площадь под кривой для сывороточного альбумина составила 0,747 (СО = 0,049 [95% ДИ: 0,652 – 0,843], p= 0,0001), для времени операции 0,741 (СО = 0,056 [95% ДИ: 0,631 – 0,851], p= 0,0001), что позволяет классифицировать качество полученной модели в обоих случаях как хорошее.
Таблица 5
Многофакторный логистический регрессионный анализ взаимосвязей между потенциальными предикторными факторами и исходом (наличие осложнения)
|
Показатель |
В |
СО |
Вальд |
p |
ОР |
95% ДИ для ОP |
|
|
Ниж- ний |
Верх-ний |
||||||
|
Шаг 1 |
|||||||
|
Комбинированный характер операции |
0,562 |
0,640 |
0,770 |
0,380 |
1,753 |
0,500 |
6,144 |
|
Длительность операции |
0,015 |
0,007 |
4,919 |
0,027 |
1,015 |
1,002 |
1,028 |
|
Уровень альбумина в плазме |
-0,152 |
0,048 |
10,102 |
0,001 |
0,859 |
0,782 |
0,943 |
|
Саркопения |
3,120 |
1,234 |
6,399 |
0,011 |
22,654 |
2,019 |
254,185 |
|
Шаг 2 |
|||||||
|
Длительность операции |
0,016 |
0,006 |
6,687 |
0,010 |
1,016 |
1,004 |
1,029 |
|
Уровень альбумина в плазме |
-0,154 |
0,048 |
10,517 |
0,001 |
0,857 |
0,781 |
0,941 |
|
Саркопения |
3,098 |
1,234 |
6,297 |
0,012 |
7,383 |
1,971 |
83,000 |
Примечание: обозначения те же, что и в табл. 4.
При пороге чувствительности 80% пороговое значение сывороточного альбумина при ROC-анализе составило 39,0 г/л; времени операции – 155,0 минут.
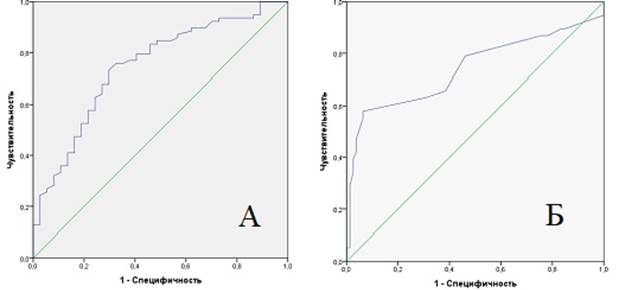
Рис. 2. ROC-кривые для уровня сывороточного альбумина (А) и продолжительности операции (Б)
Проверка пороговых значений для обоих показателей методом логистического регрессионного анализа показала статистическую значимость моделей с использованием категоризации по пороговым значениям.
Недостаточности питания, или нутритивной недостаточности (НН), у онкологических пациентов в настоящее время уделяется пристальное внимание. Клинически значимая НН встречается у 15-80% пациентов с онкологическими заболеваниями пищевода и желудка, что составляет самую большую частоту среди всех онкологических пациентов [4; 5; 20]. Показано, что наличие НН значимо ухудшает результаты всех видов лечения пациентов с РЖ, в том числе повышает частоту хирургических осложнений [21-23], негативно влияет на 5-летнюю общую и канцерспецифическую выживаемость [24-26]. В нашем исследовании, носившем ретроспективный характер, оценивались такие параметры НС, как ИМТ, уровень общего белка в плазме, уровень сывороточного альбумина. Показатели ИМТ и общего сывороточного белка не имели статистически значимой разницы у пациентов с осложненным и неосложненным течением послеоперационного периода, в то время как уровень альбумина статистически значимо ниже у пациентов с осложнениями. Эти результаты в целом соответствуют данным литературы [27-29], в связи с чем показатель сывороточного альбумина в нашем исследовании был использован для дальнейшего анализа в качестве потенциального предиктора осложненного послеоперационного периода.
Опухоли органов ЖКТ часто сопровождаются развитием кахексии и связанных с ней состояний в связи с сочетанием нутриционных нарушений и воспалительных изменений. Показано, что более чем у 1/2 пациентов с опухолями ЖКТ на момент начала лечения выявляется саркопения, или истощение скелетной мускулатуры, что объясняется сочетанием алиментарного дефицита и перестройки метаболизма пациента на фоне выделения опухолевыми клетками провоспалительных цитокинов [2; 30]. В нашем исследовании также зарегистрирована высокая частота саркопении среди пациентов с осложненным течением послеоперационного периода. В литературе появляется все больше данных о наличии корреляции между данными изменениями и неблагоприятными результатами хирургического (осложнения и летальность) и лекарственного (токсичность) лечения [30; 31]. Проведенный нами анализ в целом подтвердил имеющиеся литературные данные о взаимосвязи нутритивной недостаточности и саркопении с осложненным течением послеоперационного периода у пациентов с РЖ [9; 11; 27]. Многофакторный логистический регрессионный анализ показал, что уровень сывороточного альбумина и саркопения являются независимыми предикторами развития осложнений в послеоперационном периоде.
Продолжительность операции является показателем, отражающим сложность, травматичность операции, и непосредственно влияет на профиль безопасности пациента [32]. Показано, что увеличение времени операции связано со значительным увеличением вероятности летального исхода и серьезных осложнений после лапароскопической бариатрической хирургии, а также после эзофагэктомии [32; 33]. В нашем исследовании увеличение времени операции также показало статистически значимое влияние на прогноз осложнений в послеоперационном периоде при радикальных резекциях у пациентов с РЖ. Данный фактор необходимо также учитывать в прогнозировании течения послеоперационного периода и стремиться к сокращению продолжительности операции, особенно у пациентов с низким нутритивным статусом и наличием саркопении.
Исследование имеет определенные ограничения, главное из которых обусловлено его ретроспективным дизайном, что может приводить к появлению систематических ошибок в исследованиях «случай-контроль» в результате нерепрезентативности случаев [34]. Ретроспективный набор данных обусловил также недостаточный спектр параметров НС, которые были проанализированы в исследовании, поскольку в различные временные интервалы набор лабораторных параметров и методы их оценки были различными, в связи с чем их сравнительный анализ был бы не корректен. Кроме того, в группы «случая» и «контроля» нами отбирались только те пациенты, у которых была возможность анализа данных компьютерной томографии из баз данных, такая селекция также потенциально могла нести в себе возможность смещения результатов и систематических ошибок на этапах формирования групп и дальнейшего анализа.
Заключение. Проведенный многофакторный логистический регрессионный анализ в исследовании «случай-контроль» показал, что длительность операции (более 155 минут), уровень сывороточного альбумина (менее 39,0 г/л) и наличие саркопении являются независимыми предикторами развития осложнений после радикальных операций у пациентов с раком желудка I – III стадий. Диагностика нарушений НС и саркопении и их коррекция в предоперационном периоде, оптимизация техники операции и ведения послеоперационного периода с учетом имеющихся нарушений может являться значимым резервом улучшения непосредственных результатов хирургического лечения пациентов с раком желудка.
Библиографическая ссылка
Уваров И.Б., Асипович О.М., Дербенев С.Н., Ященко А.В., Андреев Д.В., Порханов В.А., Мануйлов А.М. ПОКАЗАТЕЛИ НУТРИТИВНОГО СТАТУСА И САРКОПЕНИЯ КАК ПРЕДИКТОРЫ ОСЛОЖНЕНИЙ ПОСЛЕ РАДИКАЛЬНЫХ ОПЕРАЦИЙ У ПАЦИЕНТОВ С РАКОМ ЖЕЛУДКА: ИССЛЕДОВАНИЕ ТИПА «СЛУЧАЙ-КОНТРОЛЬ» // Современные проблемы науки и образования. 2023. № 3. ;URL: https://science-education.ru/ru/article/view?id=32680 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32680



