Востребованность остеотропных материалов в современном мире растет с каждым годом. По данным НИИ ревматологии РАМН, в настоящее время около 2 млн пациентов нуждаются в операциях по замещению костной ткани, а общий объем рынка биоматериалов в Российской Федерации к 2025 г. должен достичь 979 млн рублей [1]. Мировой рынок растет еще более стремительно, и, если, по данным Global View Research, в 2017 г. он оценивался в 83,9 млрд долларов, то ожидается, что к 2025 г. он вырастет примерно в 3 раза – до 240 млрд долларов [2].
Столь значительная потребность в материалах для костной пластики имеет медицинскую основу. Травмы, хирургические вмешательства при опухолевых и воспалительных процессах требуют от врачей поиска новых подходов к замещению дефектов костной ткани или оптимизации процессов остеогенеза, в том числе с использованием специальных материалов [3]. Такими достаточно изученными и применяемыми материалами являются имплантируемые субстанции, изготовленные на основе фосфатов (ФК) или силикатов (СК) кальция. Керамика из ФК обладает способностью индуцировать процессы остеогенеза, так как имеет схожий с натуральной костью состав и может служить каркасом для ее восстановления [4], а нанесение покрытий из ФК, в частности гидроксиапатита (Са10(РО4)6(ОН)2) и трикальция фосфата (Са3(РО4)2), на металлоконструкции для остеосинтеза и эндопротезирования достаточно давно используется в медицинской практике, поскольку позволяет добиться достоверно лучших результатов лечения [5, 6, 7]. Помимо кальцийфосфатных материалов, широкое распространение получили биоактивные стекла, содержащие в составе оксид кремния [8, 9]. Доказано, что они обладают остеоиндуктивными свойствами и способствуют дифференцировке мультипотентных мезенхимальных стволовых клеток в остеобласты, оказывают положительное влияние на формирование основного вещества кости, тем самым стимулируя процессы репаративного остеогенеза [10].
Наряду с составом важна и форма материала, которая должна обеспечивать возможность полного заполнения костного дефекта любой конфигурации и объема. С этой точки зрения более удобны гранулированные материалы, в составе которых присутствуют частицы различных размеров [11].
Резюмируя изложенное, можно заключить, что композитные препараты, содержащие в своем составе фосфаты и силикаты кальция в виде гранул различных размеров, представляются перспективными костнопластическими материалами, требующими дальнейшего изучения.
Цель исследования – экспериментальное изучение ранних общих и местных реакций на имплантацию нового остеопластического материала, включающего различные комбинации фосфата и силиката кальция, при замещении метаэпифизарного костного дефекта.
Материалы и методы исследования
Для достижения поставленной цели необходимо было разработать экспериментальный резорбируемый материал на основе сочетания фосфатов и силикатов кальция, имплантировать его в стандартизированный посттравматический метаэпифизарный костный дефект у лабораторных животных и изучить его влияние на общие и локальные регенераторные процессы.
На первом этапе исследования на базе научной лаборатории стоматологического факультета ФГБОУ ОмГМУ Минзрава России был разработан и получен новый синтетический гранулированный материал с варьируемым содержанием фосфата и силиката кальция, а именно гидроксиапатита (Са10(РО4)6(ОН)2) и волластонита (CaSiO3), и связующего полимера – желатина (в количестве не более 20 масс.%) [2]. Макроскопически материал представляет собой набор сфер различного диаметра (от 0,2 мм до 5 мм) (рис. 1) с открытой пористостью порядка 50% и микротвердостью не менее 17 HV (микротвердость – твердость отдельных участков микроструктуры), эти данные были получены путем измерений по Виккерсу.


а б
Рис. 1. Общий вид гранул: фото образца в чашке Петри (а) и микрофотография, полученная на микроскопе «JCM-5700», JEOL (б)
Для исследования in vivo были выбраны гранулы с пропорцией гидроксиапатита к волластониту 60/40, 50/50 и 40/60 масс.% соответственно, размерами от 0,2 до 1,0 мм. Перед использованием материалы стерилизовали путем автоклавирования при температуре 120°С в течение 30 минут.
Экспериментальное исследование проводилось на 36 кроликах породы Белый великан весом 3800–4200 г с соблюдением принципов гуманности, которые изложены в директивах Европейского сообщества (86/609//ЕЕС) и Хельсинкской декларации, на основании разрешения этического комитета ОмГМУ № 128 от 03.02.2021 г. Всем животным выполнялся стандартизированный дефект метаэпифизарного отдела бедренной кости. Для этого каждому из кроликов в операционной выполнялась в/м седация путем введения препарата «Золетил» в индивидуальной дозировке. С использованием циркулярной пилы в дистальном метаэфипизе бедренной кости формировался прямоугольный дефект кортикального слоя размером 10х5 мм. При помощи инструментария кортикальная пластинка «вдавлена» на глубину до 8 мм (объем сформированной полости составил 400±4 мм3), далее при помощи элеватора выполнялся подъем костного фрагмента, впоследствии, в зависимости от исследуемой группы, в сформированную полость помещался синтетический материал либо зона оставалась интактной. Кортикальная пластинка фиксировалась в материнское ложе, мягкие ткани послойно ушивались (рис. 2).
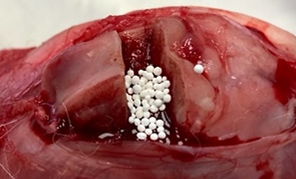
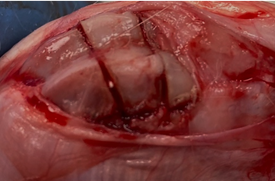
а б
Рис. 2. Вид метаэпифизарного костного дефекта: а – после имплантации биоактивных гранул; б – после закрытия костной полости кортикальной пластинкой
Экспериментальные животные были разделены на 4 группы (по 9 животных в каждой) в зависимости от выбранного соотношения фосфатов и силикатов кальция: 1-я группа (контрольная) – зона дефекта не замещалась материалом, 2-я группа – в зону перелома имплантировался материал, в своем составе содержащий фосфаты и силикаты кальция в соотношении 60/40 масс.% соответственно, 3-я группа – в зону смоделированного дефекта имплантировался материал, в своем составе содержащий фосфаты и силикаты кальция в соотношении 50/50 масс.% соответственно, 4-я группа – в зону перелома имплантировался материал, в своем составе содержащий фосфаты и силикаты кальция в соотношении 40/60 масс.% соответственно.
После моделирования костного дефекта животные находились под ежедневным контролем клинического статуса: оценивались их общее состояние, сохранение аппетита и жажды, температура тела per rectum, опороспособность конечности, заживление послеоперационной раны, наличие или отсутствие отека, гиперемии, повышение локальной температуры оперированной конечности. Лабораторные исследования сыворотки крови всех групп животных выполнялись на 7-е, 14-е и 30-сутки. При биохимическом исследовании крови были проанализированы уровень кальция, фосфора и щелочной фосфатазы, WBC, СРБ. Реакцию костной ткани на имплантацию и динамику репаративных процессов контролировали выполнением рентгенологического исследования на аппарате Toshiba Radrex и мультиспиральной компьютерной томографией (МСКТ), выполненной на аппарате Toshiba Aquilion CXL 128, в сроки 1-е, 14-е и 30-е сутки после операции.
Для забора морфологического материала животные выводились из эксперимента на 14-е и 30-е сутки. С помощью медицинского инструментария и фрезы резецировалась метаэпифизарная часть бедренной кости, включающая область экспериментального костного дефекта. Полученные костные фрагменты помещали в 10%-ный раствор формалина, декальцинировали в 5%-ном растворе азотной кислоты и обезвоживали в спиртах возрастающей крепости (от 60° до 96°), а также в смеси этилового спирта с диэтиловым эфиром (в соотношении 1:1). В последующем образцы заливали в целлоидин, уплотняли под парами хлороформа, после чего из полученных блоков изготавливали срезы толщиной 7–10 мкм, которые окрашивали гематоксилином и эозином и исследовали под микроскопом «XSZ 158T».
При статистическом анализе использовали программные пакеты Microsoft Excel XP и Statsoft Statistica v.10. Сравнение групп лабораторных животных проводили с использованием t-критерия Стьюдента с уровнем достоверности р<0,05. Полученные данные каждой группы оценивали при помощи критерия Шапиро–Уилка; результаты анализа приближаются к 1, то есть данные можно считать достоверными.
Результаты исследования и их обсуждение
Наиболее значимые изменения в клиническом статусе животных были зафиксированы в период с 1-е по 6-е сутки. В 1-е сутки после моделирования дефекта и установки биоактивного материала животные всех исследуемых групп оставались вялыми, мало двигались, не опирались на оперированную конечность. Были зафиксированы снижение аппетита, увеличение потребления жидкости (до 500 мл), средняя температура тела у животных составила 40,03±0,08°C (в норме температура тела составляет 39,0°C), а среднее значение локальной температуры оперированной конечности – 40,5±0,1°С. У всех животных отмечались местная гиперемия, отечность и болезненная реакция на пальпацию оперированной конечности. На 2-е сутки у животных сохранялись снижение аппетита, болевая реакция, однако зона гиперемии уменьшалась, повысилась активность и восстановилась частичная опороспособность. Среднее значение температуры у животных составило 39,8±0,1°С, местной – 40,2±0,1°С. На 3-и сутки у животных восстановились аппетит и двигательная активность, жажда снизилась (объем потребляемой жидкости – 350 мл). Местный отек и болевая чувствительность не регистрировались. Среднее значение температуры тела составило 39,4±0,2°С, местной – 39,6±0,2°С. К 5-м суткам после операции фиксировали только незначительное повышение местной температуры конечности – 39,2±0,1°С, остальные показатели клинического статуса вернулись к дооперационным, с 6-х суток отмечалось полное восстановление клинического статуса у животных всех наблюдаемых групп.
Результаты лабораторных исследований свидетельствовали об однотипной стойкой тенденции к повышению биохимических показателей кальция, фосфора и щелочной фосфатазы в сыворотке крови у всех групп оперированных животных, что подтверждает активацию процессов регенерации. Интегрированные результаты биохимических исследований представлены в таблице.
Некоторые биохимические показатели сыворотки крови у экспериментальных животных в ранние сроки после имплантации
|
Показатель сыворотки крови |
До операции |
Сутки после моделирования дефекта |
Референтный интервал |
||
|
7-е |
14-е |
30-е |
|
||
|
Кальций, mmol\l |
1,60±0,08 |
2,6±0,1 |
3,3±0,1 |
1,9±0,3 |
1,4–3,1 |
|
Фосфор, mmol\l |
1,5±0,1 |
2,0±0,2 |
2,4±0,2 |
2,0±0,6 |
1,3–2,2 |
|
Щелочная фосфатаза, u/l |
7,0±1,2 |
11,8±0,5 |
18,3±0,6 |
12,7±0,3 |
4,1–16,2 |
|
WBC х109/l |
3,5±0,5 |
10,2±0,7 |
6,4±0.3 |
4,1±0,4 |
3,3–11,1 |
|
СРБ mg/l |
0,08±0,08 |
0,76±0,18 |
0,39±0,09 |
0,10±0,03 |
0,08–1,02 |
Полученные результаты свидетельствуют о том, что на протяжении первого месяца эксперимента значения концентраций кальция, фосфора и активности щелочной фосфатазы превышали исходные и референтные значения. К 7-м суткам отмечалось абсолютное увеличение концентрации кальция на 15,4%, фосфора – на 5%, ЩФ – на 23%; на 14-е сутки концентрации кальция были выше на 12,1%, фосфора – на 4,2%, ЩФ – на 12%, на 30-е сутки количества кальция, фосфора, активность щелочной фосфатазы, WBC и СРБ уже находились в границах физиологической нормы. Статистически достоверной разницы при использовании имплантатов с различными массовыми соотношениями фосфата и силиката кальция выявлено не было.
На 14-е сутки выполнялись контрольная рентгенография оперированной конечности в прямой и боковой проекциях, а также МСКТ-исследование, которые подтвердили, что имплантированные гранулы у животных всех экспериментальных групп полностью заполняли послеоперационный костный дефект, миграции гранул не произошло, патологической периостальной реакции, новых зон резорбции костной ткани выявлено не было.
К 30-м суткам после операции наибольшая выраженность остеопластического процесса была отмечена во 2-й экспериментальной группе, где зона дефекта заполнялась материалом, содержащим фосфаты и силикаты кальция в соотношении 60 к 40 масс% соответственно. По данным рентгенографии в посттравматическом костном дефекте у животных этой группы были отмечены признаки резорбции и трансформации имплантированного материала в новообразованную костную ткань. Кроме того, имелись отчетливые признаки сращения остеотомированной кортикальной пластинки бедренной кости с материнским ложем за счет развития костно-пластических процессов в зоне самого посттравматического дефекта (рис. 3).
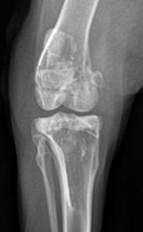
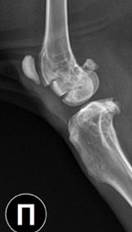
а) б)
Рис. 3. Вид метаэпифизарного костного дефекта на 30-е сутки эксперимента: а – передне-задняя проекция: б – боковая проекция
МСКТ-картина подтверждала полученные клинические и рентгенологические данные. В зоне имплантации остеогенного материала формировалась костная ткань неравномерной плотности, заполняющая посттравматический дефект и имеющая в ряде отделов интимную связь с кортикальным слоем кости. В этих же отделах выявлялись элементы гипертрофической реакции надкостницы и периостальной костной мозоли. В некоторых сканах в отдельных участках костного дефекта, вероятно, в связи с преобладанием рубцовой соединительной ткани, визуализировались отграниченные от интактной кости «пустые» зоны с формированием небольших полостей и начинающимся остеосклерозом их стенок (рис. 4).
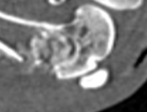
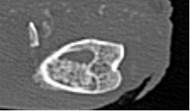
а) б)
Рис. 4. МСКТ срезы метаэпифизарного костного дефекта на 30-е сутки эксперимента: а – сагиттальный срез; б – коронарный срез
Измерение плотности новообразованной ткани в единицах Хаунсфилда (рис. 5) показало, что в зоне имплантируемого вещества к 30-м суткам эксперимента наблюдалось формирование костной ткани, схожей по плотности с окружающей метафизарной костью и соответствующей плотности кости не оперированной контрлатеральной конечности (HU = 250–400 Ед).

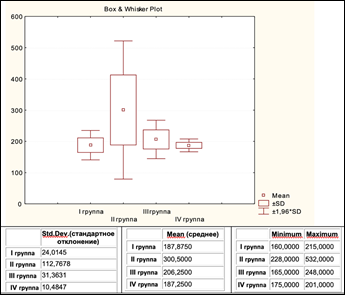
Рис. 5. Распределение плотности новообразованной костной ткани (Hu) в экспериментальных группах
Наибольший разброс показателей плотности, но и наибольшая средняя плотность костного регенерата были зарегистрированы у животных 2-й экспериментальной группы, что, вероятно, свидетельствовало о большей активности репаративных процессов при использовании имплантируемого материала с соотношением фосфата и силиката кальция 60 к 40 масс%.
Гистологическое исследование показало, что в опытных группах, где были имплантированы материалы, имеющие в составе фосфаты и силикаты кальция в соотношении 40 к 60 и 50 к 50 масс%, к 30-м суткам после операции локальная картина была однотипной. В костном дефекте обнаруживались неструктурированные фрагменты имплантируемого материала различной формы и величины с отсутствием макрофагальной реакции. Сам дефект был преимущественно заполнен нежно-волокнистой соединительной тканью с новообразованными полнокровными сосудами капиллярного типа, на границе дефекта и интактной кости определялись единичные активные остеобласты. Иная картина наблюдалась в гистологических образцах 2-й группы при использовании соотношения фосфатов и силикатов кальция в 60 к 40 масс% (рис. 6).
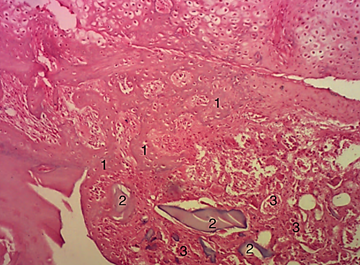
Рис. 6. Гистологический препарат новообразованной костной ткани после имплантации гранул в соотношении 60/40 масс% ФК/СК: 1 – новообразованная кость; 2 – включения имплантируемого вещества; 3 – новообразованные сосуды
Кроме заполняющего дефект массива малодифференцированной соединительной ткани с множественными кровеносными сосудами различных размеров и фрагментами имплантированного материала, визуализировались формирующиеся костные трабекулы, образовывающие среднеячеистую губчатую кость, в межтрабекулярных промежутках которой соединительная ткань приобретала более организованную структуру.
Таким образом, проведенное исследование показало, что использование имплантируемого биодеградируемого материала на основе сочетания фосфатов и силикатов кальция имеет ряд положительных качеств и в отношении переносимости, и в отношении остеоиндуктивности. Первое подтверждалось отсутствием патологических реакций, признаков системного и местного активного воспалительного процесса в раннем и средне-срочном периодах после имплантации. Более того, после заполнения дефекта произошло достаточно быстрое (в течение первых 6 суток) возобновление активности лабораторных животных с восстановлением опороспособности конечности, отмечалось первичное заживление послеоперационной раны с отсутствием признаков продолжительной экссудации. Лабораторные показатели общего анализа крови, СРБ в течение первых 10 суток вернулись к референтным значениям.
Наиболее важной задачей исследования являлось выяснение регенераторного потенциала имплантируемого материала при различных сочетаниях в нем фосфата и силиката кальция. Литературные данные свидетельствуют, что для оптимизации процессов остеогенеза в основном используют материалы, имеющие в своем составе исключительно фосфаты кальция [5, 2, 12] в различных формах, размерах и сочетаниях (с металлами, органическими компонентами и пр.). В зарубежной литературе имеются данные о синтезировании высокотемпературной керамики, сочетающей в себе фосфаты и силикаты кальция в различных пропорциях, но основными недостатками данных веществ являются высокая плотность и отсутствие пористости поверхности, что препятствует процессам активного роста и интеграции новообразованной костной ткани [12]. Однако в ряде исследований показано существенное стимулирующее влияние ионов кремния на процессы остеогенеза, которое носит волнообразный характер и наиболее активно проявляется в процессе минерализации. Было установлено, что на ранних стадиях роста остеоидной ткани содержание в ней кремния крайне невелико, однако с созреванием каллуса его количество постепенно нарастает, достигая более чем 200% от исходного. Методом рентгеноспектрального анализа обнаружено, что в этот период кремний присутствует в участках роста молодой кости и в составе остеобластов в количествах, близких к содержанию кальция, фосфора и магния [9]. В дальнейшем, по мере увеличения в новообразованной кости концентрации кальция до соответствующего зрелому костному апатиту, уровень кремния снова снижается до минимума [3, 2, 13].
В проведенном нами экспериментальном исследовании получены комплексные данные, позволяющие прийти к заключению о перспективности симультанного использования фосфатов и силикатов кальция для замещения костных дефектов. Это подтвердили и данные биохимического исследования крови (повышение значений концентраций кальция, фосфора и активности щелочной фосфатазы), и результаты рентгенологических методов визуализации, отмечающих, что уже к 30-м суткам в зоне имплантации формировалась костная ткань, заполняющая полость сформированного дефекта, с неравномерной, но достаточно высокой средней плотностью в 300,5 ед. Хаунсфилда. Гистологическое исследование подтвердило активацию процессов остеогенеза в зоне костного дефекта с биодеградацией искусственного материала и преимущественным замещением его новообразованной трабекулярной костной тканью. Проводя сравнение и анализ полученных результатов, необходимо отметить, что наибольший потенциал регенераторного воздействия в ранние сроки показала имплантация гранул материала, сочетающего в своем составе фосфаты и силикаты кальция в соотношении 60/40 масс%.
Заключение
По результатам проведенного экспериментального исследования нами было установлено, что предлагаемый синтетический материал не вызывает патологических общих и локальных реакций на имплантацию, а использование комбинации фосфатов и силикатов кальция с целью стимуляции и оптимизации процессов репаративного остеогенеза в соотношении 60/40 масс% соответственно показало лучшие первичные результаты восполнения метаэпифизарного костного дефекта, в отличие от других дозировок, что было подтверждено клиническими, рентгенологическими и гистологическими методами исследования. Таким образом, полученные данные демонстрируют целесообразность дальнейшего изучения механизмов и эффективности применения новых биоактивных имплантатов для замещения дефектов костной ткани.
Библиографическая ссылка
Рождественский А.А., Дзюба Г.Г., Ерофеев С.А., Солоненко А.П., Шевченко А.Е., Кузовкин А.Н., Ештокин Д.И., Чернигова С.В., Дочилова Е.С., Рождественский А.С. ПЕРВЫЕ РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТАЛЬНОГО ПРИМЕНЕНИЯ СИНТЕТИЧЕСКОГО МАТЕРИАЛА НА ОСНОВЕ СМЕСИ ФОСФАТА И СИЛИКАТА КАЛЬЦИЯ С ЦЕЛЬЮ ЗАМЕЩЕНИЯ КОСТНЫХ ДЕФЕКТОВ // Современные проблемы науки и образования. 2022. № 3. ;URL: https://science-education.ru/ru/article/view?id=31828 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/spno.31828



