Проблема гиподинамии в современном обществе стоит особенно остро. Согласно данным Всемирной организации здравоохранения, гиподинамия и адинамия представляют собой настоящую пандемию, ежегодно затрагивающую огромное количество населения разного пола, возраста и социального статуса. Борьба с гиподинамией ведется постоянно, в первую очередь за счет популяризации физкультуры и спорта высоких достижений [1]. Имеющиеся в настоящий момент данные показывают, что умеренные физические нагрузки могут успешно препятствовать возникающим при гиподинамии патологическим изменениям в организме. Однако по мере прогрессирования и улучшения спортивных результатов неизбежно развитие физического и психологического истощения, что, в свою очередь, приводит к функциональному спаду. С уменьшением эффективности тренировок сталкиваются как профессиональные спортсмены, так и спортсмены-любители. В связи с этим все большее значение приобретают методы и техники, позволяющие отсрочить наступление функционального спада, среди которых особенно выделяются фармакотерапевтические подходы. На сегодняшний день фармакология спорта – одно из стремительно развивающихся направлений медицинской науки, позволяющее поддерживать достигнутый уровень тренированности в оптимальном диапазоне [2]. Над этим работают различные специалисты. Для сохранения спортивного результата возможно использование лекарственных препаратов, относящихся к различным фармакотерапевтическим группам. Наиболее широко применяются средства адаптогенного, ноотропного действия и различные метаболические стимуляторы (креатин), антиоксиданты, актопротекторы [3]. Исследования последних лет показывают, что эффективными средствами коррекции физического и психического утомления могут быть вещества, изменяющие митохондриальную функцию и таким способом модулирующие метаболизм клетки. Основой для концепции митохондриального таргетинга в спортивной медицине послужили фундаментальные исследования патогенеза мышечного утомления. D. Constantin-Teodosiu et al., 2021, было показано, что как временное, так и хроническое мышечное утомление может быть связано с угнетением митохондриального биогенеза, сопровождаемого активацией гликолиза, накоплением лактата и истощением пула АТФ [4]. Снижение биогенеза митохондрий не только негативно отражается на энергообеспечении клетки, но и может выступать триггером иных патогенетических путей мышечного утомления, таких как окислительный стресс, апоптоз поперечно-полосатых миоцитов, гиперцитокиновый каскад и инсулинорезистентность [5]. В связи с этим логично предположить, что применение средств, увеличивающих митохондриальный биогенез, может благоприятно отражаться на функциональном состоянии скелетной мускулатуры. Ранее проведенные исследования показали, что производные хромона обладают митохондриоориентированным действием и способностью к модуляции метаболического статуса клетки [6], в связи с чем именно дериваты хромона были выбраны в качестве анализируемых соединений в данном исследовании.
Цель исследования. Оценить изменение митохондриального биогенеза на фоне введения новых производных хромона в условиях хронического мышечного утомления.
Материалы и методы исследования
Работа выполнена на 80 мышах-самцах Balb/c с массой тела 20–22 г. Животные были приобретены у питомника лабораторных животных «Рапполово» и во время эксперимента содержались в полипропиленовых боксах по 5 особей в контролируемых условиях окружающей среды: температура воздуха 20±20С, влажность воздуха 55–65%, суточный цикл 12 часов день / 12 часов ночь. Обращение с лабораторными животными и их содержание соответствовали требованиям Директивы 2010/63/EU Европейского Парламента и Совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях.
Мышечное утомление воспроизводили у мышей методом «принудительного плавания с отягощением». Перед началом эксперимента животных взвешивали с точностью до 1,0 г и вычисляли массу нагрузки, равную 20% от массы тела животного. Груз фиксировали у основания хвоста животного. Далее мышей помещали в акриловый цилиндр с высотой стенок 0,3 м и диметром 0,15 м, заполненный водой с температурой 150С, фиксировали время плавания (в секундах) до полного истощения (за полное истощение принималось нахождение животного на дне бассейна без попыток всплытия на протяжении 10 секунд) [7]. На основании полученных результатов мышей рандомизировали на равные группы по 10 особей: группа интактных животных (ИН), группа негативного контроля (НК), группа мышей, которым вводили препарат сравнения – этилтиобензимидазол («Метапрот», Россия) в дозе 25 мг/кг [7], и группы животных, получавших исследуемые соединения под шифрами 3FC1, 3FC2, 3FC3, 3FC4 и 3FC5 в дозе 40 мг/кг [6]. После формирования экспериментальных групп повторно воспроизводили процедуру «принудительного плавания» (интактных мышей тестировали группами по 3, 3 и 4 особи соответственно). Плавание продолжалось на протяжении 10 дней (1 процедура в сутки). Исследуемые соединения и референс-препарат вводили per os за 60 мин до «принудительного плавания», при этом НК группа животных получала воду очищенную в эквивалентном объеме. На 11-й день эксперимента животных декапитировали под хлоралгидратной анестезией (350 мг/кг, интаперитонеально) и осуществляли забор четырехглавой мышцы бедра (m.quadriceps femoris). Мышечную ткань гомогенизировали в механическом гомогенизаторе Поттера в буферной системе с рН 7,2, состоящей из 1 ммоль/л ЭГТА, 215 ммоль/л маннита, 75 ммоль/л сахарозы, 0,1%-ного раствора бычьего сывороточного альбумина, 20 ммоль/л HEPES. Полученный гомогенат центрифугировали при 1400 g на протяжении 3 мин, после чего полученный супернатант переносили в пробирки типа «Эппендорф» и повторно центрифугировали при 18000 g на протяжении 10 минут. Полученный вторичный супернатант отбрасывали, осадок ресуспендировали в 0,5 мл изолирующего буфера и удаляли для проведения анализа [7]. В полученном биоматериале оценивали интенсивность митохондриального биогенеза путем определения активности сукцинатдегидрогеназы и цитохром-с-оксидазы.
Активность сукцинатдегидрогеназы определяли спектрофотометрически в реакции восстановления дихлорфенолиндофенола в среде, содержащей ротенон и сукцинат. Оптическую плотность регистрировали при 600 нм. [8]. Активность цитохром-с-оксидазы оценивали в ходе реакции окисления цитохрома С (II) при добавлении в анализируемую среду калия цианида [9].Оптическую плотность полученной смеси определяли при 500 нм.
Спектрофотометрический анализ выполнен с использованием системы УФ-спектрофотометра ПРОМЭКОЛАБ – ПЭ-5300В в кюветах с длиной оптического пути 1,0 см. Активность ферментов выражали в единицах действия (Ед) в пересчете на концентрацию белка в образце (мг белка). Содержание белка определяли методом Бредфорда.
Полученные результаты обрабатывали методами вариационной статистики. В ходе статистического анализа использовали пакет прикладных программ STATISTICA 6.0. (StatSoft, США). Нормальность распределения данных оценивали с применением теста Шапиро–Уилка. Однородность дисперсий определяли тестом Левена. Статистически значимые отличия между группами оценивали методом однофакторного дисперсионного анализа с пост-тестом Ньюмена–Кейлса (при нормальном распределении данных) или пост-тестом Краскелла–Уоллиса (при распределении данных, отличном от нормального) при критическом уровне значимости р<0,05.
Результаты исследования и их обсуждение
Анализ изменения продолжительности плавания (табл. 1) показал, что у НК группы мышей на всем протяжении эксперимента выносливость имела тенденцию к снижению, начиная со 2-го дня плавания с нагрузкой. В итоге к концу исследования (на 10-й день) время плавания НК группы животных было меньше аналогичного у ИН мышей на 39,5% (p<0,05). Применение референс-препарата способствовало повышению физической активности животных. Так, у мышей, которым вводили Метапрот, продолжительность плавания на всем протяжении эксперимента была статистически значимо (p<0,05) выше таковой у НК группы животных. Пик работоспособности у данной группы животных отмечен на 9-й день эксперимента, когда время плавания животных, получавших референс-препарат, было выше аналогичного у НК группы мышей на 144,0% (p<0,05). Введение изучаемых производных хромона производило эффект, сопоставимый с препаратом сравнения. Так, на фоне применения веществ под шифрами 3FC1; 3FC2; 3FC3; 3FC4 и 3FC5 физическая активность мышей превосходила таковую у НК группы животных практически на всем протяжении исследования. Пиковое значение работоспособности для данных групп мышей наблюдалось раньше, чем в случае курсового введения референс-препарата, – на 5–7-е сутки эксперимента. На пике физической активности время плавания мышей, получавших соединения 3FC1; 3FC2; 3FC3; 3FC4 и 3FC5, статистически значимо превосходило аналогичные показатели НК группы животных: на 118,1%; 141,5%; 144,4%; 108,5% и 87,4% соответственно (все показатели p<0,05). Стоит отметить, что показатели пиковой работоспособности животных, получавших исследуемые вещества и референт, статистически значимо не отличались (таблица).
Таблица 1
Влияние исследуемых соединений и препарата сравнения на изменение продолжительности плавания животных в тесте «принудительное плавание с отягощением»
|
Группа |
ИН |
НК |
Метапрот |
3FC1 |
3FC2 |
3FC3 |
3FC4 |
3FC5 |
|
День 1 |
116,21±9,63 |
113,14±14 |
110,61±14,96 |
111,51±13,2 |
118,68±9,24 |
111,01±9,57 |
116,6±7,84 |
118,57±12,98 |
|
День 2 |
111,53±8,71 |
105,47±9,53 |
114,67±13,01 |
122,75±11,72 |
120,09±14,11 |
126,29±11,48 |
124,29±13,24 |
127,57±8,85 |
|
День 3 |
115,1±11,05 |
92,43±8,71 |
129,39±8,33* |
151,41±10,19* |
184,66±14,93* |
182,58±7,9* |
121,46±8,59* |
120,18±9,82* |
|
День 4 |
114,21±8,47 |
80,02±14,53# |
152,82±9,73* |
140,44±8,83* |
191,93±8,96* |
167,1±13,1* |
176,7±13,85* |
133,44±8* |
|
День 5 |
114,03±8,92 |
85,98±10,61# |
168,49±11,01* |
187,5±12,55* |
179,22±10,09* |
166,88±11,93* |
158,94±7,12* |
161,11±8,26* |
|
День 6 |
119,86±13,49 |
87,8±13,12# |
162,87±14,64* |
185,02±9,18* |
180,78±10,12* |
190,76±8,37** |
183,02±10,58* |
159,83±13,94* |
|
День 7 |
116,07±9,36 |
81,41±14,43# |
168,36±13,58* |
183,15±10,25* |
190,6±11,44* |
198,98±8,35* |
173,48±10,39* |
140,45±12,25* |
|
День 8 |
119,76±11,16 |
77,82±10,18# |
147,38±7,67* |
130,96±11,56* |
167,8±11,83* |
186,84±10,54* |
146,17±8,13** |
144,3±12,77* |
|
День 9 |
118,41±10,09 |
72,89±9,78# |
177,83±13,06* |
161,77±14,88* |
176,42±14,33** |
171,09±10,12* |
177,31±12,94* |
132,65±13,26* |
|
День 10 |
113,68±7,27 |
68,77±14,02# |
156,05±12,31* |
142,38±12,66* |
160,65±10,98* |
161,69±13,4* |
115,79±14,7* |
156,32±11,8* |
Примечание: ИН – интактные животные; НК – негативный контроль; Метапрот – группа мышей, получавших Метапрот; 3FC1-3FC5 – группы мышей, получавших исследуемые соединения; # – достоверно относительно ИН группы животных (тест Краскелла–Уоллиса, p<0,05); * – достоверно относительно НК группы животных (тест Краскелла–Уоллиса, p<0,05).
Активность митохондриальных ферментов (рисунок) в мышечной ткани у НК группы уменьшилась по отношению к ИН мышам: сукцинатдегидрогеназы – на 60,9% (p<0,05), цитохром-с-оксидазы – на 70,5% (p<0,05). Применение референс-препарата не оказало значимого влияния на изменение активности анализируемых ферментов, в то время как на фоне введения исследуемых соединений каталитические свойства сукцинатдегидрогеназы и цитохром-с-оксидазы статистически значимо увеличились по отношению к НК группе животных. Так, на фоне применения соединения 3FC1 активность сукцинатдегидрогеназы и цитохром-с-оксидазы повысилась на 44% (p<0,05) и 25% (p<0,05) соответственно; соединения 3FC2 – на 56% (p<0,05) и 75%(p<0,05); 3FC3 – на 80% (p<0,05) и 96,4%(p<0,05); 3FC4 – на 24% (p<0,05) и 39,2% (p<0,05) и соединения 3FC5 – на 32% (p<0,05) и 42,9% (p<0,05) соответственно. Стоит отметить, что активность митохондриальных ферментов у животных, получавших анализируемые вещества, была выше, чем у группы мышей, которой вводили референт (p<0,05).
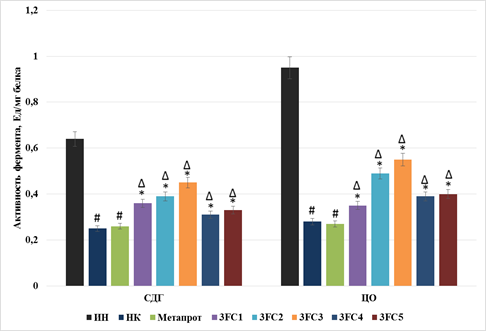
Влияние исследуемых соединений и референс-препарата на изменение активности митохондриальных ферментов в мышечной ткани животных в условиях теста «принудительное плавание с отягощением»
Примечание: СДГ – сукцинатдегидрогеназа; ЦО – цитохром-с-оксидаза; ИН – интактные животные; НК – негативный контроль; Метапрот – группа мышей, получавших Метапрот; 3FC1-3FC5 – группы мышей, получавших исследуемые соединения; # – достоверно относительно ИН группы животных (тест Ньюмена–Кейлса, p<0,05); * – достоверно относительно НК группы животных (тест Ньюмена–Кейлса, p<0,05); Δ – достоверно относительно группы животных, которой вводили Метапрот (тест Ньюмена–Кейлса, p<0,05)
Полученные изменения свидетельствуют, что у животных в условиях истощающих физических нагрузок снижаются реакции митохондриального биогенеза, что может привести к метаболическому сдвигу в пользу анаэробных реакций обмена с резким падением уровня работоспособности. Применение референс-препарата способствовало восстановлению физической активности животных, но при этом для используемого в работе референта не было отмечено значимого влияния на изменение активности ферментов митохондриального происхождения. В то же время применение исследуемых производных хромона статистически значимо повышало активность как сукцинатдегидрогеназы, так и цитохром-с-оксидазы, что сопровождалось сопоставимым с референтом ростом физической активности мышей. Таким образом, можно предположить, что референс-препарат и изучаемые дериваты хромона действуют на разных уровнях регуляции метаболического состояния клетки. Метапрот известен как активатор синтеза РНК и соответствующих ферментов глюконеогенеза, который не оказывает прямого действия на изменение митохондриальной функции [10], тогда как производные хромона, напротив, улучшают внутриклеточный синтез макроэргов посредством повышения биогенеза митохондрий и соответственно повышения их активности.
Выводы
Курсовое применение производных хромона приводит к повышению физической активности животных в условиях теста «принудительное плавание с отягощением» в степени, сопоставимой с референс-препаратом – Метапротом. При этом основой для реализации фармакологического эффекта дериватов хромона может служить повышение митохондриального биогенеза и соответственно увеличение внутриклеточного пула макроэргических соединений при дефиците кислорода.
Библиографическая ссылка
Поздняков Д.И., Руковицина В.М., Олохова Е.А., Саркисян К.Х. ПОВЫШЕНИЕ МИТОХОНДРИАЛЬНОГО БИОГЕНЕЗА КАК ОДИН ИЗ АСПЕКТОВ АКТОПРОТЕКТОРНОГО ДЕЙСТВИЯ ПРОИЗВОДНЫХ ХРОМОНА. ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ // Современные проблемы науки и образования. 2022. № 3. ;URL: https://science-education.ru/ru/article/view?id=31773 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31773



