Оперативное вмешательство, как и любое другое повреждение, сопровождается рядом реакций, включающих высвобождение стрессовых гормонов и медиаторов воспаления, ведущее к формированию синдрома системной воспалительной реакции. Нейроэндокринный компонент хирургического стресс-ответа проявляется в увеличении секреции адренокортикотропного гормона, кортизола и адреналина [1]. Как правило, уровень и продолжительность повышения интра- и послеоперационных концентраций кортизола пропорциональны степени хирургической травмы [2]. Интраоперационная гипергликемия является результатом активации симпатоадреналовой системы, повышения уровня катехоламинов и глюкокортикоидов в плазме крови [1]. Повышение уровня гормонов стресса считается нежелательным, поскольку это сопровождается усилением послеоперационного катаболизма и гемодинамической нестабильностью [1].
Иммунный компонент ответной реакции представляет собой массивное высвобождение медиаторов воспаления (ИЛ-1, ИЛ-6, ФНО-α) и активацию иммунокомпетентных клеток [3]. Рост цитокинов отражает травматичность хирургического вмешательства, и она, в частности, значительно выражена при протезировании суставов [4]. При данных операциях концентрация цитокинов достигает максимума к 1-м суткам и остается повышенной на протяжении 48–72 ч после операции [2]. Повышение уровня ИЛ-6 способствует увеличению выработки в печени СРБ, специфической дифференцировке наивных CD4+Т-клеток и стимуляции выработки антител [5]. Однако избыточное высвобождение медиаторов воспаления может усугублять процессы тканевого повреждения [2]. Также ИЛ-6 способен вызывать сенситизацию как периферического, так и центрального звена ноцицептивной нервной системы, т.е. усиливать интенсивность послеоперационного болевого синдрома [2].
Частота перипротезных инфекций после первичного эндопротезирования тазобедренного сустава составляет от 0,3% до 3,0% [6]. Для лечения перипротезной инфекции тазобедренного сустава применяется ревизионное эндопротезирование с установкой артикулирующего спейсера. Присутствие у пациентов перипротезной инфекции обусловливает интоксикацию, нарушение нутритивного статуса и усугубление существующих соматических заболеваний. Воспаление приводит к сокращению жизни эритроцитов и их повышенному разрушению, что обусловливает наличие анемии.
Исходя из вышеизложенного перед анестезиологом стоит выбор методики анестезии, способной модулировать хирургический стресс-ответ и, как следствие, минимально влияющей на иммунные реакции. Общая анестезия оказывает минимальное влияние на хирургический стресс-ответ и ограничена временем операции [3]. Выраженным модулирующим действием на хирургический стресс-ответ обладают нейроаксиальные методы анестезии [1; 3]. Согласно исследованию А.В. Марочкова и соавторов, у пациентов при операциях на нижних конечностях с использованием спинальной анестезии и эффективным обезболиванием в послеоперационном периоде содержание сывороточного кортизола до, во время и после операции не изменялось [7]. Зарубежные исследования также демонстрируют, что уровень кортизола в сыворотке крови в периоперационном периоде в группе спинальной анестезии был значительно ниже по сравнению с группой общей анестезии при проведении операций на нижнем и верхнем этажах брюшной полости [1].
Существуют противоречивые данные исследований о влиянии метода анестезии на воспалительный компонент хирургического стресс-ответа. По одним исследованиям, использование спинальной анестезии по сравнению с общей сопровождается меньшим повышением уровня провоспалительных цитокинов (ИЛ-6, ФНО-α) [8]. Сочетанная эпидуральная анестезия по сравнению с общей анестезией эффективнее для сохранения послеоперационной иммунной функции и обеспечения лучшего контроля боли в периоперационном периоде [9]. Однако результаты метаанализа A. Alhayyan, 2019, свидетельствуют о том, что применение эпидуральной анестезии в сочетании с общей анестезией по сравнению только с общей анестезией не оказывает существенного влияния ни на уровень ИЛ-6, ни на СРБ в послеоперационном периоде [10]. В большинстве исследований, включенных в метаанализ, не сообщалось о существенной разнице в величине послеоперационной системной воспалительной реакции при сравнении различных методов общей и регионарной анестезии. Поэтому актуальным остается поиск метода анестезии, оказывающего модулирующее действие на хирургический стресс-ответ и иммунную функцию при травматичных ортопедических вмешательствах, в том числе у пациентов с хроническим воспалительным процессом.
Цель исследования: изучить влияние общей и комбинированной спинально-эпидуральной анестезии при ревизионных операциях у больных с перипротезной инфекцией тазобедренного сустава на показатели хирургического стресс-ответа и гуморального иммунитета.
Материалы и методы исследования
Проведенное открытое проспективное рандомизированное исследование было одобрено локальным этическим комитетом университетской клиники ФГБОУ ВО «ПИМУ» Минздрава России. В исследование после получения письменного информированного согласия были включены 26 пациентов (9 женщин и 17 мужчин). Средний возраст пациентов составил 53,05 (29;75) года. Критериями исключения были: пациенты с диагнозами «сепсис», «септический шок», «сахарный диабет», «ВИЧ-инфекция» или «сифилис» любой стадии, активное злокачественное заболевание, наличие системных заболеваний соединительной ткани, сопутствующая декомпенсированная хроническая патология печени или почек. Все больные проходили лечение в отделении гнойной остеологии по поводу перипротезной инфекции тазобедренного сустава. Больным выполняли оперативные вмешательства ревизионного протезирования с заменой всех компонентов протеза. Время оперативного вмешательства составляло 1,5–2,5 часа. Рандомизация проводилась методом конвертов.
Пациентам группы 1 проводили общую анестезию (ОА) – индукция пропофол 2 мг/кг, фентанил 2 мкг/кг, миорелаксация – рокуроний 0,5–0,6 мг/кг для интубации трахеи. Далее продолжали ингаляционную анестезию севофлураном с МАК 0,5–1 с болюсным введением фентанила в дозе 50–100 мкг перед разрезом и травматичными этапами операции. Контроль глубины анестезии осуществлялся с помощью BIS мониторинга с подержанием индекса в пределах значений от 40 до 60. По завершении операции больных переводили в реанимационное отделение, где для обезболивания использовали НПВС (кетонал 5% 2 мл в/м) и тримепередин (промедол) 2% 1 мл в/м по требованию.
Пациентам группы 2 операции выполняли под комбинированной спинально-эпидуральной анестезией (КСЭА). Перед выполнением пункции для седации использовали мидазолам 0,5% 2,5–5 мг. На уровне LI–LII выполняли пункцию эпидурального пространства иглой 18 G методом потери сопротивления с последующим введением эпидурального катетера (B. Braun, Германия). После катетеризации эпидурального пространства проводили аспирационную пробу, при отрицательном результате в эпидуральный катетер вводили 4 мл 2%-ного лидокаина через предварительно заполненный бактериальный фильтр. При отсутствии признаков развития спинальной блокады через 5–10 мин выполняли пункцию субарахноидального пространства на уровне LIII–LIV. Для спинальной анестезии применяли маркаин спинал 0,5% (Cenexi, Франция), блокосс 0,5% (Сотекс, Россия). У всех больных развивался выраженный моторный блок на стороне операции – 4 балла по шкале Bromage, уровень сенсорной блокады обычно достигал уровня Th X. После интратекального введения препарата на область пункции эпидурального пространства клеилась асептическая наклейка (Tegaderm Film, 3M, США). Седация в течение операции проводилась мидазоламом 0,5% дробно и инфузией 1%-ного пропофола со скоростью 1–2 мг/кг/час для достижения уровня легкой седации по RAAS. Во время оперативного вмешательства введения местных анестетиков в эпидуральный катетер не требовалось. По окончании операции пациентов переводили в реанимационное отделение, где проводили эпидуральное обезболивание 0,2%-ным раствором ропивакаина со скоростью 2–4 мл/час через инфузомат. Также в послеоперационном периоде для обезболивания по требованию использовали промедол и кетонал в/м. После перевода в отделение эпидуральное обезболивание продолжали 0,2%-ным ропивакаином при помощи инфузионных помп со скоростью 4 мл/час в течение 2 суток. Каждый день проводили контроль целостности асептической наклейки и осмотр больного. За время наблюдения ни у одного из больных не отмечалось жалоб на болезненность в месте пункции или симптомов неврологических нарушений. В послеоперационном периоде все больные продолжали получать плановую антибактериальную терапию и низкомолекулярные гепарины.
Оценивались показатели хирургического стресс-ответа (кортизол, ИЛ-6, глюкоза крови), гуморального иммунитета (IgA, IgM, IgG), концентрации транстиретина и интенсивность болевого синдрома по визуально-аналоговой шкале (ВАШ). Забор крови производили утром в день операции до начала анестезии, затем после удаления всех компонентов протеза и далее на утро 1-х, 3-х, 5-х и 7-х суток после операции. Выраженность болевого синдрома по шкале ВАШ оценивали по 100-балльной шкале на 1-е, 3-и, 5-е и 7-е сутки после операции.
Концентрацию кортизола определяли методом твердофазного иммуноферментного анализа с использованием тест-систем «Алкор Био» согласно прилагаемой инструкции. Измеренияпроводилипри длине волны 450 нмна спектрофотометре Tecan infinite f50. Результаты выражали в нмоль/л. За показатели нормы принимали значения, указанные производителем.
Концентрацию ИЛ-6 определяли методом твердофазного иммуноферментного анализас использованием тест-систем «Вектор Бест» согласно прилагаемой инструкции. Измеренияпроводилив двухволновом режиме: при основной длиневолны 450 нми длине волны сравнения 620 нм на спектрофотометре Tecan infinite f50. Результаты выражали в пг/мл. За показатели нормы принимали значения, указанные производителем.
Определение иммуноглобулинов основных классов проводили методом радиальной иммунодиффузии по Манчини с помощью наборов реагентов «Моно-РИД-G, A, M» производства «МикроГен» согласно прилагаемой инструкции. Результаты выражали в г/л. Определение концентрации транстиретина проводили иммунотурбидиметрическим методом с использованием реагентов фирмы DiaSys (Германия). Определение концентрации глюкозы проводили глюкозоксидазным методом с использованием реагентов BioSystems (Испания) на биохимическом анализаторе Ilab 650 (США).
Статистическую обработку полученных данных проводили с помощью пакета программ SPSS-Statistics. Распределения в группах сравнивались с помощью U-критерия Манна–Уитни для независимых выборок. Уровень статистической значимости принимали равным 0,05, результаты описаны как M±σ.
Результаты исследования и их обсуждение
В обеих группах показатели среднего значения кортизола крови в течение всего исследования были в пределах референтных значений (150–660 нмоль/л). До начала операции статистически значимых различий между группами не было: в группе ОА средний показатель концентрации кортизола крови составлял 389,85±84,87 нмоль/л, в группе КСЭА – 413,39±87,23 нмоль/л. После удаления компонентов протеза в группе ОА наблюдалось статистически значимое повышение этого показателя (p<0,05) до 599,36±172,22 нмоль/л (рис. 1). В группе КСЭА на этом этапе операции показатель составил 395,32±278,69 нмоль/л, повышение было статистически незначимым. Показатель среднего значения уровня кортизола крови после удаления компонентов протеза статистически значимо различался между группами (p<0,05). Также статистически значимые отличия между группами наблюдались на 3-и и 5-е сутки исследования (p<0,05).
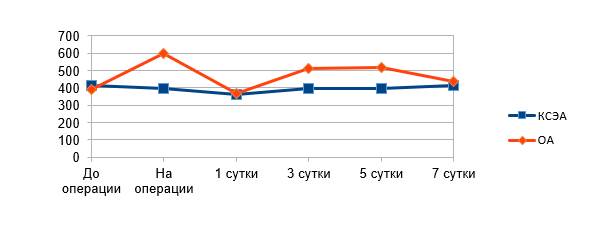
Рис. 1. Средние значения уровня кортизола крови (нмоль/л)
Средние значения концентрации ИЛ-6 до начала операции в обеих группах были выше нормы (до 10 пг/мл), что связано с инфекционной природой заболевания. После удаления компонентов протеза не отмечено статистически значимого повышения среднего показателя ИЛ-6 в обеих группах по сравнению с исходными значениями (рис. 2). Однако к 1-м суткам после операции наблюдалось максимальное повышение среднего значения ИЛ-6 как в группе ОА, так в группе КСЭА. В дальнейшем отмечено снижение показателей ИЛ-6 в обеих группах. На 3-и сутки отмечено статистически значимое различие между группами, концентрация ИЛ-6 в группе ОА составила 70,83±40,78 пг/мл, в группе КСЭА – 41,37±27,27 пг/мл (p=0,05). На 5-е и 7-е сутки не отмечено статистически значимых различий между группами.
В 1-е сутки интенсивность болевого синдрома по шкале ВАШ статистически значимо была меньше в группе КСЭА (p<0,05). В группе ОА показатель составил 45±27,9 балла, а в группе КСЭА – 19,1±15 балла. В остальные дни статистически значимых отличий в интенсивности боли не обнаружено. Потребность в наркотических анальгетиках (тримепиредин 2%) после операции также достоверно была ниже в группе КСЭА (p=0,026). В группе ОА показатель составил 42±6,32 мг, в группе КСЭА – 30,6±14,86 мг.
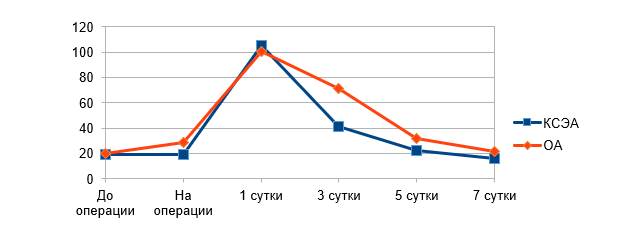
Рис. 2. Средние значения ИЛ-6 крови (пг/мл)
Не отмечено статистически значимых различий в концентрации IgA, IgM, IgG между группами. Также не выявлено значимых различий в концентрации глюкозы и транстиретина. Средние значения концентрации IgA в обеих группах в течение всего исследования были выше референсных значений (1,14–2,22 г/л), что связано с инфекционной природой заболевания (рис. 3).
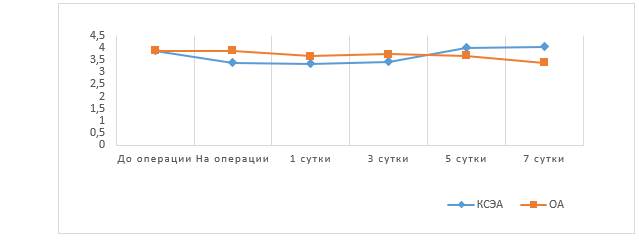
Рис. 3. Средние значения IgА, г/л
В группе ОА средние значения концентрации IgM до операции и на 3-и сутки после операции были ниже нормы (рис. 4).
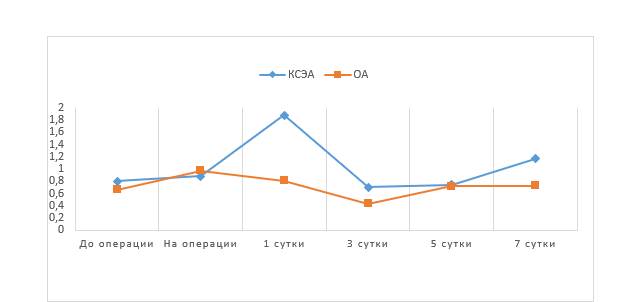
Рис. 4. Средние значения IgM г/л
Остальные значения концентрации IgM в обеих группах находились в пределах референсного интервала. Средние значения концентрации IgG (рис. 5) в обеих группах в течение всего исследования были в пределах нормы (11,6–18,2 г/л).
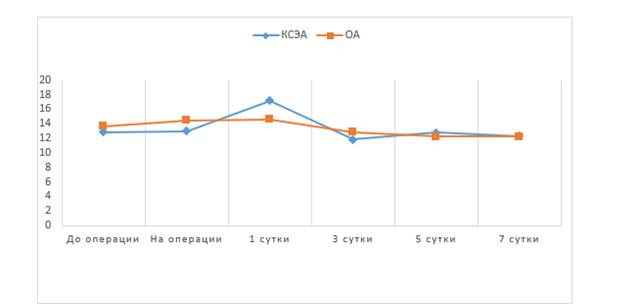
Рис. 5. Средние значения IgG, г/л
Уровень плазменной концентрации кортизола является адекватным отражением реакции организма на хирургический стресс [2]. Наши данные согласуются с исследованиями, демонстрирующими положительное влияние регионарной анестезии на уровень кортизола в интраоперационном периоде. Это различие может быть объяснено блокированием КСЭА сенсорных афферентных нервных импульсов, возникающих в результате хирургической травмы.Известно, что блокирование эфферентных и афферентных путей вегетативной нервной системы подавляет активацию нейроэндокринной оси во время хирургических вмешательств [1].
Применение эпидурального обезболивания в течение первых 2 суток оказало положительное влияние на выраженность болевого синдрома в группе КСЭА. Также в этой группе отмечена меньшая потребность в наркотических анальгетиках в день операции. В дальнейшем, после прекращения эпидурального обезболивания не отмечено статистически значимых различий в интенсивности боли между группами. Однако блокирование сенсорных афферентных нервных импульсов в течение 48 часов привело к меньшей концентрации кортизола на 3-и и 5-е сутки после операции.
Максимальные значения ИЛ-6 в обеих группах наблюдались через 1 сутки после операции, что объясняется нарастанием его концентрации в ответ на операционную травму. В результате повреждения тканей высвобождаются молекулярные структуры, связанные с повреждением (DAMPs) [5]. Они представлены митохондриальной ДНК и различными белками, которые прямо или косвенно способствуют воспалению, активируя нейтрофилы. После того как ИЛ-6 синтезируется в месте локального повреждения в начальной стадии воспаления, он током крови переносится в печень с последующей быстрой индукцией широкого спектра белков острой фазы (таких как СРБ, сывороточный амилоид А (SAA), фибриноген, гаптоглобин) [5].
Кроме оказания регуляторных эффектов на иммунную систему, ИЛ-6 снижает выработку фибронектина, альбумина и трансферрина [5]. ИЛ-6 индуцирует выработку гепсидина, который блокирует действие ферропортина 1 – переносчика железа, приводя, таким образом, к гипоферремии и анемии в связи с развитием хронического воспаления. С этих позиций устойчивое повышение ИЛ-6 в послеоперационном периоде будет замедлять процесс восстановления пациента и увеличивать риск реинфекции.
На 3-и сутки отмечено различие между группами – среднее значение концентрации ИЛ-6 в группе ОА составила 70,83±40,78 пг/мл, а в группе КСЭА – 41,37±27,27 пг/мл (p=0,05), что может говорить о существовании тенденции более интенсивного снижения ИЛ-6 через 72 часа после выполнения операции в группе КСЭА. Вероятным механизмом влияния регионарной анестезии и анальгезии на воспалительный ответ является системное действие местных анестетиков [2]. Способность к уменьшению аккумуляции нейтрофилов в тканях-мишенях, снижение концентрации ФНО-α и интерлейкинов проявляются в микромолярных концентрациях местных анестетиков [2]. В исследовании J.Y. Hong, T. Kyung, 2008, показано, что превентивное использование эпидуральной анестезии сопровождалось меньшим повышением ИЛ-6 сразу после операции, а также через 24 и 72 часа после нее [11]. Таким образом, вероятно, регионарная анестезия обладает противовоспалительным эффектом. Можно предположить, что в нашем исследовании применение эпидуральной анестезии в течение 2 суток после операции привело к меньшей концентрации ИЛ-6 к 3-м суткам. Однако необходимо проведение исследований с включением большего количества испытуемых для выявления этих эффектов.
Показана связь между активацией гипоталамо-гипофизарно-надпочечниковойоси и уровнем ИЛ-6. Рецепторы ИЛ-6 присутствуют на кортикотрофах гипофиза и клетках коры надпочечников, активация которых приводит к стимуляции выработки глюкокортикоидов [12]. Повышение уровня глюкокортикоидов в плазме приводит к подавлению цитокинов, таких как ИЛ-1, ИЛ-6 и ФНО-α, и к усилению регуляции других цитокинов, таких как ИЛ-4, ИЛ-10, и рецепторов цитокинов. Таким образом, регулируя выработку и действие цитокинов, гипоталамо-гипофизарно-надпочечниковаяось способствует модуляции реакции на воспаление. Исходя из этого можно предположить, что в группе КСЭА на 3-и сутки более низкий уровень ИЛ-6 оказывал меньшее стимулирующее влияние на выработку кортизола, что в совокупности с эпидуральным обезболиванием в послеоперационном периоде (48–72 часа) привело к снижению концентрации кортизола на 3-и и 5-е сутки после операции.
Препараты для анестезии сами по себе оказывают влияние на концентрацию про- и противовоспалительных цитокинов. Так, в метаанализе Q.B. Yu, 2015, включающем 7 исследований влияния севорана и пропофола на концентрации в крови ИЛ-6 и ИЛ-8 у пациентов, перенесших искусственное кровообращение, продемонстрировано снижение провоспалительных цитокинов в группе севорана [13]. Однако влияние севорана на воспалительный ответ ограничено временем операции. Также данные метаанализа Q.Y. Pang, 2021, показывают, что у пожилых пациентов при некардиохирургических вмешательствах анестезия пропофолом превосходит ингаляционную анестезию (севораном и изофлюраном) вследствие уменьшения системного воспаления (снижения концентрации ИЛ-6, ФНО-α) и нарушений когнитивного статуса [14]. В нашем исследовании мы не обнаружили разницы в концентрации ИЛ-6 между общей анестезией севораном и КСЭА с седацией мидазоламом во время операции.
В исследовании В.В. Хиновкер и соавт., 2017, было проведено сравнение продленной спинальной, КСЭА и общей анестезии при операциях первичного эндопротезирования тазобедренного сустава. Авторы пришли к выводу, что гуморальное звено иммунитета (IgA, IgG, IgM) более устойчиво к действию операционной травмы. Наиболее выраженным стресс-протективное действие оказалось у КСЭА, в данной группе уровень IgA после операции снижался существенно меньше, а уровень IgM оказался даже несколько выше предоперационного [15]. В исследовании T. Shun et al., 2019, при операциях кесарева сечения в горных районах через 12 часов после вмешательства отмечено снижение показателей гуморального иммунитета (IgA, IgG, IgM) в группах эпидуральной и комбинированной спинально-эпидуральной анестезии. Однако в группе КСЭА это снижение было менее выражено (р<0,05).
В данном исследовании мы не обнаружили достоверных различий между группами в концентрации IgA, IgG, IgM в периоперационном периоде. В отличие от приведенных примеров, в нашем исследовании участвовали больные с очагом гнойной инфекции, что, несомненно, сказывается как на клеточном, так и на гуморальном компонентах иммунитета, о чем свидетельствует повышенный уровень IgA в обеих группах в течение всего исследования. Так как для выработки IgM и IgG нужно по меньшей мере несколько дней, возможно, различия в концентрации между группами появляются на более поздних этапах – спустя недели или месяц. Для выявления этих закономерностей необходимо проведение более масштабных исследований с более длительным интервалом наблюдения в послеоперационном периоде.
Одновременное существование как про-, так и противовоспалительных систем диктует необходимость выбора методики анестезии, способной минимизировать провоспалительную стимуляцию и предупреждать потенцирование воспалительного компонента операционного стресс-ответа. Выработка провоспалительных цитокинов приводит к иммунным реакциям, включающим как клеточный, так и гуморальный компонент. Существование выраженного воспалительного ответа для организма является разрушительным, способствует развитию ряда осложнений. Возникающая в результате этого иммуносупрессия увеличивает риск септических осложнений и как следствие – хронизации процесса. Высказываются мнения о необходимости контроля динамики воспалительной реакции при тяжелой инфекции на основе выбранных параметров (ФНО-α, ИЛ-1, ИЛ-6) с целью более раннего выявления и реагирования.
Заключение. При операциях ревизионного эндопротезирования тазобедренного сустава по поводу перипротезной инфекции эффективным методом анестезиологического пособия является как общая, так и комбинированная спинально-эпидуральная анестезия. Однако при использовании КСЭА наблюдалось меньшее повышение уровня кортизола во время операции, а также на 3-и и 5-е сутки после нее (p<0,05) по сравнению с общей анестезией. Также в группе КСЭА на 3-и сутки после операции наблюдалась тенденция к меньшему повышению уровня ИЛ-6 (p=0,056). Следовательно, использование КСЭА оказывает модулирующее действие на хирургический стресс-ответ в периоперационном периоде. Не отмечено достоверных различий между группами в показателях гуморального иммунитета (IgA, IgM, IgG), концентрации глюкозы и транстиретина. Необходимо проведение дополнительных исследований с более длительным периодом наблюдения для оценки влияния метода анестезиологического пособия на гуморальное звено иммунитета.
Библиографическая ссылка
Казанин А.А., Загреков В.И., Лебедев М.Ю., Ашкинази В.И., Наргизян А.З., Митрофанов В.Н., Комаров Р.Н., Преснов Д.В. ВЛИЯНИЕ МЕТОДА АНЕСТЕЗИОЛОГИЧЕСКОГО ПОСОБИЯ НА ХИРУРГИЧЕСКИЙ СТРЕСС-ОТВЕТ И ГУМОРАЛЬНЫЙ ИММУНИТЕТ ПРИ ПЕРИПРОТЕЗНОЙ ИНФЕКЦИИ ТАЗОБЕДРЕННОГО СУСТАВА // Современные проблемы науки и образования. 2022. № 3. ;URL: https://science-education.ru/ru/article/view?id=31716 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31716



