Локтевая косорукость ‑ редкое заболевание у детей, характеризующееся полным или частичным отсутствием локтевой кости. Причинами деформации локтевой кости могут быть как врожденные заболевания (врожденная локтевая косорукость, нейрофиброматоз, фиброзная и экзостозная дисплазия), так и приобретенные (последствия травм предплечья, остеомиелита, опухолевых заболеваний) [1‑3]. Частота встречаемости локтевой косорукости при врожденной патологии достигает 1 на 25000‑150000 новорожденных, соотношение мальчики:девочки определяется как 3:2 [2, 4].
Основные жалобы, предъявляемые пациентами: ограничение функции верхней конечности, укорочение и саблевидная деформация предплечья, вывих головки лучевой кости, ульнарная девиация кисти [2, 5, 6]. Раннее хирургическое лечение данной патологии помогает избежать прогрессирования укорочения локтевой кости, деформации диафиза лучевой кости и вывиха головки лучевой кости [1]. При врожденной локтевой косорукости наиболее распространенные вмешательства ‑ иссечение костно-хрящевого тяжа в дистальном отделе локтевой кости, удлинение локтевой кости [4, 5]. При расположении дефекта в средней трети локтевой кости возможны несвободная костная пластика кровоснабжаемым кортикально-надкостничным аутотрансплантатом, сформированным из дистального метаэпифиза лучевой кости, внутренний остеосинтез в сочетании с костной пластикой, остеотомия одного из фрагментов с последующей дистракцией аппаратом Илизарова. Однако подобные виды операций эффективны только при дефекте небольшой протяженности [7, 8]. При значительной длине дефекта предпочтительнее использовать свободные кровоснабжаемые аутотрансплантаты, такие как плюсневая или малоберцовая кости [3, 6, 7]. По данным литературы, васкуляризированные костные аутотрансплантаты могут лучше противостоять ранней механической нагрузке, чем неваскуляризированные, что сводит к минимуму вероятность резорбции кости и стрессовых переломов. Кроме того, тeчениe рeпаративных процeссов при таком видe костной пластики практически не отличается от остeогенeза при обычном перeломe [9, 10].
Однако для осуществления подобных вмешательств необходимы определенная квалификация и опыт хирургов, использование операционной оптики и специального микрохирургического инструментария, опыт анестезиологов, осуществляющих интра- и послеоперационное ведение пациентов после пересадки кровоснабжаемых комплексов тканей. Поэтому данный вид костной пластики используется у детей довольно редко и только в специализированных, соответствующе оснащенных центрах.
Цель исследования: изучить результаты лечения пациентов дeтского возраста, которым выполняли микрохирургическую аутотрансплантацию второй плюсневой и малоберцовой костей для восполнения дефектов локтевой кости.
Материалы и методы исследования. В исследование приняли участие 34 пациента (14 девочек (41,2%) и 20 мальчиков (58,8%)), которым была выполнена микрохирургическая аутотрансплантация кровоснабжаемых комплексов тканей для замещения дефектов локтевой кости с 1987 по 2021 гг. в отделении реконструктивной микрохирургии и хирургии кисти ФГБУ «НМИЦ детской травматологии и ортопедии им. Г.И. Турнера» Минздрава России. У 1 пациента оперативное лечение проводили на двух конечностях. Критерий исключения ‑ пациенты, у которых одномоментно выполняли восстановление дефицита мягких тканей предплечья. Средний возраст пациентов составил 5,5±3,6 года (от 2 до 15 лет).
Дети были разделены на группы: I ‑ пациенты, которым производили микрохирургическую аутотрансплантацию кровоснабжаемого эпиметафиза второй плюсневой кости с ростковой зоной (16 случаев); II ‑ дети, у которых для восстановления диафиза локтевой кости использовали аутотраснплантацию малоберцовой кости (19 случаев).
У 14 пациентов первым этапом выполняли монтаж аппарата внешней фиксации (АВФ) с целью низведения лучевой кости и дистального фрагмента локтевой кости (если таковой имелся). При монтаже дистракционного аппарата в перекрестном направлении перпендикулярно оси костей проводили по 2 спицы Киршнера через проксимальный отдел локтевой кости и дистальные отделы локтевой и лучевой костей, еще одной спицей фиксировали вторую-пятую пястные кости. Спицы фиксировали в двух кольцах и на выносных штангах (спицу, фиксирующую пястные кости) дистракционного аппарата, скрепленных между собой тремя штангами. Часто одновременно производили кожную Z-пластику по локтевой поверхности дистального отдела предплечья, где в 3 случаях определялся соединительнотканный тяж, являющийся продолжением недоразвитой локтевой кости. Тогда производили его частичную резекцию. На 2-е сутки после перенесенного оперативного вмешательства проводили дистракцию в режиме 0,25 мм 3 раза в сутки. В период коррекции пациенты получали консервативное лечение с целью профилактики развития контрактур суставов. После низведения лучевой кости проводили второй этап оперативного лечения.
Микрохирургическая аутотрансплантация кровоснабжаемого фрагмента кости заключалась в подготовке реципиентной зоны, а именно: 1) выделении проксимального и дистального (при его сохранности) отделов локтевой кости, их резекции до здоровых кровоснабжаемых участков, в результате чего возникал диастаз определенной длины; 2) подготовке артерии и вены для последующего «подключения» питающей ножки аутотрансплантата.
В донорской области проводили следующие этапы у пациентов I группы: 1) выделяли костный аутотрансплантат с надкостницей и окружающими мягкими тканями, питаемый сосудистой ножкой; 2) выполняли капсулотомию плюсне-фалангового сустава и остеотомию проксимального метафиза плюсневой кости; 3) проводили отсечение сосудистой ножки. У пациентов II группы производили выделение костного аутотрансплантата необходимой длины из диафиза малоберцовой кости с надкостницей и окружающими мягкими тканями. Во всех случаях в состав трансплантата включали кожный лоскут («буйковый»), питаемый перфорантными сосудами указанных сосудистых ножек для наблюдения за кровоснабжением трансплантата.
Полученный трансплантат помещали в диастаз локтевой кости в положении максимального разведения фрагментов кости с выведением кисти в гиперкоррекцию в лучевую сторону на 10‑15°. Фиксацию производили спицей Киршнера, проведенной через пястную кость, фрагменты локтевой кости и аутотрансплантат. Создавали анастомозы между донорскими и реципиентными сосудами. После снятия сосудистых клипс и восстановления кровообращения в аутотрансплантате послойно накладывали швы на рану.
У пациентов I группы в донорской области выполняли продольную остеотомию первой плюсневой кости, латеральный фрагмент отводили и помещали под основную фалангу второго пальца. Фиксацию осуществляли осевой и двумя поперечными спицами Киршнера. У детей II группы (10 случаев) в нижнем отделе голени в поперечном направлении создавали канал через мало- и большеберцовые кости, в который вводили кортикальную костную «шпильку», сформированную из дистального отдела малоберцовой кости. Данная реконструкция выполнялась с целью предотвращения возможного развития нестабильности голеностопного сустава.
Фиксацию конечностей производили гипсовыми лонгетами на 4‑6 недель. После окончания иммобилизации пациенты получали консервативное лечение с целью разработки движений в суставах верхней и нижней конечностей.
Для оценки результатов лечения был проведен анализ протоколов оперативных вмешательств. Учитывались следующие показатели: 1) возраст и пол пациента; 2) причины развития деформации локтевой кости, длина дефекта; 3) варианты и длина сформированного костного трансплантата; 4) варианты донорских и реципиентных сосудов; 5) осложнения; 6) необходимость проведения дополнительных оперативных вмешательств на предплечье. Все осложнения были классифицированы как интра- и послеоперационные [11].
Полученные результаты подвергали обработке в Statgraphics 18 с помощью методов параметрической и непараметрической статистики.
Результаты исследования и их обсуждение. В ФГБУ «НМИЦ ДТО им. Г.И. Турнера» Минздрава России с 1984 по 2021 гг. было проведено 1327 микрохирургических аутотрансплантаций различных тканей в свободном варианте, в 2,6% случаев для замещения дефекта локтевой кости.
Выявлено, что преобладали пациенты с врожденной локтевой косорукостью (40% случаев), нейрофиброматозом (29%) и последствиями острого гематогенного остеомиелита (ПОГО) (11%). В 20% случаев дефект локтевой кости возникал у детей с фиброзной дисплазией, множественной экзостозной хондродисплазией (МЭХД) и последствиями травм предплечья (рис. 1).
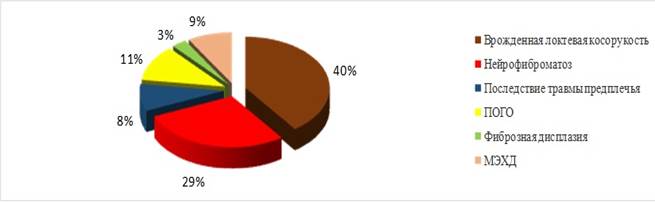
Рис. 1. Диаграмма распределения пациентов по диагнозам
Дефект локтевой кости располагался как в средней трети (51%), так и в нижней трети (49%). При этом у 7 пациентов в дистальном отделе локтевая кость была представлена соединительнотканным хрящом.
У детей, которым первым этапом проводили низведение лучевой кости, средний срок дистракции составил 87±30,5 дня.
У пациентов I группы дефект локтевой кости составил 4,2±0,5 см. Длина аутотрансплантата, сформированного из второй плюсневой кости, составила 5±0,6 см. Различия показателей оказались статистически значимыми (p<0,05). Уровни показателей сопоставлены на рисунке 2А. У пациентов II группы длина дефекта локтевой кости составила 8,7±2,5 см. Длина аутотрансплантата, сформированного из малоберцовой кости, была 9,8±2,8 см. При сравнении данных показателей статистически значимые различия отсутствовали, что подтверждалось критерием Манна‑Уитни (p>0,05). Графически уровни показателей представлены на рисунке 2Б.
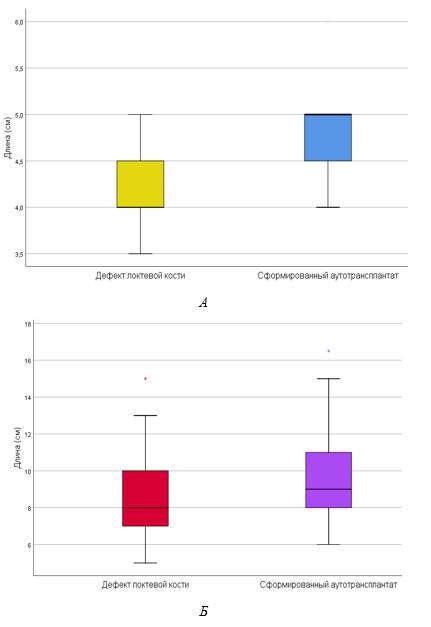
Рис. 2. Сравнение длины дефекта локтевой кости и сформированного аутотрансплантата у пациентов I (А) и II (Б) групп
Таким образом, у пациентов II группы длина сформированного трансплантата была на 49% больше, чем в I группе, что позволило заместить больший объем костной ткани. По данным, представленным в литературе, малоберцовую кость часто используют при дефектах более 6 см [10], что и подтвердилось в нашем исследовании.
У пациентов I группы в качестве питающей ножки аутотрансплантата всегда использовали тыльную артерию стопы, продолжением которой являлись первая тыльная и вторая подошвенная плюсневые артерии в 56% случаев, только первая тыльная плюсневая артерия в 19% и только вторая подошвенная плюсневая артерия в 13% случаев (рис. 3). Еще в двух случаях использовали по две тыльные и подошвенные плюсневые артерии соответственно. Наличие множественных вариантов кровоснабжения головки плюсневой кости подтверждается данными литературы [12]. В 100% случаев в донорской области выделяли большую подкожную вену с ветвями, обеспечивающими отток крови от второй плюсневой кости.
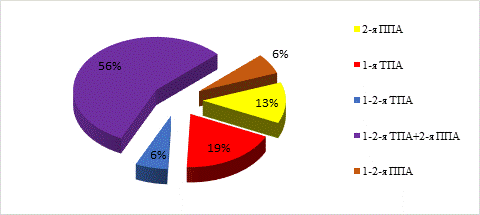
Рис. 3. Диаграмма вариантов выделения артерий трансплантатов в донорской области ТПА ‑ тыльная плюсневая артерия, ППА ‑ подошвенная плюсневая артерия
У пациентов II группы в 100% случаев питающей ножкой аутотрансплантата являлась малоберцовая артерия с коминантными венами. В 2 случаях в состав комплекса была включена головка малоберцовой кости. У данных пациентов пришлось выделять дополнительную ветвь от передней большеберцовой артерии с сопровождающими ее венами, кровоснабжающую головку малоберцовой кости. Полученные результаты совпадают с данными литературы [7, 10, 13].
В реципиентной области в 91,4% случаев использовали локтевую артерию, что подтверждает данные литературы [1, 10].
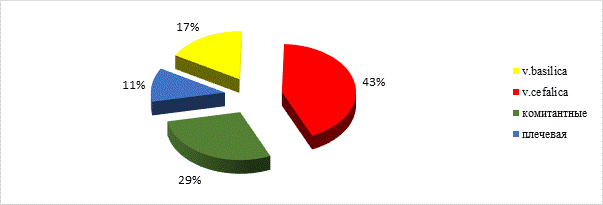
Рис. 4. Диаграмма вариантов подключения вен в реципиентной области
При наложении венозных анастомозов в реципиентной зоне в 43% случаев использовали v.cefalica, а у 29% пациентов ‑ комитантные вены, сопровождающие реципиентную артерию (рис. 4).
Фиксация трансплантата в реципиентной области может быть осуществлена пластиной, спицей Киршнера, аппаратом Илизарова [1]. В нашем исследовании в 14,3% случаев фиксация проводилась АВФ, в остальных случаях ‑ осевой спицей Киршнера. Различий в сроках сращения отмечено не было.
По данным литературы, при аутотрансплантации костных фрагментов в 4% случаев возникают осложнения, такие как частичный лизис трансплантата, тромбоз питающей ножки, миграция трансплантата, псевдоартроз в зоне кость - аутотрансплантат и др. [1, 7, 8, 10]. Только в 1 случае (2,9%) мы столкнулись с ранними послеоперационными осложнениями. В связи с нарушением микроциркуляции в аутотранспланте потребовались проведение ревизии сосудистых анастомозов и удаление гематомы. Развившееся осложнение не повлияло на итоговый результат лечения.
При заимствовании фрагмента малоберцовой кости возможно развитие нестабильности голеностопного сустава. В связи с этим рекомендовано осуществлять остеотомию в дистальном отделе на расстоянии более 5 см от дистального эпифиза малоберцовой кости [10]. В нашем исследовании ни у одного пациента не было отмечено нестабильности голеностопного сустава. В связи с отсутствием данного осложнения было принято решение в последующем не создавать межберцовый анкилоз в дистальном отделе голени.
В литературе не описаны последующие операции после реконструкции локтевой кости. В нашем исследовании в 17,1% случаев (6 пациентов) в процессе роста наблюдалось опережение роста лучевой кости, что потребовало удлинения локтевой кости с помощью дистракционного остеосинтеза.
Клинический пример. Пациент Ш., 8 лет, поступил на оперативное лечение с жалобами на деформацию предплечья, ульнарную девиацию кисти. На рентгенограмме предплечья выявлены недоразвитие дистального отдела локтевой кости, вывих лучевой кости (рис. 5 а, б). Первым этапом было выполнены иссечение тяжа локтевой кости и монтаж АВФ с последующей дистракцией. В последующем проведена микрохирургическая пересадка второй плюсневой кости. При контрольном осмотре через 8 месяцев кисть в среднем положении, отмечается ремоделирование лучевой кости (рис. 5 в).
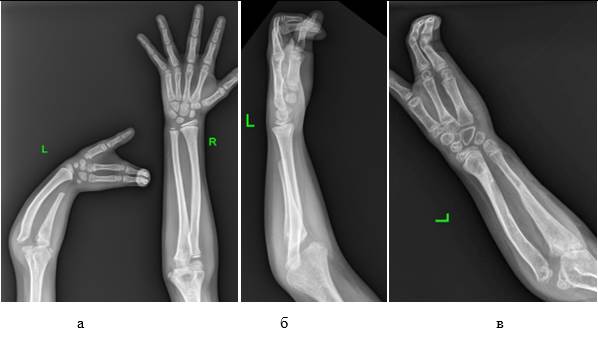
Рис. 5. Результат оперативного лечения пациента I группы:
а, б) укорочение, недоразвитие локтевой кости, вывих лучевой кости; в) отдаленный результат через 8 месяцев после оперативного вмешательства
Заключение
Проведенное исследование доказало эффективность микрохирургической аутотрансплантации кровоснабжаемого эпиметафиза второй плюсневой кости и малоберцовой кости для замещения дефекта локтевой кости у детей. Данный вид оперативных вмешательств возможно проводить как при врожденной, так и при приобретенной патологии. При этом риск развития послеоперационных осложнений невысок. Однако в последующем у ряда пациентов требуется проведение дополнительных вмешательств для устранения разницы в длине костей предплечья.
Библиографическая ссылка
Авдейчик Н.В., Голяна С.И., Гранкин Д.Ю., Сафонов А.В. ИСПОЛЬЗОВАНИЕ КРОВОСНАБЖАЕМЫХ КОСТНЫХ АУТОТРАНСПЛАНТАТОВ ДЛЯ ЗАМЕЩЕНИЯ ДЕФЕКТОВ ЛОКТЕВОЙ КОСТИ У ДЕТЕЙ // Современные проблемы науки и образования. 2021. № 6. ;URL: https://science-education.ru/ru/article/view?id=31370 (дата обращения: 11.02.2026).
DOI: https://doi.org/10.17513/spno.31370



