Лаброциты, или тучные клетки (ТК) - многофункциональные клеточные элементы, которые играют значительную роль при таких важнейших состояниях, как стресс [1-3], репарация [4], адаптация [5] и опухолевый рост [6].
В сердце, в силу своих тесных взаимосвязей с эндокринной, нервной и иммунной системами и клетками микроокружения кардиомиоцитов, ТК осуществляют ремоделирование миокарда [7]. Мобилизация эндокринной системы является важнейшим фактором активизации ТК при холодовом стрессе. Активация симпато-адреналовой и гипоталамо-гипофизарно-надпочечниковой систем через синтез адренокортикотропного гормона гипофиза (АКТГ) и катехоламинов приводит к дегрануляции лаброцитов. При воздействии нервной системы по симпатическим стволам к сердечным ТК поступают нейропептиды (субстанция Р, нейротензин и кортикотропин-релизинг фактор), которые также обладают мощным дегранулирующим эффектом. Медиаторы ТК способны оказывать влияние на клетки иммунной системы и наоборот. Цитокины и хемокины ТК могут активировать и вызывать миграцию нейтрофилов, а гепарин, напротив, снижает миграцию нейтрофильных лейкоцитов; гепарин способен тормозить миграцию эффекторных Т-лимфоцитов, а цитокин ИЛ-16 является хемоаттрактантом для CD4+ Т-лимфоцитов; ФНОα стимулирует миграцию и активность макрофагов; гистамин, лейкотриен и триптаза являются митогенами для сердечных фибробластов; химаза активирует матриксные металлопротеиназы и стимулирует синтез коллагена [8; 9].
ТК сердца относят к популяции соединительнотканных ТК. В норме в сердце их немного, они представлены в основном компактными формами, дегранулирующие ТК, по разным данным, составляют от 7% до 20%. Но количество и морфофункциональная активность ТК в сердечной ткани резко возрастает при сердечной недостаточности, инфаркте миокарда, гипертонической болезни, различных вариантах кардиомиопатий, миокардитах, атеросклерозе и экспериментальной патологии миокарда [10-12]. Высказывается предположение, что ТК через активацию фибробластов осуществляют замещение некротизированных клеток миокарда соединительной тканью. В то же время есть работы, где приводятся данные о негативном влиянии сердечных ТК при сердечно-сосудистой патологии. Но, несмотря на большое количество работ, посвященных сердечным ТК в норме и при патологии миокарда, их патоморфология при воздействии на сердечную ткань экстремальных факторов окружающей среды, и в том числе холодового фактора, изучена недостаточно.
Целью исследования являлся патоморфологический анализ тучных клеток сердечной ткани белых крыс Вистар при холодовом воздействии и в постгипотермическом периоде.
Материалы и методы исследования
В работе исследована сердечная ткань 50 самцов белых крыс линии Вистар, массой тела 200-300 граммов, при воздействии глубокой гипотермии (ГИГ). ГИГ вызвали помещением клеток с крысами в воду температурой +5 градусов, температура окружающей среды при этом составляла +7 градусов. Время воздействия холодового фактора в среднем было равно 40 минутам. Считали, что животные достигали состояния глубокой гипотермии, если у них ректальная температура составляла +20-25 градусов. Крыс выводили из эксперимента через 1, 2, 7 и 14 суток.
В качестве контроля использовали 10 крыс, которые в клетках помещались в воду с температурой +30 градусов, температура окружающей среды была +22-25 градусов, время охлаждения было то же.
Использование крыс в данном исследовании, как и в других наших экспериментах, осуществлялось в соответствии с Европейской конвенцией по охране позвоночных животных, используемых в эксперименте, и директивами - 86/609/EEC. В целях гуманности и устранения влияния стресса на результаты исследования умерщвление и обезболивание проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных».
Для целей патогистологического исследования из левого желудочка сердца экспериментального животного вырезали 3-5 кусочков, которые затем фиксировали в 10%-ном растворе нейтрального формалина в течение 24-48 часов при комнатной температуре, после чего осуществляли проводку по общепринятой методике и заливали в высокомолекулярный парафин. При помощи роторного микротома изготавливали срезы толщиной 5-7 мкм. Окрашивание ТК осуществляли при помощи набора компании Biovitrum (Санкт-Петербург). Для фотографирования использовали цифровую видеокамеру Leica EC3 (Германия) и микроскоп Leica DM 750 E200 (Германия). В программе Image Tool 3.0. на фотографиях в формате JPEG высчитывали среднее число ТК в 3 полях зрения при увеличении объектива микроскопа х400 (площадь поля зрения составляла 0,365 мм2). Рассчитывали в процентах содержание компактных и дегранулирующих типов ТК. Морфометрические исследования осуществляли с помощью программного обеспечения «ВидеоТест-Морфология 5.2». Статистическая обработка осуществлялась при помощи программного пакета Statistica 10.0.
Результаты исследования и их обсуждение
В сердечной ткани крыс группы контроля ТК обнаруживали в перикарде, периваскулярной ткани и между кардиомиоцитами. Они были небольшого размера, округлой формы, расположены одиночно или небольшими группами. Число ТК в сердце составило 3,3±0,3 в поле зрения. Площадь клеток была равна 82,5±3,6 мкм2. Содержание компактных типов ТК составило 74%±5,4, дегранулирующих форм было 26%±5,4. Дегрануляция ТК в группе контроля осуществлялась по апокриновому типу с отделением от клетки небольших фрагментов цитоплазмы или гранул.
На 1-й день эксперимента в сердце экспериментальных крыс ТК располагались группами или поодиночке, в основном в периваскулярной ткани. Они были крупного размера, овальной или округлой формы, бледно-фиолетового цвета (рис. 1).
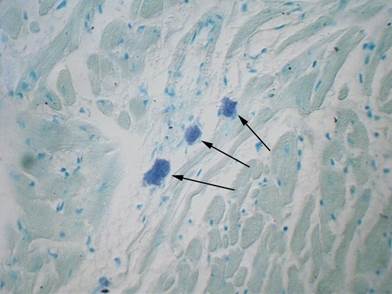
Рис. 1. Сердечная ткань крысы. На 1-й день эксперимента крупные ТК в состоянии мерокриновой секреции и опустошения располагаются в периваскулярной ткани (обозначены стрелками). Окрашивание толуидиновым голубым. Ув. х 400
Параметры лаброцитов сердечной ткани крыс
|
Параметры |
Дни эксперимента |
|||
|
1-й день (1) |
2-й день (2) |
7-й день (3) |
14-й день (4) |
|
|
Общее число лаброцитов
|
3,6±0,4 |
5,6±0,3 |
3,8±0,2 |
2,4±0,15 |
|
Число компактных типов лаброцитов (%) |
22,2±6,1 |
59,3±4,6 |
74±5,4 |
77,8±5,4 |
|
Число дегранулирующих типов лаброцитов (%) |
77,8±6,1 |
40,7±4,6 |
26±5,4 |
22,2±5,4 |
|
Площадь лаброцитов (мкм2)
|
126,3±4,8 |
108,8±3,0 |
94,7±3,9 |
90,7±3,9 |
Примечание: для общего числа лаброцитов: P1-2 – 0,0001; P2-3 – 0,00002; P3-4 – 0,000003.
Для числа компактных типов лаброцитов: P1-2 – 0,000009; P2-3 – 0,04.
Для числа дегранулирующих типов: ТК P1-2 – 0,000009; P2-3 – 0,04; P2-4 – 0,01.
Для площади лаброцитов: P1-2 – 0,001; P2-3 – 0,004.
Количество ТК в сердечной мышце равнялось 3,6±0,4, площадь клеток составила 126,3±4,8 мкм2. Дегранулирующие формы ТК составили 77,8%±6,1, при этом дегрануляция осуществлялась по мерокриновому типу с выраженными явлениями гранулоцитолиза и опустошения клеток. Количество компактных форм ТК, по сравнению с контролем, уменьшилось до 22,1%±6,1 (табл.).
На 2-й день эксперимента ТК в ткани сердца располагались группами вокруг сосудов и в меньшей мере между кардиомиоцитами, они имели фиолетовую окраску и преимущественно вытянутую форму (рис. 2).
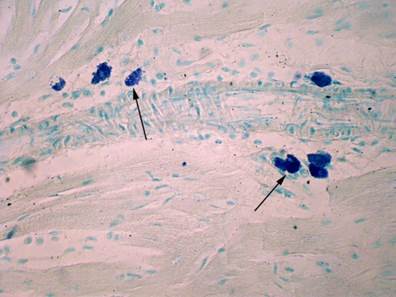
Рис. 2. Сердечная ткань крысы. ТК находятся в адвентиции сосуда, через 2 суток после воздействия ГИГ (обозначены стрелками). Окрашивание толуидиновым голубым. Ув. х 400
Содержание ТК в миокарде увеличивалась в 1,55 раза, площадь их уменьшалась до 108,8±3,0 мкм2. Количество клеток, имеющих компактное строение, возрастало в 2,7 раза, число дегранулирующих уменьшалось в 1,9 раза (табл.), при этом преобладали явления апокриновой секреции.
На 7-й день эксперимента отмечали уменьшение числа ТК вокруг сосудов и возрастание их количества между кардиомиоцитами. На данном сроке эксперимента преобладали клетки удлиненного вида (рис. 3).
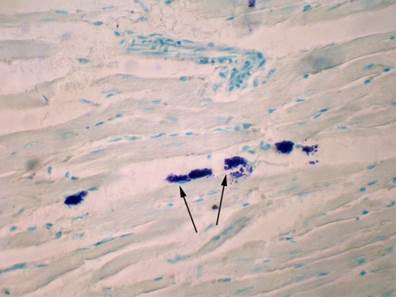
Рис. 3. Сердечная ткань крысы. Отмечается миграция ТК из периваскулярных пространств в миокард через 7 суток после воздействия ГИГ (обозначены стрелками). Окрашивание толуидиновым голубым. Ув. х 400
Число ТК уменьшалось в 1,5 раза, и их площадь становилась меньше (94,7±3,9 мкм2). Число клеток в состоянии дегрануляции снижалось в 1,6 раза, а содержание ТК компактного строения увеличивалось в 1,25 раза (таблица). Дегрануляция преимущественно проходила по апокриновому типу.
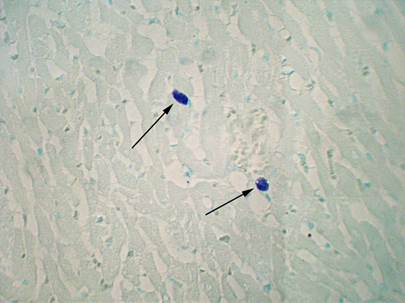
Рис. 4. Сердечная ткань крысы. Небольшие ТК определяются между кардиомиоцитами через 14 суток после воздействия ГИГ (обозначены стрелками). Окрашивание толуидиновым голубым. Ув. х 400
На 14-й день проведения эксперимента ТК были расположены поодиночке и группами, в основном между кардиомиоцитами. Они были небольшого размера и округлой формы (рис. 4).
Число ТК на данном сроке проведения эксперимента снижалось в 1,6 раза. Площадь клеток равнялась 90,7±3,9 мкм2. В состоянии дегрануляции было 22,2%±5,4 клеток, при этом дегрануляция осуществлялась по апокриновому типу. Компактные формы ТК составляли 77,8%±5,4 (табл.).
Таким образом, морфофункциональная активность сердечных ТК экспериментальных животных значительно изменялась под действием однократной ГИГ. После воздействия холодового фактора ТК находились в состоянии активной мерокриновой секреции, с проявлениями тотальной дегрануляции и гранулолизиса, что являлось следствием гипоксии, возникшей по причине спазма сосудов и активации симпато-адреналовой и гипоталамо-гипофизарно-надпочечниковой систем, так как АКТГ и катехоламины являются мощными дегрануляторами лаброцитов.
На 2-й день эксперимента в ткани сердца происходило возрастание числа ТК, и большинство из них отмечали в периваскулярной ткани. Это может свидетельствовать о процессах миграции молодых форм лаброцитов из кровяного русла в миокард. Следует отметить, что в предыдущих наших исследованиях содержание ТК в печени и легких после воздействия однократной ГИГ значительно возрастало только на 7-е сутки эксперимента [13-15]. Из этого можно заключить, что тучноклеточная популяция сердца является более чувствительной при мобилизации эндокринной системы и воздействии дегранулирующих факторов, в частности нейропептидов симпато-адреналовой и гипоталамо-гипофизарно-надпочечниковой систем. Через 7 дней лаброциты перемещались из периваскулярной ткани в миокард, и на 14-й день их содержание оказывалось близким к нормальному.
Динамические изменения, происходящие в популяции сердечных лаброцитов, обнаруженные в эксперименте, по нашему мнению, были связаны с процессами срочной адаптации, которые проявлялись гипертрофией ТК, активной мерокриновой секрецией, гранулолизисом на раннем этапе эксперимента и активным перемещением юных форм клеток из кровяного русла впоследствии. Высокая активность тучноклеточной популяции и раннее увеличение числа лаброцитов в миокарде может служить важным фактором, который способствует препятствию развитию тромбоза сосудов микроциркуляторного русла вследствие активной секреции гепарина.
Заключение
Таким образом, лаброциты служат важнейшими факторами в компенсаторно-приспособительных адаптационных реакциях, обеспечивающих устойчивость миокарда к воздействию холодового фактора. Сердечные ТК препятствуют блокаде микроциркуляторного русла и регулируют процессы регенерации кардиомиоцитов при воздействии ГИГ.
Библиографическая ссылка
Бобров И.П., Лепилов А.В., Долгатов А.Ю., Корсиков Н.А., Гулдаева З.Н., Крючкова Н.Г., Соседова М.Н., Долгатова Е.С., Лушникова Е.Л., Бакарев М.А. ТУЧНЫЕ КЛЕТКИ МИОКАРДА ПРИ ВОЗДЕЙСТВИИ ГИПОТЕРМИИ // Современные проблемы науки и образования. 2021. № 5. ;URL: https://science-education.ru/ru/article/view?id=31160 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31160



