Рак толстой кишки (РТК) является одной из наиболее распространенных форм онкопатологий с продолжающимся ростом заболеваемости и смертности. РТК служит четвертой причиной гибели от злокачественных новообразований (ЗНО) во всем мире и второй – в европейской популяции [1]. Данная онкопатология поражает около 10% мужчин и 9% женщин. Низкие показатели общей 5-летней выживаемости ассоциированы с тем, что у 15% пациентов с впервые диагностированным РТК наблюдается стадия Т4, а от 60% до 89% случаев сопровождаются осложнениями в виде острой кишечной непроходимости и перфораций кишечной стенки [2].
На ранних стадиях тактика лечения предполагает выполнение хирургической резекции, после которой определяется необходимость применения последующей адъювантной терапии, что дает хорошие результаты безрецидивной и общей выживаемости [3]. Тем не менее, метастатические формы заболевания характеризуются неблагоприятным прогнозом для пациентов и в 90% случаев являются причиной смерти. Вариативность ответов на терапию связана с различными молекулярными особенностями опухолей рака толстой кишки. В связи с этим актуальным представляется создание доклинических моделей, точно отражающих клинические проявления данного заболевания, с целью успешной разработки и продвижения в клиническую практику новых эффективных препаратов [4].
Ключевым инструментом в разработке новых фармакологических субстанций и проведении доклинических исследований (ДКИ) являются мышиные модели рака, позволяющие проводить оценку противоопухолевой эффективности in vivo [5].
Традиционные доклинические модели, созданные на основе клеточных линий рака человека, играют важную роль в формировании понимания механизмов действия новых терапевтических средств. Однако опухолевые клетки в процессе адаптации к росту на плоскости претерпевают изменения некоторых исходных биологических свойств, что можно описать как отсутствие морфологической и молекулярно-генетической гетерогенности [6].
Чтобы преодолеть эти ограничения и улучшить понимание биологии опухоли и механизмов лекарственного ответа, были разработаны ксенотрансплантаты, полученные путем прямой имплантации образцов опухоли пациентов иммунодефицитным мышам, – PDX (Patient-Derived Xenograft), ставшие превосходной альтернативой классическим доклиническим моделям. Образцы тканей пациентов могут быть имплантированы как гетеротопически (подкожно), так и ортотопически в гистологически соответствующий орган [7].
В 2013 г. R.L. Johnson и J.C. Fleet в работе «Animal Models of Colorectal Cancer» описали ключевые аспекты поддержания трансляционного потенциала мышиной модели рака толстой кишки, включающие ограниченность злокачественного процесса органом-мишенью, что позволяет исключать развитие сопутствующих заболеваний, сохранение гистологических и молекулярно-биологических особенностей, наблюдаемых у пациентов, а также способность отражать сложные межклеточные взаимодействия [8]. Хотя гетеротопические модели не полностью соответствуют описанным признакам в связи с отсутствием характерного опухолевого микроокружения (неоангиогенез, нарушение в регуляции клеточного цикла, отсутствие инвазивного роста, связанного с экспрессией матриксных металлопротеиназ, и секреция промоторов воспаления), они широко используются при проведении ДКИ благодаря относительной простоте процедуры создания и последующего мониторинга роста опухоли.
Ортотопические ксенотрансплантаты, в отличие от подкожных, способны воссоздать опухолевое микроокружение, необходимое для адекватного моделирования инвазивности и метастазирования [9]. Развитие метастазов у животных-носителей имеет решающее значение при моделировании РТК, так как 50% впервые диагностированных ЗНО толстого кишечника сопровождаются наличием метастазов. Но, несмотря на указанные преимущества, сложности оценки темпов и характера роста опухоли, предполагающие выполнение серии исследований с использованием специализированного оборудования для визуализации in vivo или проведения травматичной процедуры лапаротомии, ограничивают использование ортотопической PDX-модели [10].
Целями проведенного исследования явились создание гетеротопической и ортотопической PDX-модели рака толстой кишки человека, а также оценка приживления и динамики роста в зависимости от сайта имплантации.
Материал и методы исследования
Лабораторные животные
Исследование проводили на 40 интактных иммунодефицитных самках мышей линии Balb/c Nude с массой тела 18–24 г, возрастом 5–6 недель. Животные содержались в SPF-виварии Испытательного лабораторного центра ФГБУ «НМИЦ онкологии» Минздрава РФ в системе искусственно вентилируемых клеток с соблюдением светового режима день/ночь (12/12 часов) при температуре 22–26˚С и относительной влажности воздуха 50–60%.
Работа с животными осуществлялась в соответствии с «Правилами проведения работ с использованием экспериментальных животных» Хельсинской декларации. План исследования был одобрен биоэтической комиссией ФГБУ «НМИЦ онкологии» Министерства здравоохранения РФ.
Доноры опухолевого материала
Донорами опухолевого материала являлись пациентки с ЗНО толстого кишечника (стадии T3–T4), проходящие лечение в ФГБУ «НМИЦ онкологии» Министерства здравоохранения РФ. От каждого донора было получено добровольное письменное согласие на передачу биологического материала. Опухолевый материал от всех пациенток был получен в ходе хирургической резекции.
Наркотизация лабораторных животных
Животным выполняли премедикацию путем внутримышечного введения 1,5 мл/кг препарата «Ксила» (Interchemie werken «De Adelaar» B.V, Нидерланды). Через 15 минут проводили внутримышечную инъекцию препарата «Золетил 100» (Virbac, Франция) в дозе 50 мг/кг. Процедура наркотизации была проведена в соответствии с запатентованным ранее способом [10].
Процедура создания подкожной PDX-модели
Создание подкожной PDX-модели начинали с обработки паховой области 10%-ным раствором повидон-йода, после чего производили надрез длиной 10 мм. Через кожное отверстие вставляли прямой острый пинцет, сдвигая подкожную жировую клетчатку каудальнее, и имплантировали опухолевый фрагмент. Пинцет извлекали, удерживая фрагмент в ране. Края раны соединяли, накладывая простой узловой шов, с использованием материала пролен 4-0.
Процедура создания ортотопической PDX-модели
Создание ортотопической PDX-модели начинали с обработки брюшной поверхности животного 10%-ным раствором повидон-йода, после чего проводили послойное рассечение кожи и тканей брюшной стенки вдоль тела. Для удобства манипуляций толстую кишку животного выводили в операционную рану и формировали карман, в который погружали фрагмент опухоли, полученный от пациента. После процедуры имплантации затягивали лигатуру и помещали кишку в брюшную полость. Послойное ушивание стенки брюшной полости осуществляли с помощью шовного материала пролен 5-0.
Анализ роста подкожных и ортотопических ксенографтов, полученных от пациенток
С целью оценки успешности ксенотрансплантации и характера роста опухоли проводили замеры подкожных опухолевых узлов с помощью электронного штангенциркуля (ШЦЦ-I-150-0.01). Для оценки характера роста ортотопических ксенотрансплантатов проводили процедуру контрольной лапаротомии на 20-е, 50-е и 70-е сутки после имплантации.
Объемы опухолевых узлов определяли по формуле Шрека для эллипсоида:
V=а×в×с×p/6,
где а, в, с – измерения опухолевого узла в трех плоскостях.
Процедура эвтаназии
На 90-е сутки эксперимента проводили процедуру эвтаназии путем дислокации шейных позвонков. После эвтаназии выполняли выделение опухолевых узлов для дальнейших исследований.
Гистологический анализ
Свежеизолированный опухолевый материал помещали в 10%-ный раствор формалина на 24 часа, после чего образцы подвергали обезвоживанию и заключали в парафин. Серийные срезы окрашивали гематоксилином и эозином (Sigma). Изображения получали с помощью светового микроскопа (ZEISS).
Статистический анализ
Статистическую обработку данных осуществляли с помощью программы Statistica 10.0 (StatSoft. Inc., США). Анализ достоверности различий между изучаемыми группами проводили с помощью произвольных таблиц сопряженности с использованием критерия хи-квадрат.
Результаты исследования и их обсуждение
Для выполнения данной работы в результате процедуры хирургической резекции были получены образцы первичных опухолей от четырех пациенток, ранее не получавших химиотерапию. Свежерезецированный опухолевый материал транспортировали из операционной в виварий Испытательного лабораторного центра в питательной среде для культуры клеток с добавлением антибиотика. Образец от каждого пациента был разделен на равные фрагменты и имплантирован в подкожный (n=5) и ортотопический сайт (n=5), который был представлен дистальными отделами толстого кишечника (рис. 1).
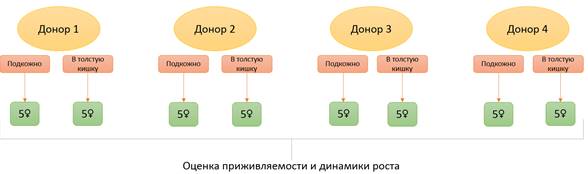
Рис. 1. Дизайн эксперимента
Приживление PDX считалось успешным, если пересаженные опухоли начинали расти в течение 3 месяцев.
Показатели приживления подкожных и ортотопических ксенотрансплантатов представлены в таблице.
Процент приживления опухолевого материала, полученного от пациенток
|
Номер пациента-донора |
Процент приживления |
|
|
|
Ортотопический сайт |
Гетеротопический сайт |
|
№ 1 |
40% (2/5) |
80% (4/5) |
|
№ 2 |
60% (3/5) |
40% (2/5) |
|
№ 3 |
40% (2/5) |
40% (2/5) |
|
№ 4 |
Опухолевый материал не прижился |
Опухолевый материал не прижился |
По результатам проведенного анализа статистически значимых отличий между факторным (сайт имплантации) и результативным (% приживления опухолевого материла) признаками обнаружено не было (p=7,81, р>0,05). Полученные результаты позволяют говорить о том, что успех приживления опухолевого материла не зависит от выбранного сайта имплантации и, возможно, детерминирован другими факторами. Из четырех процедур ксенотрансплантации три привели к формированию опухолевых узлов как в гетеротопическом, так и в ортотопическом сайтах; у животных, получивших биоматериал от донора № 4, не наблюдался опухолевый рост в обоих сайтах имплантации; таким образом, общий показатель результативности составил 75%.
Ксенотрансплантаты, созданные на основе опухолевых фрагментов, полученных от пациенток-доноров № 1, № 2 и № 3, продемонстрировали относительно непродолжительный латентный период, длящийся от 30 до 60 дней, после чего наблюдалась экспоненциальная фаза роста. Динамика роста представлена на рисунках 2, 3 и 4.
Наблюдаемая динамика роста подкожных ксенотрансплантатов, полученных от доноров № 1, № 2 и № 3, характеризовалась постепенным увеличением объемов опухолевых узлов как при гетеротопическом, так и при ортотопическом варианте имплантации.
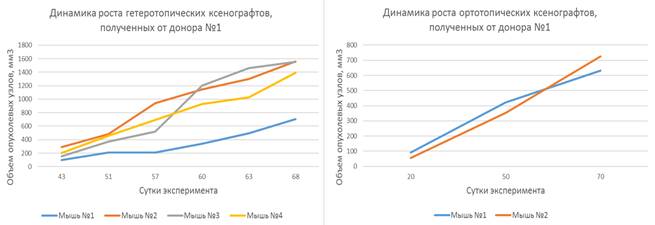
Рис. 2. Динамика роста гетеротопических и ортотопических ксенотрансплантатов, полученных от донора № 1
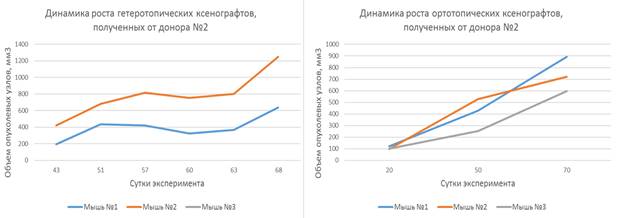
Рис. 3. Динамика роста гетеротопических и ортотопических ксенотрансплантатов, полученных от донора № 2
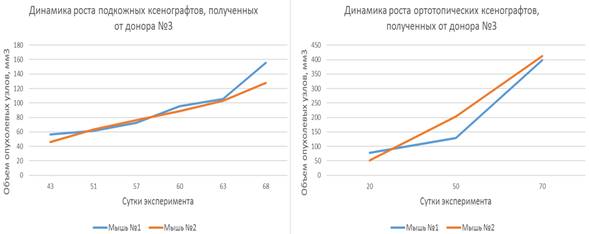
Рис. 4. Динамика роста гетеротопических и ортотопических ксенотрансплантатов, полученных от донора № 3
Результаты процедуры лапаротомии убедительно продемонстрировали экзофитный рост и выраженную сосудистую сеть на опухолевых узлах у всех ортотопических PDX-моделей, а также наличие метастатического поражения у некоторых животных (рис. 5). Объемы ортотопических ксенографтов были сопоставимы с таковыми у подкожных.
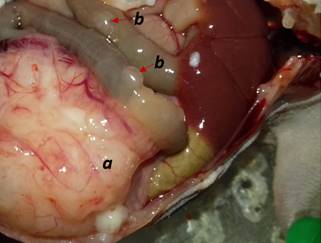
Рис. 5. Процедура лапаротомии (a – опухолевый узел, b – метастаз)
Результаты проведенного гистологического исследования продемонстрировали соответствие PDX-модели гистотипу и степени дифференцировки первичной опухоли пациента.
В настоящее время модели PDX являются востребованной экспериментальной модельной системой, способной воспроизвести важные биологические черты опухолей человека. В ходе данной работы были созданы как гетеротопические, так и ортотопические PDX-модели рака толстой кишки. Согласно исследованию Y. Koga и A. Ochiai (2019), создание гетеротопических (подкожных) PDX является наиболее распространенной процедурой, в 80% всех проанализированных авторами публикациях упоминается именно этот вариант ксенотрансплантации [11]. Тем не менее, ортотопический сайт считается более предпочтительным для нескольких типов рака, включая первичную или метастатическую опухоль головного мозга, рак молочной железы и рак почки [12]. Кроме того, ортотопическая имплантация может увеличить частоту метастазов во время роста ксенотрансплантата и должна рассматриваться как приоритетная, когда метастазирование опухоли является предметом исследования [13].
Однако в работе B. Rashidi с соавторами (2000) было продемонстрировано, что нередко создание ортотопической PDX-модели сопровождается непроходимостью и преждевременной гибелью животного-носителя, связанными с быстрым ростом опухоли человека в слизистой оболочке толстого кишечника мыши [14]. Но в ходе нашей работы описанный характер роста PDX-модели не наблюдался.
В результате эксперимента была проведена оценка приживления и динамики роста PDX рака толстой кишки человека при ортотопической и гетеротопической локализации. Зависимости показателей приживления ксенотрансплантатов, полученных от 4 пациенток с диагнозом «рак толстого кишечника», и скорости роста от используемых сайтов имплантации в данном эксперименте не наблюдалось.
В работе Н.А. Нефёдовой и П.Г. Малькова (2015) подчеркивается роль опухолевых стволовых клеток (ОСК) в канцерогенезе РТК. «Иерархическая» модель развития опухоли объясняет механизм регуляции пролиферативного потенциала путем выделения растворимых факторов роста мезенхимальными клетками [14].
На основании полученных результатов и анализа литературы можно сделать вывод о том, что процент приживления опухолевого материала не зависит от выбранного сайта имплантации, а определяется гетерогенностью свежеизолированных опухолевых фрагментов. Данная особенность могла стать причиной попадания различного количества ОСК в ксенотрансплантат.
Заключение
Проведенный эксперимент позволяет предположить, что успех имплантации и высокая приживляемость определяются клеточным составом имплантируемых фрагментов, таким образом, минимизируется роль сайта имплантации при создании PDX-модели. Гетерогенность опухолевого материала, полученного от пациентов, детерминирует различия пролиферативного потенциала опухолевых клеток, а также определяет вероятность метастатического поражения прилегающих тканей и локорегиональных лимфатических узлов. Перспективным представляется определение роли гетерогенности клеточного состава и количества ОСК в образцах опухолей, полученных от пациента, при создании как гетеротопических, так и ортотопических PDX-моделей рака толстого кишечника.
Библиографическая ссылка
Заикина Е.В., Гончарова А.С., Лукбанова Е.А., Егоров Г.Ю., Димитриади С.Н., Волкова А.В., Позднякова В.В., Киблицкая А.А., Касьяненко В.Н., Ходакова Д.В., Миндарь М.В., Курбанова Л.З. ОЦЕНКА ПРИЖИВЛЕНИЯ И ДИНАМИКИ РОСТА PDX РАКА ТОЛСТОЙ КИШКИ ЧЕЛОВЕКА В ЗАВИСИМОСТИ ОТ САЙТА ИМПЛАНТАЦИИ // Современные проблемы науки и образования. 2021. № 3. ;URL: https://science-education.ru/ru/article/view?id=30902 (дата обращения: 05.02.2026).
DOI: https://doi.org/10.17513/spno.30902



