Одним из приоритетных современных направлений исследований стало изучение семейства белков сиртуинов (SIRTUIN1-7) в связи с их значительной ролью в регуляции клеточного гомеостаза у млекопитающих. SIRT1, один из семейства этих белков, регулирует процессы метаболизма в организме, что в существенной степени определяет его роль в развитии ряда патологий, в том числе различных видов рака [1].
Известно, что роль окислительного стресса в процессе развития злокачественных опухолей неоднозначна. С одной стороны, окислительный стресс способен индуцировать процессы, играющие важную роль в инициации опухолевого роста. Установлено, что повышение продукции активных форм кислорода, в том числе и под действием ультрафиолетового излучения, способствует повышению продукции меланина и меланомогенезу [2]. C другой стороны, при поздних стадиях развития опухоли окислительный стресс способствует гибели опухолевых клеток и предотвращает метастазирование [3].
Существует определенное количество исследований, показывающих положительное влияние ограничения калорийности при злокачественных новообразованиях, в частности меланоме [4].
Тем не менее механизмы опухольсупрессивного эффекта ограничения калорийности до сих пор окончательно не исследованы.
Цель исследования
Изучение влияния низкокалорийной диеты на экспрессию гена sirt1 и активность ферментов антиоксидантной системы в опухолевых клетках и клетках печени у мышей линии С57ВL6 с экспериментальной меланомой В-16.
Материалы и методы исследования
Объект исследования – самки мышей линии С57/BL6 массой 20–22 г. Мышей содержали при постоянной температуре 20–22°C со световым периодом 12 ч в индивидуальных клетках. Диета животных была строго сбалансирована, для чего использовался гранулированный полнорационный комбикорм «Чара» (ГОСТ ISO 9001-2011(ISO 9001:2008).
Список экспериментальных процедур одобрен этическим комитетом ГБОУ ВПО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого (протокол № 57/2014).
Для исследований в качестве контрольных образцов использовали мышей, находящихся на базовой диете (adlibitum), – 1-я группа, и на диете, составляющей 70% от диеты, удовлетворяющей физиологические потребности животных, – 2-я группа. Опытным животным подкожно перевивали 5х105 клеток меланомы B-16 в 0,5 мл раствора Хенкса. После трансплантации опухоли меланомы В-16 мыши случайным образом были разделены на две опытные группы: 3-я группа (7 мышей) получала диету 1-й группы; 4-я группа (8 мышей) получала диету 2-й группы. На 22-е сутки, после эвтаназии животных, опухоль иссекали в пределах непораженных тканей и извлекали печень.
Уровень экспрессии гена sirt1 определяли в опухолевой ткани и оценивали с помощью полимеразной цепной реакции в реальном времени. Постановку метода осуществляли на приборе StepOne™ Real-Time PCR System (Applied Biosystems, Сингапур). Очищенную РНК предварительно подвергали обратной транскрипции со случайными гексамерными праймерами. Реакционная смесь для обратной транскрипции содержалa 5 мкл ОТ-буфера, 1 мкл 25 мМ случайных праймеров, 2 мкл 20 мМ дитиотреитола, 1 мкл 25 мМ дНТФ, 5 е.а. фермента MMLV обратной транскриптазы, 4 мкл раствора РНК (около 2 мкг), воду без нуклеаз до конечного объема 25 мкл. 2 мкл полученной комплементарной ДНК добавляли в ПЦР-смесь следующего состава: 10 мкл ПЦР-смеси (Синтол, Москва, Россия), 1 мкл смеси праймеров и зонда, специфичных для участка гена sirt1 мыши, 12 мкл безнуклеазной воды. Реакцию проводили в соответствии с указаниями производителя праймеров. По окончании реакции относительный уровень экспрессии сиртуина 1 рассчитывали по методу ΔΔCt [5]. В качестве внутреннего контроля использовали экспрессию гена бета-актина.
Гомогенат печени использовали для определения содержания малонового диальдегида, активности антиоксидантных ферментов – супероксиддисмутазы (СОД), каталазы (КТ), глутатионпероксидазы (ГПО) и глутатион-S-трансферазы (ГSТ).
Содержание малонового диальдегида (МДА), продукта перекисного окисления липидов, оценивалось по уровню хромогена, образующегося при взаимодействии МДА с 2-тиобарбитуровой кислотой, интенсивность окраски которого регистрировалась при длине волны 532 нм. Уровень МДА рассчитывали, учитывая коэффициент молярной экстинкции образовавшегося хромогена, равный 1,56*105М-1*см-1, и выражали в мкмоль/г белка [6].
В основу метода определения активности СОД положено ингибирование реакции аутоокисления адреналина в щелочной среде в присутствии СОД вследствие дисмутации супероксидных анион-радикалов, которые являются продуктом одного из этапов. Об интенсивности аутоокисления адреналина судили по динамическому нарастанию поглощения при длине волны 347 нм, обусловленному накоплением продукта окисления, не описанного ранее в литературе, и опережающему по времени образование адренохрома, имеющего максимум поглощения при 480 нм [7].
Определение активности КТ основано на образовании окрашенного в желтый цвет комплекса не разрушенной в ходе каталазной реакции перекиси водорода с молибдатом аммония. Активность КТ рассчитывали, используя коэффициент экстинкции пероксида водорода, равный 22,2 * 103 мкМ-1 * см-1 при длине волны 400 нм, и выражали в мкмоль/мин * г белка [8].
Активность ГПО оценивали по изменению содержания ГSТ в пробах до и после инкубации с модельным субстратом – гидропероксидом трет-бутила – в ходе цветной реакции с ДТНБК [8]. Активность ГSТ определяли по скорости образования конъюгатов между ГSТ и 1-хлор-2,4-динитробензолом. Увеличение концентрации конъюгатов в ходе реакции регистрировали спектрофотометрически при длине волны 340 нм. Активность фермента рассчитывали с учетом коэффициента молярной экстинкции глутатион-S-конъюгатов, 9600 М-1см-1 [8].
По результатам исследования была сформирована база данных, на основе которой с помощью программы Statistica 8 осуществлялся статистический анализ при подсчете медианы и интерквартильного разброса (С25–С75 процентили). Проверку гипотезы о статистической значимости различий показателей двух выборок проводили с помощью непараметрического критерия Манна–Уитни.
Результаты исследования и их обсуждение
Установлено, что ограничение калорийности питания у животных с экспериментальной меланомой не приводит к достоверному повышению содержания МДА в гомогенате печени. Активность СОД и КТ при низкокалорийной диете достоверно не изменяется. Ограничение калорийности у животных с меланомой вызывает снижение активности ГПО и ГSТ в гомогенате печени в 1,6 и 1,2 раза соответственно (табл. 1).
Таблица 1
Изменение активности показателей антиоксидантной системы и содержания МДА при ограничении калорийности у мышей с экспериментальной меланомой; группа 3 – базовая диета, группа 4 – диета с ограничением калорийности (70% от базовой диеты)
|
Показатель |
Группа 3 n=10 (7) |
Группа 4 n=10 (8) |
|
Ме С25–С75 |
Ме С25–С75 |
|
|
МДА мкмоль/г белка |
4,20 3,68–4,57 |
5,91 3,90–7,41 |
|
COД у.е/мин/г белка |
1305,50 1188,0–1522,0 |
1544,50 1340,0–1576,0 |
|
КТ ммоль/мин/г белка |
262,90 260,30–265,70 |
290,55 287,40–292,50 |
|
ГПO мкмоль/мин/г белка |
5,63 5,04–7,74 |
3,52 3,34–4,29 Р<0,01 |
|
ГST ммоль/мин/г белка |
7,17 6,93–9,8 |
5,77 5,0–6,85 Р<0,01 |
Выявлено усиление экспрессии гена sirt1 в группе мышей, находящихся на диете с ограничением калорийности питания после перевивки клеток опухоли – «Опухоль + ОК», по сравнению с контрольной группой мышей без опухоли и с содержанием на рационе с ограничением калорийности – «ОК». При сравнении группы мышей, находящихся на базовой диете после перевивки клеток опухоли – «Опухоль + БД», с группой мышей без опухоли, находящихся на рационе питания без ограничения калорийности – базовая диета (БД), таких изменений экспрессии гена sirt1 не выявляется. Это может указывать на положительное влияние ОК на экспрессию данного гена и способно опосредовать ряд механизмов, направленных на замедление темпов развития опухоли (табл. 2).
Таблица 2
Влияние диеты на изменение экспрессии гена sirt1 у мышей с экспериментальной меланомой.
|
№ группы |
Обозначение группы |
x¯ (среднее) |
m (стандартная ошибка среднего) |
|
1 |
БД |
0,00058 |
0,00004 |
|
2 |
ОК |
0,00031 |
0,00003 |
|
3 |
БД + Опухоль |
0,00163 |
0,00162 |
|
4 |
ОК + Опухоль |
0,00097 |
0,00033 |
Примечание: ОК – ограничение калорийности; БД – базовая диета. Р1,2=0,00796; Р2,4=0,039
Ферментативная активность SIRT1зависит от уровня NAD+, что во многом определяет его регулирующую роль в клеточном метаболизме. Ограничение калорийности питания можно рассматривать как стрессовый фактор, влияющий на активность белков семейства сиртуинов (и SIRT1 в том числе). Вмешательство в изменение активности SIRT1 с помощью ограничения калорийности питания может быть одним из направлений, влияющих на процессы меланогенеза.
Усиление экспрессии гена sirt1 в тканях опухоли у мышей при ограничении калорийности питания по сравнению с группой мышей, находящейся на базовой диете, в наших экспериментах указывает на положительное влияние ОК на экспрессию данного гена и может опосредовать ряд механизмов, направленных на замедление темпов развития опухоли. Эти механизмы в существенной степени могут быть реализованы через изменение баланса клеточных про- и антиоксидантных систем.
СОД катализирует реакцию дисмутации супероксиданиона с образованием пероксида водорода. КТ обеспечивает удаление пероксида водорода. ГПО катализирует восстановление органических гидроперекисей и Н2О2. Одновременно в результате действия NАDPН-зависимой глутатионредуктазы происходит восстановление глутатиона, ГSТ использует глутатион для коньюгации с гидрофобными соединениями и восстановления органических пероксидов. ГSТ осуществляет обезвреживание различных органических соединений, к числу которых относятся вещества, обладающие канцерогенным действием.
Таким образом, ограничение калорийности не приводит к усилению продукции свободных радикалов и увеличению степени окислительного стресса в клетках печени мышей с экспериментальной меланомой, а способствует повышению антиоксидантной активности клеток печени. Можно предположить, что данные изменения способны оказывать воздействие на развитие клеток меланомы В-16 в целом. Известно, что одной из особенностей метаболизма, присущих опухолевым клеткам, является повышение продукции активных форм кислорода. Возможно, снижение уровня свободных радикалов способно изменять активность ряда сигнальных путей, в том числе МАРК-сигнальных путей (ERK и JNK), и инициировать гибель клеток меланомы путем апоптоза. Кроме того, установлено, что изменение уровня свободных радикалов способно модулировать действие некоторых противоопухолевых препаратов, в частности, влияя на NF-κB сигнальный путь [9].
Однако получены данные, что sirt1 способствует аутофагии, инициированной действием Н2О2 при окислительном стрессе. Предполагают, что в реализации этого эффекта принимают участие III PI3K/беклин 1 и сигнальный путь mTOR [10]. Следовательно, повышение экспрессии sirt1 может способствовать как гибели опухолевых клеток (аутофагия), так и снижению процесса апоптоза (рис.).
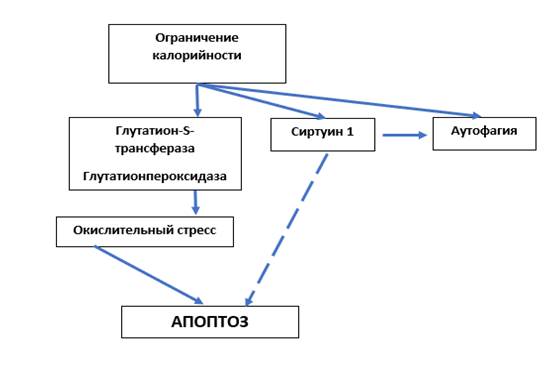
Механизм влияния ограничения калорийности на гибель опухолевых клеток
Заключение
Таким образом, эффекты, вызванные снижением калорийности рациона мышей с меланомой, имеют разнонаправленный характер, а их дальнейшее исследование играет важную роль в понимании фундаментальных механизмов процесса канцерогенеза.
Библиографическая ссылка
Фефелова Ю.А., Сергеева Е.Ю., Титова Н.М. СНИЖЕНИЕ КАЛОРИЙНОСТИ ПИТАНИЯ ИЗМЕНЯЕТ АКТИВНОСТЬ ФЕРМЕНТОВ АНТИОКСИДАНТНОЙ СИСТЕМЫ У МЫШЕЙ С МЕЛАНОМОЙ В-16 // Современные проблемы науки и образования. 2020. № 6. ;URL: https://science-education.ru/ru/article/view?id=30427 (дата обращения: 30.01.2026).
DOI: https://doi.org/10.17513/spno.30427



