Колоректальный рак (КРР) – группа злокачественных новообразований кишечника, которая занимает 4-е место среди всех онкологических заболеваний по числу летальных случаев [1]. Ежегодно во всем мире фиксируют около 1 000 000 новых случаев КРР и более 700 000 смертей от этого заболевания. В последнее десятилетие в России наблюдается значительное увеличение заболеваемости КРР [2]. В данной группе заболеваний наиболее распространенными являются опухоли прямой кишки [3]. В течение последних нескольких лет диагностика и лечение опухолей прямой кишки проводятся отдельно от других отделов кишечника. Комбинированные подходы к лечению, включая хирургическое вмешательство, предоперационную и послеоперационную химио- или радиотерапию, привели к улучшению показателей выживаемости [4].
Основным эффективным методом лечения рака прямой кишки, признанным как в России, так и во всем мире, остается выполнение предоперационной лучевой терапии с последующим хирургическим вмешательством [5]. Одним из вариантов лучевой терапии является курс облучения с разовой очаговой дозой (РОД) 2,4 Гр до суммарной очаговой дозы (СОД) 54 Гр [2]. Однако в практике имеются случаи отсутствия реакции у пациентов на предоперационную лучевую терапию, что связано с радиорезистентностью опухолевых клеток, зависящей от их молекулярно-генетических особенностей [2], в частности от пониженной или повышенной экспрессии определенной группы генов.
Ранее нами в модельном эксперименте была показана ассоциация показателя копийности генов, регулирующих репарацию ДНК, клеточный цикл и апоптоз, с радиорезистентностью опухолевых клеток [6]. Поэтому целью данной работы явилось исследование влияния транскрипционной активности генов BRCA2, H2AX, , RBBP8, CASP9 и BCL2 на эффективность предоперационной лучевой терапии опухолей прямой кишки.
Материалы и методы исследования. В исследовании использовали парные препараты биопсии (полученные при ВКС до облучения) прилегающих немалигнизированных (нормальных) и опухолевых тканей прямой кишки (аденокарцинома G1-2) 30 пациентов (медиана возраста 57 лет), проходивших лечение в ФГБУ «РНИОИ» МЗ РФ в 2018–2019 гг. Лучевая терапия проводилось на линейном ускорителе Novalis TX (Varian, США) (РОД=2,4 Гр до СОД=54 Гр). Образцы биопсии мгновенно замораживали в жидком азоте без использования транспортных РНК сохраняющих сред.
Выделение тотальной РНК проводили методом, описанным Chomczynski&Sacchi. Следы геномной ДНК удаляли с помощью ДНК-азы. Для синтеза библиотек комплементарной ДНК (кДНК) использовали наборы Reverta-L («Интерлабсервис», Россия) [7]. Методом RT-qPCR определяли величины относительной экспрессии 5 генетических локусов: BRCA2, H2AX, CASP9, RBBP8 и BCL2. В качестве референсных использовали гены GAPDH, ACTB и B2M. Последовательности высокоспецифичных олигонуклеотидов (праймеров) (табл. 1) разрабатывали с использованием NCBI GenBank и программы Primer-BLAST.
Таблица 1
Последовательности синтетических олигонуклеотидов
|
Наименование праймеров |
Хромосомная локализация |
Последовательность |
|
H2AX_F H2AX_R |
Chr 11: 119.09 – 119.1 |
GCACTTGGTAACAGGCACATC ACTCCCCAATGCCTAAGGTT |
|
RBBP8_F RBBP8_R |
Chr 18: 22.8 – 23.03 |
GCGAGTATTTTGGTATTTGACCTGT AGCTGCTTCCCGAGATGTTC |
|
BRCA2_F BRCA2_R |
Chr 13: 32.32 – 32.4 |
AGTTGGCTGATGGTGGATGG GGATCCACACCTGGAGTGTC |
|
BCL2_F BCL2_R |
Chr 18: 63.12 – 63.32 |
GGATCCAGGATAACGGAGGC GAAATCAAACAGAGGCCGCA |
|
CASP9_F CASP9_R |
Chr 1: 15.49 – 15.53 |
TGAGACCCTGGACGACATCT TCCCTTTCACCGAAACAGCA |
|
GAPDH_F GAPDH_R |
Chr 12: 6.53 – 6.54 |
GTCAAGGCTGAGAACGGGAA TCGCCCCACTTGATTTTGGA |
|
B2M_F B2M_R |
Chr 15: 44.71 – 44.72 |
AGATGAGTATGCCTGCCGTG CCATGATGCTGCTTACATGTCTC |
|
ACTB_F ACTB_R |
Chr 7: 5.53 – 5.56 |
AACCGCGAGAAGATGACCC AGCACAGCCTGG TAGCAAC |
RT-PCR-амплификацию библиотек к ДНК проводили в 25 мкл реакционной смеси (12 нг кДНК, 0,25 мМ dNTPs, 2,5 мМ MgCl2, 1х-ый ПЦР-буфер и 1 ед. акт. SynTaq ДНК-полимеразы, 1х-ый краситель EVA-Green и по 500 нМ прямого и обратного праймеров) по следующей программе: денатурация: t=95°С 3 мин; далее 40 циклов: t=95°С 10 секунд, t=57°С 30 секунд (считывание флуоресцентного сигнала), t=72°С 30 секунд. Транскрипционную активность генетического локуса (RЕ) рассчитывали по формуле RЕ =2-ΔΔCt[7].
Статистический анализ выполняли в пакете программ Statistica 10. Для оценки нормальности распределения показателей применяли критерий Шапиро–Уилка (n<50). Для оценки различий использовали критерий Манна–Уитни для порогового уровня статистической значимости р<0,05. Для построения тепловых карт (Heatmap) и кластерного анализа (Hierarchical Clustering, Euclidean distance) применяли скрипты (собственной разработки) в среде программирования R (R-Studio версия 8.10.173.987) [6].
Результаты исследования и их обсуждение
Полученные в исследовании данные по транскрипционной активности 5 генетических локусов в биопсийных образцах опухолевой ткани были подвергнуты кластерному анализу (Hierarchical Clustering, Euclidean distance) (рис. 1).
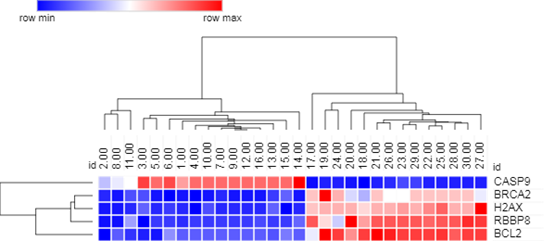
Рис. 1. Результаты кластерного анализа и тепловая карта транскрипционной активности генов в опухолевой ткани прямой кишки (n=30)
Как видно из представленных данных, было выделено два кластера – две группы пациентов, отличающихся по транскрипционному профилю генов BRCA2, H2AX, CASP9, RBBP8 и BCL2. В первой группе у 81% пациентов повышена экспрессия гена CASP9, у 100% снижена экспрессия генов BRCA2, H2AX, RBBP8 и BCL2. Во второй группе у 100% пациентов снижена экспрессия гена CASP9 и у 93% повышена экспрессия генов BRCA2, H2AX, RBBP8 и BCL2.
Сами генетические локусы также были разделены на разные кластеры, соответствующие выполняемой ими функции: BRCA2, H2AX, RBBP8 – регуляция репарации ДНК, CASP9 – проапоптозная функция, BCL2 – антиапоптозная функция. Визуально взаимодействие данных генов, а также сила этих взаимодействий представлены на рисунке 2 (рассчитано с помощью GIANT [8]). Эти гены являются компонентами различных сигнальных путей, а изменение их транскрипционной активности, вероятно, опосредованное изменением копийности [6], приводит к изменению экспрессии целого ряда других генов (рис. 3).
С помощью онлайн-сервиса GeneMANIA (Gene Multiple Association Network Integration Algorithm) были оценены особенности взаимодействия между генами BRCA2, BCL2, H2AX, RBBP8, CASP9 и SPO11, FKBP8, RAD50, APPL1, MRE11A, NBN, TP53BP1, RAD51, MDC1, DIABLO, APAF1, BIK, ATM, XRCC3, TEX15, PALB2, CASP6, BRCA1, MND1, GSN (табл. 2).
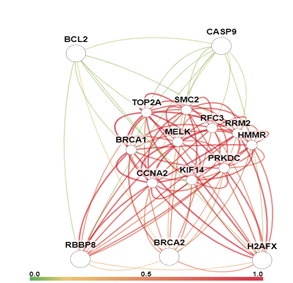

Рис. 2. Схема взаимодействия и сила взаимосвязи генов CASP9, BCL2, BRCA2, H2AX и RBBP8 в тканях прямой кишки
GeneMANIA использует алгоритм машинного обучения и предсказывает функцию генов в составе сложной сети из множества генов, присваивает оценку каждому узлу построенной сети. Эта оценка отражает силу связи [6].
Из представленных в таблице функций генов достаточно часто встречается такая, как изменение конформации ДНК. Эукариотическая ДНК упакована в виде хроматина, что представляет собой преграду для процессов, требующих взаимодействия ферментов с определенными сайтами ДНК. Поэтому для репарации ДНК после облучения хроматин должен быть ремоделирован [6].
Ген H2AX кодирует соответствующий гистоновый белок, который в ответ на двухцепочечные разрывы в ДНК, вызванные ионизирующим излучением, фосфорилируется по серину (γH2AX). За этот процесс ответственны киназы семейства PI3, в частности ATM (Ataxia telangiectasia mutated). Из-за этой модификации ДНК становится менее конденсированной, появляется место для присоединения белковых комплексов, необходимых для осуществления репарации [9].
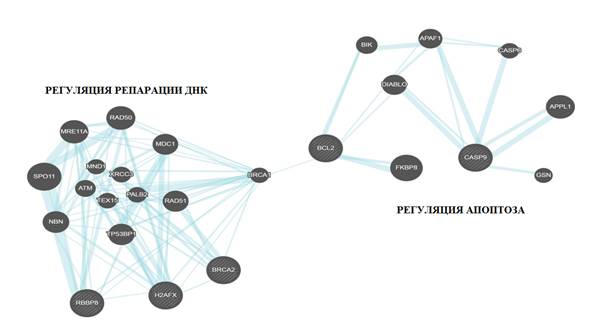
Рис. 3. Взаимодействия генов BCL2, BRCA2, H2AX, CASP9, RBBP8, рассчитанные с помощью алгоритма GeneMANIA
Таблица 2
Взаимодействия генов BCL2, BRCA2, H2AX, CASP9, RBBP8, вычисленные с помощью GeneMANIA
|
Ген |
Индекс |
Функция |
Ссылки |
|
RBBP8 |
0.66 |
Контроль клеточного цикла, контроль повреждения ДНК, восстановление двухцепочечного разрыва, репарация повреждения ДНК |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=100616139 |
|
BRCA2 |
0.61 |
Восстановление двухцепочечных разрывов посредством гомологичной рекомбинации |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=675 |
|
H2AFX |
0.56 |
Контроль клеточного цикла, изменение конформации ДНК, контроль повреждения ДНК, восстановление двухцепочечного разрыва посредством гомологичной рекомбинации, регуляция ответа на повреждения ДНК, регуляция клеточного ответа на стресс, регуляция репарации ДНК, реакция на ионизирующее излучение |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=3014 |
|
BCL2 |
0.55 |
Регуляция апоптотического сигнального пути в ответ на повреждение ДНК, в ответ на радиацию |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=596 |
|
CASP9 |
0.54 |
Активация эндопептидазы цистеинового типа, участвующей в апоптотическом процессе, клеточный ответ на радиацию, сигнальный путь апоптоза в ответ на повреждение ДНК, позитивная регуляция запрограммированной гибели клеток |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=842 |
|
SPO11 |
0.07 |
– |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=23626 |
|
FKBP8 |
0.07 |
– |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=23770 |
|
RAD50 |
0.05 |
АТФ-зависимая ДНК-геликазная активность, изменение конформации ДНК, геометрическое изменение ДНК, восстановление двухцепочечного разрыва посредством гомологичной рекомбинации, реципрокная мейотическая рекомбинация |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=10111 |
|
APPL1 |
0.05 |
Положительная регуляция апоптоза |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=26060 |
|
MRE11A |
0.05 |
Изменение конформации ДНК, рекомбинация ДНК, восстановление двухцепочечных разрывов посредством гомологичной рекомбинации, поддержание теломер |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=4361 |
|
NBN |
0.05 |
Изменение конформации ДНК, рекомбинация ДНК, восстановление двухцепочечных разрывов посредством гомологичной рекомбинации, поддержание теломер |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=4683 |
|
TP53BP1 |
0.04 |
Восстановление двухцепочечных разрывов посредством гомологичной рекомбинации |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=7158 |
|
RAD51 |
0.04 |
Изменение конформации ДНК, геометрическое изменение ДНК, восстановление двухцепочечного разрыва посредством гомологичной рекомбинации |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=5888 |
|
MDC1 |
0.04 |
Контроль целостности ДНК, восстановление двухцепочечного разрыва с помощью гомологичной рекомбинации |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=9656 |
|
DIABLO |
0.04 |
Активация эндопептидазы цистеинового типа, позитивная регуляция апоптотического процесса |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=56616 |
|
APAF1 |
0.04 |
Активация эндопептидазы цистеинового типа, позитивная регуляция апоптотического процесса |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=317 |
|
BIK |
0.03 |
– |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=638 |
|
ATM |
0.03 |
Контроль клеточного цикла и клеточного ответа на радиацию, восстановление двухцепочечных разрывов, позитивная регуляция запрограммированной гибели клеток |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=472 |
|
XRCC3 |
0.02 |
– |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=7517 |
|
TEX15 |
0.02 |
– |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=56154 |
|
PALB2 |
0.02 |
Восстановление двухцепочечного разрыва с помощью гомологичной рекомбинации |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=79728 |
|
CASP6 |
0.02 |
– |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=839 |
|
BRCA1 |
0.02 |
Контроль клеточного цикла, передача сигнала p53, восстановление двухцепочечного разрыва посредством гомологичной рекомбинации, регуляция репарации ДНК и реакции на ионизирующее излучение |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=672 |
|
MND1 |
0.02 |
– |
http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=search&term=84057 |
|
GSN |
0.02 |
– |
http://www.ensembl.org/Homo_sapiens/geneview?gene=ENSG00000148180 |
Далее с комплексом γH2AX/MDC1 связываются две убиквитинлигазы – RNF8 и RNF168, которые осуществляют убиквитилирование других компонентов хроматина, что в итоге позволяет BRCA1 присоединиться к модифицированному γH2AX/MDC1 хроматину [10]. На участке γH2AX-модифицированного хроматина также собирается комплекс MRN (состоящий из Mre11, Rad50 и Nbs1), RAD51 и АТМ [11]. Для перемещения белка RAD51 к двухцепочечному разрыву в ДНК требуется образование комплекса BRCA1-PALB2-BRCA2 [12]. Его образованию способствует модулирующее действие на функции BRCA1 белка, кодируемого геном RBBP8 [13]. Соответственно гиперэкспрессия генов BRCA2, H2AX и RBBP8 в клетках опухолей прямой кишки может повышать эффективность работы системы репарации ДНК и обеспечивать их выживание при воздействии лучевой терапии.
Продукты генов BCL2 и CASP9 вовлечены в регуляцию апоптоза. BCL2 является антиапоптозным белком, контролирует проницаемость митохондриальной мембраны и ингибирует каспазы за счет предотвращения выхода цитохрома C из митохондрий и за счет связывания APAF1 – фактора, активирующего апоптоз. Инициаторная каспаза CASP9 выполняет критическую для запуска апоптоза функцию [6].
Можно предложить, что в первой группе пациентов, где повышена экспрессия проапоптозного гена CASP9 и снижена экспрессия антиапоптозного гена (BCL2) и генов, регулирующих репарацию ДНК (BRCA2, H2AX, RBBP8), воздействие лучевой терапии окажется более эффективным в силу сниженной активности репарационной системы и повышенной чувствительности к стрессиндуцированному апоптозу, чем во второй группе.
Последующий анализ результатов лучевой терапии рака прямой кишки у 30 пациентов позволил подтвердить это предположение. Так, у 16 пациентов после лучевой терапии наблюдался полный регресс опухоли, при этом в их опухолевом биопсийном материале экспрессия генов H2AX и RBBP8 была снижена в 2,0 раза (р<0,05), а экспрессия гена CASP9 повышена в 4,5 раза (р<0,005) относительно нормальной ткани. У 8 пациентов наблюдался незначительный регресс опухоли, а у 6 пациентов регресс отсутствовал, при этом у них статистически значимо (р<0,005) экспрессия генов BRCA2, H2AX, RBBP8 и BCL2 была выше в 2,5, 4,0, 6,0 и 3,3 раза соответственно (в 2,0, 3,0, 2,5 и 5,0 раз относительно нормы), а гена CASP9 – в 4,5 раза ниже, чем экспрессия у пациентов с полным регрессом опухоли (рис. 4).
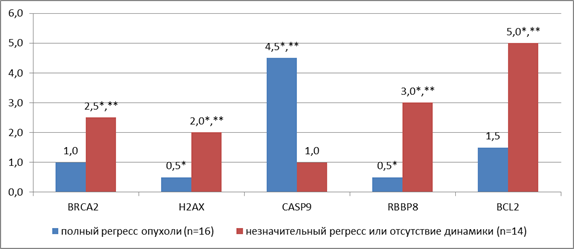
Рис. 4. Транскрипционная активность генов в опухолевой ткани прямой кишки
у двух групп больных (с полным регрессом или его отсутствием).
* – статистически значимые отличия относительно нормы (р<0,005),
** – статистически значимые отличия одной группы от другой
Заключение. Таким образом, проведенное исследование позволило установить, что транскрипционная активность генов BRCA2, H2AX, CASP9, RBBP8 и BCL2 влияет на эффективность лучевой терапии, которая возрастает у пациентов с повышенной экспрессией гена CASP9 и сниженной экспрессией H2AX и RBBP8, и наоборот – эффективность терапии падает при повышенной экспрессии H2AX, RBBP8, BRCA2 и BCL2.
Работа выполнена в рамках госзадания «Поиск предикторов радиорезистентности рака прямой кишки и разработка персонифицированных неоадьювантных терапевтических подходов».
Библиографическая ссылка
Кутилин Д.С., Кошелева Н.Г., Гусарева М.А., Харагезов Д.А., Донцов В.А., Полуэктов С.И., Зема Т.В., Лиман Н.А., Шляхова О.В., Удаленкова И.А. ВЛИЯНИЕ ТРАНСКРИПЦИОННОЙ АКТИВНОСТИ ГЕНОВ, РЕГУЛИРУЮЩИХ РЕПАРАЦИЮ ДНК, НА ЭФФЕКТИВНОСТЬ ЛУЧЕВОЙ ТЕРАПИИ ОПУХОЛЕЙ ПРЯМОЙ КИШКИ // Современные проблемы науки и образования. 2019. № 6. ;URL: https://science-education.ru/ru/article/view?id=29353 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.29353



