Апоптоз, один из важнейших механизмов поддержания гомеостаза, осуществляется как в физиологических, так и в патологических условиях. В настоящее время проблеме апоптоза и его влиянию на течение и исход различных патологических процессов уделяется много внимания. Апоптоз характеризуется рядом характерных морфологических изменений в структуре клетки, а также рядом ферментзависимых биохимических процессов. В результате происходит элиминация клеток из организма с минимальным повреждением окружающих тканей. Нарушения в процессе апоптоза могут приводить к накоплению поврежденных клеток. Поэтому понимание путей апоптоза важно для разработки эффективной терапии при многих заболеваниях [1].
Семейство белков Bcl играет важную роль в регуляции апоптоза, и среди них есть как про-, так и антиапоптотические типы [2].
Белки семейства Bcl-2 признаны основными регуляторами митохондриального пути апоптоза. Они контролируют проницаемость наружной мембраны митохондрий. Кроме того, Bcl-2 белки также обнаружены в других внутриклеточных компартментах, таких как эндоплазматическая сеть, аппарат Гольджи, ядро, пероксисомы. На уровне этих органелл белки семейства Bcl-2 не только регулируют проницаемость наружной мембраны митохондрий удаленно, но также участвуют в основных клеточных процессах, включая гомеостаз кальция, контроль клеточного цикла и миграцию клеток. С развитием методов визуализации живых клеток и созданием флуоресцентных рекомбинантных белков стало ясно, что распределение белков Bcl-2 внутри клетки является динамическим процессом, на который глубоко влияют изменения в клеточном микроокружении. Высокодинамичный процесс внутриклеточного распределения белков семейства Bcl-2 является критическим для определения судьбы клетки [3, 4, 5]. Белки Bcl-2 функционируют посредством межбелковых взаимодействий. Воздействие на белки семейства Bcl-2 открывает новые возможности воздействия на патологические процессы [6].
Поскольку семейство белков Bcl2 является ключевым регулятором апоптоза, нарушения его функций способствуют развитию многих заболеваний, включая рак, нейродегенеративные расстройства и аутоиммунные заболевания [7].
Апоптоз также играет решающую роль в репаративных процессах регенерации. В частности, контроль над плотностью клеток в ткани, образующейся в месте заживления раны, опосредуется апоптозом [8-10].
Цель работы: изучить экспрессию белков семейства Bcl в условиях повреждения брюшины при естественном течении процесса и при блокаде р38 МАРК.
Материал и методы исследования
В качестве модели спаечного процесса в брюшной полости использовали самцов крыс линии Вистар [11, 12]. Представителям контрольной группы (N=40) был введен в брюшную полость физиологический раствор (3 мл), представителям опытной группы (N=40) – препарат «Серогард»® того же объема (АО «Фармасинтез», Россия, товарный знак (знак обслуживания) № 529254 «СЕРОГАРД»). Фармакодинамическим эффектом препарата «Серогард»® является пролонгированная блокада активности p38 MAPK (митогенактивируемой протеинкиназы) [13].
Все исследования проведены с соблюдением этических норм. Исследование одобрено комитетом по этике Иркутского научного центра хирургии и травматологии.
Исследования проводили на 8 временных точках в сроки от 2 часов до 30 суток. Проводили иммуногистохимическое окрашивание образцов. В ходе исследования применяли:
– антитела к Bcl2 rabbit polyclonal (Abbiotec Cat. № 250555, Lot 09110202) в рабочем разведении 1:300 (исследование антиапоптоза);
– Bclx rabbit monoclonal (Epitomics, Cat. № 1018-3, Lot E-07-12-01) в рабочем разведении 1:100 (исследование проапоптоза).
Для математической оценки интенсивности апоптоза и антиапоптоза производили подсчет количества окрашенных Bclx и Bcl2 клеток по отношению к неокрашенным. Определяли медиану, 25%-ный и 75%-ный квартили.
Результаты исследования и их обсуждение
Нами произведены подсчет процента окрашенных на Bclx и Bcl2 клеток и сравнение интенсивности окрашивания внутри основной и контрольной групп, а также между ними.
Таблица 1
Окраска на Bcl2 и Bclx клеток внутри основной и контрольной группы
|
Срок |
Основная |
Pu |
Контроль |
Pu |
||
|
Bcl2, % |
Bclx, % |
Bcl2, % |
Bclx, % |
|||
|
2 часа |
1,5 (1–3) |
1,5 (0–2) |
1,0 |
10,5 (10–12) |
6,0 (5–7) |
0,0277 |
|
6 часов |
15 (10–17) |
5 (2–8) |
0,0431 |
3,5 (1–5) |
5,0 (2–15) |
0,1775 |
|
12 часов |
3 (3–3) |
17,5 (13–21) |
0,0277 |
35 (17–50) |
12,5 (10–20) |
0,0116 |
|
24 часов |
26 (22-30) |
40 (38–40) |
0,0277 |
46,5 (37–52) |
32 (30–38) |
0,0464 |
|
3 суток |
7,5 (3–10) |
20 (15–20) |
0,0277 |
47 (40–50) |
41 (35–50) |
0,2339 |
|
7 суток |
3,5 (3–5) |
2,5 (2–5) |
0,8339 |
2,5 (2–5) |
2,5 (2–3) |
0,8339 |
|
14 суток |
2,5 (2–5) |
5,5 (5–7) |
0,0277 |
89,5 (87–95) |
91 (85–93) |
0,8339 |
|
30 суток |
9 (7–30) |
23,5 (21–25) |
0,1158 |
14 (12–15) |
56 (42–65) |
0,0277 |
Как следует из таблицы 1, в контрольной группе экспрессия проапоптозных и антиапоптозных белков первые часы течет параллельно. К 12, 24 часам экспрессия Вcl2 интенсивнее, чем Bclx. К 14-м суткам экспрессия Bclx и Bcl2 максимальная, а к 30-м суткам экспрессия Bclx в области формирования спайки высокая и значимо отличается от Bcl2 (рис. 1).
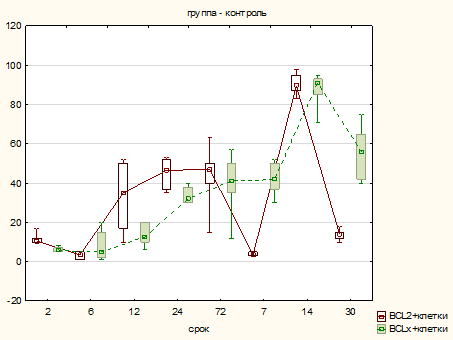
Рис. 1. Интенсивность окраски Bclx и Bcl2 клеток контрольной группы
В контрольной группе к 6 часам экспрессия Bcl2 выше, а к 12, 24 часам, наоборот, экспрессия Bclx значительнее, чем Bcl2. К 3-м суткам интенсивность окраски на Bclx уменьшается вдвое, но все же выше, чем Bclx. На 14-е сутки окраска на Bcl2 и Bclx минимальная и сохраняется такой до 30 суток (рис. 2).
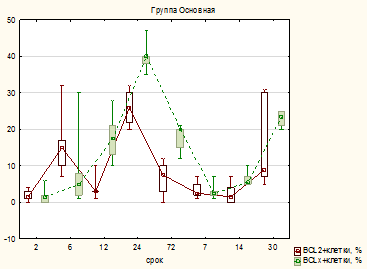
Рис. 2. Интенсивность окраски Bclx и Bcl2 клеток в основной группе
Закономерности экспрессии Bcl2 и Bclxl клеток при сравнении между основной и контрольной группами представлены в таблице 2.
Таблица 2
Сравнение интенсивности окраски Bclx и Bcl2 клеток между группами
|
Срок |
Bcl2, % |
Pu |
Bclx, % |
Pu |
||
|
Основная |
Контроль |
Основная |
Контроль |
|||
|
2 часа |
1,5 (1–3) |
10,5 (10–12) |
0,0049 |
1,5 (0–2) |
6,0 (5–7) |
0,0187 |
|
6 часов |
15 (10–17) |
3,5 (1–5) |
0,0078 |
5 (2–8) |
5,0 (2–15) |
0,9262 |
|
12 часов |
3 (3–3) |
35 (17–50) |
0,0054 |
17,5 (13–21) |
12,5 (10–20) |
0,2547 |
|
24 часа |
26 (22–30) |
46,5 (37–52) |
0,0050 |
40 (38–40) |
32 (30–38) |
0,0290 |
|
3 суток |
7,5 (3–10) |
47 (40–50) |
0,0017 |
20 (15–20) |
41 (35–50) |
0,0088 |
|
7 суток |
2,5 (3–5) |
2,5 (2–5) |
0,4107 |
2,5 (2–5) |
2,5 (2–3) |
0,4901 |
|
14 суток |
1,5 (0–4) |
89,5 (87–95) |
0,0049 |
5,5 (5–7) |
91 (85–93) |
0,0047 |
|
30 суток |
9 (7–30) |
14 (12–15) |
0,4217 |
23,5 (21–25) |
56 (42–65) |
0,00173 |
Как следует из таблицы 2, экспрессия Bcl2 увеличивается первые 6 часов в основной группе, в 12–24 часа значимо ниже, чем в контрольной группе, а в 3-и и 14-е сутки значительно ниже, чем в контрольной группе (рис. 3).
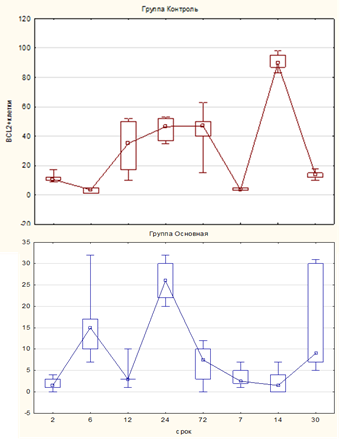
Рис. 3. Окраска на Bcl2 в основной и контрольной группах
Экспрессия Bclx значительно увеличивается к 3-м суткам в контрольной группе с максимумом интенсивности к 14-м и 30-м суткам по сравнению с основной группой (рис. 4).
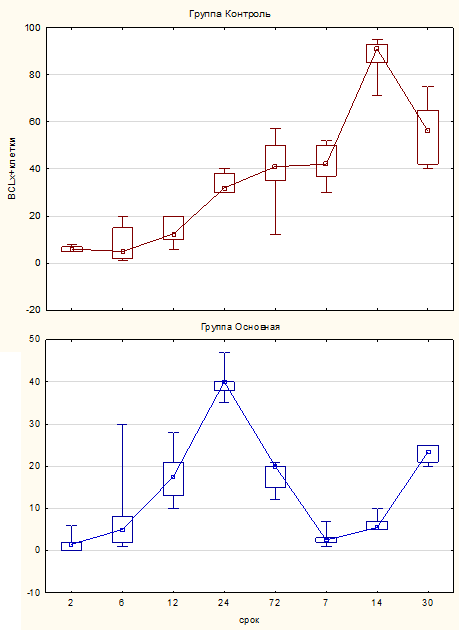
Рис. 4. Окраска на Bclx в основной и контрольной группах
Таким образом, в ходе исследования показано, что при экспериментальном повреждении брюшины запускаются как апоптоз, и антиапоптоз. В ранние сроки после повреждения брюшины превалирует окраска на маркеры антиапоптоза – до 3 суток, позднее на первый план выходят процессы апоптоза. Наиболее явно различия определяются к концу наблюдения – на 30-е сутки. За счет механизмов запуска апоптоза элиминируется большая популяция клеток фибробластического ряда из зоны повреждения брюшины [14, 15]. При этом окраска на выявление маркеров антиапоптоза в ткани имеет двухволновый характер с максимальной выраженностью на 1–3-и сутки и 14-е сутки процесса. Данные сроки совпадают с периодом роста грануляционной ткани (3-е сутки) и процессом ее созревания (14-е сутки). На финальной точке наблюдения (30-е сутки) количество клеток, демонстрирующих экспрессию антиапоптозных белков, резко снижается (рис. 5).
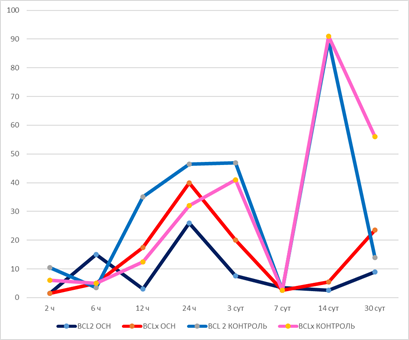
Рис. 5. Процессы апоптоза и антиапоптоза после травматического повреждения брюшины
Выводы
Нами установлено, что применение Серогарда® при экспериментальном спаечном процессе приводит к активации апоптоза фибробластов в зоне репарации. Указанный механизм действия может предопределить снижение спайкообразования в зоне травмы брюшины.
Библиографическая ссылка
Аюшинова Н.И., Шурыгина И.А., Чепурных Е.Е., Шурыгин М.Г. АПОПТОЗ В ЗОНЕ ФОРМИРОВАНИЯ СПАЕЧНОГО ПРОЦЕССА В БРЮШНОЙ ПОЛОСТИ: ВЛИЯНИЕ БЛОКАДЫ Р38 МАРК КАСКАДА // Современные проблемы науки и образования. 2019. № 6. ;URL: https://science-education.ru/ru/article/view?id=29307 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.29307



