Злокачественная меланома является одним из самых смертоносных и наиболее распространенных видов рака в кавказоидных популяциях, находящихся в условиях интенсивной инсоляции, что особенно характерно для Юга России [1]. До 2011 года диссеминированная меланома с относительно низкой эффективностью лечилась цитотоксическими препаратами, которые не могли улучшить показатели общей выживаемости. В последние годы лечение онкологических заболеваний улучшилось благодаря появлению персонализированных таргетных методов лечения. Это вызвало необходимость проведения рутинных молекулярно-генетических исследований опухолей на предмет наличия/отсутствия клинически значимых соматических мутаций [2-4]. В настоящее время проводится терапия меланомы кожи с использованием BRAF-ингибиторов [5], ингибиторов MEK (митоген-активируемых протеинкиназ), иммунотерапевтических подходов [6] и дендритно-клеточных вакцин [7].
Канонически, RAS-зависимые механизмы димеризации RAF являются одной из причин лекарственной устойчивости клеток меланомы [8; 9]. Возникновение активирующих соматических мутаций в гене KRAS можно рассматривать в качестве фактора, способствующего усилению RAF-димеризации даже без наличия активирующих соматических мутаций в генах семейства RAF. Частота проявляемости RAS-мутаций в клетках опухолей меланомы, детектируемая рутинными методами RT-PCR с чувствительностью от 1 до 5%, относительно низка. Это может объясняться тем, что титр содержания мутантных вариантов генов RAS, как правило, ниже уровней чувствительности рутинных методов детекции RT-PCR. Однако количество клеток с активирующими мутациями в генах RAS может увеличиться после создания селективных условий для их отбора при использовании таргетных препаратов, элиминирующие клетки-носители активирующих RAF-мутаций. Поэтому успешная детекция клинически значимых соматических мутаций зависит, с одной стороны, от количественной представленности в опухолях клеток, несущих детектируемую мутацию, а с другой - от чувствительности используемой системы детекции. В силу этого существует необходимость использования высокочувствительных методических подходов для скрининга низких титров соматических мутаций при лечении онкологических заболеваний.
Цель данного исследования состояла в скрининге клинически значимых активирующих соматических мутаций в гене KRAS, титр которых находится за пределами детекции рутинных методов RT-PCR, путем использования высокочувствительного метода капельной цифровой ПЦР (ddPCR). Наличие/отсутствие мутаций в гене KRAS может служить предиктивным фактором прогнозирования лекарственной чувствительности/устойчивости клеток меланомы.
Материал и методы исследования
В данное исследование включены 10 биоптатов образцов доброкачественных неоплазий кожи и образцы меланомы кожи, полученные от 26 пациентов Юга России. Все образцы ДНК проходили первичный скрининг на предмет наличия/отсутствия BRAF-мутаций V600E с использованием набора реактивов «Real-time-PCR-BRAF-V600E» («Биолинк», Новосибирск), имеющего 5%-ный уровень чувствительности. По результатам тестирования образцы разделились на группу BRAF WT (не имеющие мутаций в гене BRAF) и группу образцов BRAF MT (имеющие мутации в гене BRAF). Все пациенты проходили плановое лечение в Клиническом онкологическом диспансере № 1 МЗ КК (г. Краснодара) и ДГКБ МЗ КК (г. Краснодар). ДНК для исследования была получена из FFPE-блоков с использованием набора реагентов ReliaPrep™ FFPE gDNA Miniprep System (Promega, USA). Предварительная оценка концентрации и амплификабельности препаратов ДНК проводилась методом RT-PCR с использованием набора реагентов «XY-Детект» («Синтол», Россия). Концентрация ДНК в образцах нормализовывалась до уровня, соответствующего уровню амплификабельности нативной ДНК, равному 2 нг/мкл.
Высокочувствительный скрининг наличия/отсутствия 7 активирующих соматических мутаций (G12A, G12C, G12D, G12R, G12S, G12V и G13D) во втором экзоне гена KRAS и мутаций V600 (V600E, V600K и V600R) в гене BRAF проводили методом Digital Droplet PCR (ddPCR) с использованием наборов ddPCR KRAS Screening Multiplex Kit (Bio-Rad, USA) и BRAF V600 Screening Kit (Bio-Rad, USA) соответственно. Исследование проведено с соблюдением всех принципов ICH GCP. Статистическую обработку результатов проводили с использованием пакета прикладных программ Microsoft Excel 2013 (Microsoft Corporation, США) и Statistica 10.0 (StatSoft Inc., США).
Результаты исследования и обсуждение
В образцах исследованных нами доброкачественных новообразований кожи с использованием метода ddPCR активирующие соматические мутации в генах BRAF и KRAS не обнаружены. Таким образом, полученные в данном разделе экспериментальные данные свидетельствуют о том, что в изученных нами образцах неоплазий кожи наличие активирующих соматических мутаций в генах BRAF и KRAS не является механизмом селективного отбора клонов клеток с повышенной пролиферативной активностью на стадии доброкачественного новообразования.
Результаты наших дальнейших экспериментов наглядно демонстрируют (рис. 1), что содержание активирующих соматических мутаций в гене KRAS в группах пациентов BRAF (MT) и BRAF (WT) существенно различается. В образцах биоптатов меланомы кожи BRAF (WT) медиана содержания копий ДНК с активирующими мутациями в гене KRAS в 6 раз превышает аналогичный показатель для группы пациентов BRAF (MT).
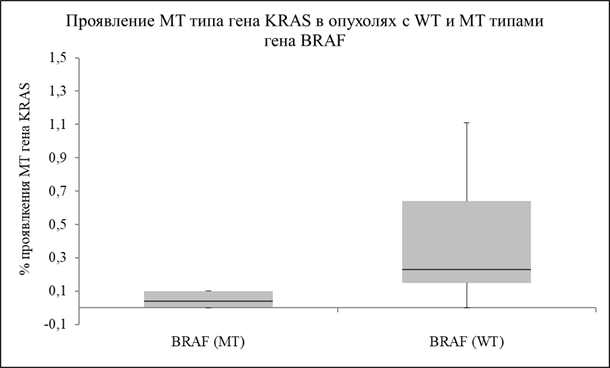
Рис. 1. Экспериментальные данные (медианы значений), полученные методом ddPCR, отражающие процентное содержание мутантного типа гена KRAS(MT) в биоптатах пациентов с меланомой кожи
При использовании теста Kruskall-Wallis доказаны статистически достоверные различия между медианами значений уровней соматических мутаций в гене KRAS для групп опухолевых биоптатов, BRAF(MT) и BRAF(WT) для p-value=2,1%. При использовании теста Манна-Уитни с коррекцией Bonferoni-Sidak доказано статистически достоверное различие между значениями средних арифметических для уровней соматических мутаций в гене KRAS для групп BRAF(MT) и BRAF(WT) для p-value=1,1%.
Нужно обратить внимание на то, что обнаруженные нами медианные уровни содержания активирующих мутаций в гене KRAS (0,04 и 0,24% соответственно для групп BRAF(MT) и BRAF(WT)) находятся значительно ниже уровня чувствительности детекции рутинных методов RT-qPCR (1-5%) и поэтому не могут быть обнаружены даже такими чувствительными тест-наборами, как «Therascreen® KRAS RGQ PCR Kit» (Qiagen). Полученные экспериментальные данные позволяют нам предположить, что опухолевые клетки меланомы кожи при малигнизации приобретающие активирующие соматические мутации в гене BRAF, с намного меньшей вероятностью подвержены клональной селекции клеток по признаку возникновения активирующих мутаций в гене KRAS. И наоборот, клетки меланомы кожи, не имеющие активирующих мутаций в гене BRAF, развиваются по другому пути активации сигнального пути EGFR→KRAS→BRAF: у этих клеток в процессе малигнизации с большей вероятностью отбираются клоны с наличием активирующих мутаций в гене KRAS. Это и обеспечивает им необходимый малигнизационный потенциал, даже при отсутствии активирующих мутаций в гене BRAF. Одновременный отбор клонов на наличие активирующих мутаций в генах KRAS и BRAF менее вероятен, но не исключен полностью: 40% образцов меланомы кожи, вошедших в данное исследование, содержали активирующие соматические мутации в генах KRAS и BRAF одновременно.
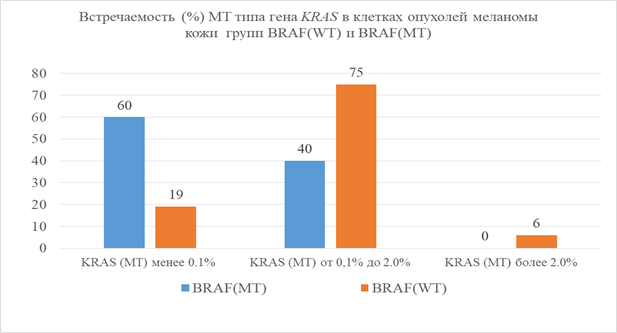
Рис. 2. Количественное распределение титра мутантных типов гена KRAS (в процентах от общего) в группах BRAF(WT) и BRAF(MT). Содержание активирующих мутаций на уровне менее 0,1%, в диапазоне от 0,1 до 2% и более 2%. По оси ординат – частота встречаемости данной группы событий среди всех образцов
На рисунке 2 представлены экспериментальные данные, демонстрирующие распределение пациентов на группы с различной количественной представленностью (%) активирующих соматических мутаций в гене KRAS. Так, например, 60% образцов меланомы кожи группы BRAF(MT) имеют титр активирующих мутаций в гене KRAS, не превышающий уровня 0,1% от всех регистрируемых событий, а 40% образцов меланомы кожи группы BRAF(WT) имели титр мутаций в гене KRAS в диапазоне от 0,1 до 2%, и ни один образец (0%) не содержал титра мутаций в гене KRAS, превышающего 2% от всех регистрируемых событий. Это свидетельствует о том, что в образцах меланомы кожи группы BRAF(MT) возникновение активирующих соматических мутаций в гене KRAS менее вероятно в силу того, что клональная селекция клеток при малигнизации преимущественно пошла по другому механизму: отбор клонов с наличием активирующих мутаций в гене BRAF.
При отсутствии активирующих соматических мутаций в гене BRAF в исследованных образцах меланомы кожи (рис. 2) количественное распределение мутаций в гене KRAS носило диаметрально противоположный характер: 75% всех зарегистрированных мутационных событий в гене KRAS находились в количественном диапазоне от 0,1 до 2% и 6% от всех зарегистрированных событий - в диапазоне более 2%. Эти данные подтверждают наше предположение о том, что в клетках меланомы кожи с наличием активирующих мутаций в гене BRAF активирующие мутации в гене KRAS возникают не только с меньшей вероятностью, но и в значительно меньших количествах.
Избирательное ингибирование BRAF является стандартным терапевтическим подходом при лечении прогрессирующей меланомы кожи у пациентов с наличием активирующих соматических мутаций в гене BRAF. Тем не менее только приблизительно 50% пациентов с меланомой кожи имеют активирующие мутации в гене BRAF, детектируемые рутинными методами. Увеличение выживаемости без прогрессирования этого заболевания и общей выживаемости после применения ингибиторов BRAF является весьма скромным [10]. Поэтому было предложено несколько механизмов устойчивости к ингибиторам BRAF [11]. Одним из прогнозов устойчивости к ингибиторам BRAF является то, что механизмы усиления димеризации RAF (aRAF, bRAF и cRAF) приводят к возникновению лекарственной устойчивости. К ним относятся изменения, которые повышают активность белков RAS, поскольку канонический механизм димеризации и активации RAF зависит от RAS. Изоформы RAS играют значительную роль в генезе онкологических заболеваний человека, а новые технологии привели к разработке перспективных способов ингибирования передачи сигналов RAS [12-14].
В нашем исследовании мы наглядно продемонстрировали, что в клетках меланомы кожи пациентов Юга России наряду с активирующими мутациями V600 в гене BRAF с частотой от 40 до 80% детектируются активирующие мутации в гене KRAS, которые не могут быть зарегистрированы рутинными методами RT-PCR с чувствительностью 5%. Наличие низкого титра клонов клеток с активирующими мутациями в гене KRAS может служить резервным механизмом быстрого возникновения лекарственной устойчивости клеток меланомы кожи к таргетной терапии. Поэтому использование ингибиторов KRAS в сочетании с ингибированием BRAF может быть эффективным клиническим подходом, в том числе предиктивным, с целью блокирования приобретения лекарственной устойчивости клетками меланомы. Приобретенная устойчивость к ингибиторам BRAF в клетках меланомы кожи зависит от динамической регуляции экспрессии и наличия активирующих мутаций в гене KRAS (а также в других генах семейства RAS). Гены RAS вызывают последующую активацию AKT (серин/треонин-специфичных протеин киназ). Этот негативный эффект имеющейся или приобретенной лекарственной устойчивости может быть преодолен с помощью ингибиторов KRAS и поэтому является дополнительной стратегией при лечении меланомы кожи [15].
Выводы
Результаты нашего исследования наглядно демонстрируют, что от 40 (группа пациентов с BRAF MT) до 80% (группа пациентов с BRAF WT) образцов меланомы кожи пациентов Юга России содержали активирующие соматические мутации в гене KRAS, которые не могли быть детектированы рутинными методами RT-PCR с чувствительностью на уровне 5%. Наличие активирующих мутаций в гене KRAS (генах RAS) канонически способствует димеризационной активации RAF-компонентов сигнального пути. Это является одним из механизмов малигнизации клеток кожи и возникновения у них резервных механизмов приобретения и проявления лекарственной устойчивости. Причиной этого является внутриопухолевая клеточная гетерогенность, проявляющаяся в присутствии минорных опухолевых клеточных клонов, изначально устойчивых к лекарственной терапии, применяемой к основной опухолевой массе. В условиях применения таргетных и/или химиопрепаратов эти клоны могут получать селективное преимущество, обеспечивая лекарственную устойчивость и прогрессию роста опухоли. Следовательно, для повышения подбора эффективных таргетных препаратов и преодоления быстрого приобретения лекарственной устойчивости клетками меланомы кожи необходим множественный скрининг активирующих мутаций в целевых генах на уровне чувствительности детекции не менее чем 0,5%.
Библиографическая ссылка
Гудков Г.В., Водолажский Д.И., Филиппов Е.Ф., Мурашко Р.А., Крутенко Д.В. DDPCR-СКРИНИНГ МУТАЦИОННОГО СТАТУСА ГЕНОВ BRAF И KRAS У ПАЦИЕНТОВ ЮГА РОССИИ // Современные проблемы науки и образования. 2019. № 1. ;URL: https://science-education.ru/ru/article/view?id=28576 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/spno.28576



