Разработка методов иммунотерапии, в частности с помощью вакцин, для лечения злокачественных опухолей является одним из приоритетных направлений в онкологии. На протяжении многих лет различными авторами предлагались разнообразные методы вакцинотерапии опухолей – от применения БЦЖ при опухолях, игравшей роль неспецифического иммуностимулятора, до использования современных клеточных технологий. Развитие представлений о значении вирусов в онкогенезе некоторых злокачественных новообразований привело к разработке и применению противовирусных вакцин. Например, вакцина против вируса папилломы человека применяется с целью профилактики рака шейки матки (РШМ) [1, 2]. Получение и испытание противоопухолевых вакцин на основе дендритных клеток открывают новые возможности иммунотерапии злокачественных опухолей [3-5]. Дендритные клетки (ДК) являются профессиональными антиген-представляющими клетками, участвующими в иммунном ответе благодаря своей способности активировать не только «наивные» CD4+ и CD8+ T-лимфоциты, но и Т-клетки памяти паракортикальных зон периферических лимфоидных органов. У онкологических больных происходит угнетение функциональной активности ДК, как и остальных иммунокомпетентных клеток, вследствие чего нарушается процесс презентации и распознавания антигена [6]. Кроме того, будучи аутологичными, опухолевые антигены низкоиммуногенны. Совокупность причин, связанных, с одной стороны, с характером антигена, а с другой – с состоянием иммунной системы организма больного, приводит к неполноценной иммунной реакции на опухоль, для преодоления которой сконструированы и применяются ДК-вакцины (ДКВ) [7, 8].
Наиболее значимых успехов удалось достичь при ДК-вакцинотерапии иммуногенных опухолей, которыми считаются меланома, почечно-клеточный рак, некоторые лимфомы [9, 10].
В РНИОИ была получена вакцина на основе аутологичных дендритных клеток (ДК), генерированных из мононуклеаров периферической крови больных РШМ, взятых до начала лечения. Метод ее получения описан нами ранее [11], защищен патентом РФ [12].
Целью данной работы является оценка иммунного статуса у больных РШМ при применении ДК-вакцины в их комплексном лечении.
Материалы и методы исследования. В качестве основной группы в исследование включены 17 больных РШМ T2b-4аN0-1M0-1 стадий. Получение ДКВ, нагруженной антигеном культуральной линии рака шейки матки HeLa, и ее введение в сочетании с химиолучевой терапией осуществлялись по ранее описанному способу [10]. Продолжительность вакцинотерапии планировалась индивидуально и зависела от эффекта лечения, который оценивали по данным осмотра, УЗИ, СРКТ, МРТ.
Контрольную группу составили 19 больных РШМ, получавших стандартное лечение: полихимиотерапию (ПХТ) и лучевую терапию по общепринятым методикам. Группу сравнения составляли 12 здоровых женщин.
Для оценки показателей клеточного иммунитета больных кровь до начала и на этапах лечения брали из локтевой вены в пробирку с антикоагулянтом (ЭДТА). Определяли популяционный и субпопуляционный состав лимфоцитов на проточном цитометре FACSCantoII (BD) с панелью моноклональных антител T-, B-, NK (CD45, CD3, CD4, CD8, CD19, CD16/56); дополнительно изучали количественное содержание Т-регуляторных (T regs) клеток (CD4+CD25+CD127dim), а также Т-клеток памяти (Тm) с фенотипом CD3+CD4+CD45RO+CD45RA-, CD3+CD8+CD45RO+CD45RA- и наивных Т-лимфоцитов (Th0) c фенотипом CD3+CD4+CD45RA+CD45RO-CD62L+ и CD3+CD8+CD45RA+CD45RO-CD62L+.
Результаты выражали в процентах от общего количества лимфоцитов, для T regs в процентах от CD3+CD4+ клеток, для Тm и Th0 – в процентах от CD3+CD4+ и CD3+CD8+ клеток. Вычисляли соотношение Тm/Th0 для каждой из этих субпопуляций лимфоцитов.
Статистическую обработку данных выполняли с помощью параметрических (t-критерий Стьюдента) и непараметрических методов (критерий Уилкоксона, метод непрямых разностей).
Результаты исследования и их oбсуждение. Трем больным St T2bN1M0 после проведения 3 курсов ПХТ в сочетании с 6 циклами ДКВ выполнено стандартное хирургическое лечение с последующей лучевой терапией. Срок наблюдения больных без рецидивов и прогрессирования заболевания составил от 6 до 18 месяцев.
Пяти больным St T3b-IVaN1M0-1 после эффективной вакцинохимиотерапии завершили лечение полноценной стандартной химиолучевой терапией с полной регрессией опухоли. Сроки наблюдения без прогрессирования – от 4 до 24 месяцев.
Пяти больным T2bN1M0 вакцинотерапия проводилась на фоне прогрессирования рака шейки матки после завершения стандартного лечения. У всех больных достигнута стабилизация процесса. Купирование болевого синдрома у всех больных отмечено после проведения 2–3 введений ДКВ.
Трем больным T2bN1M0 с первично не излеченными химиолучевой терапией опухолями шейки матки проведение вакцинотерапии на фоне второй линии химиотерапии позволило добиться полной регрессии опухоли. Сроки наблюдения за больными без прогрессирования и рецидива составили от 12 до 26 месяцев.
У двух больных T2bN0M0 с высоким риском рецидивирования после завершения стандартного комплексного лечения вакцинотерапия применялась в качестве адъювантной терапии.
Одной больной с исходно установленной St T4аN1M1 (инвазия в мочевой пузырь, нижнюю треть мочеточников, двухсторонние нефростомы, критический уровень шлаков, анемия III степени, кахексия) вакцинотерапия проводится с паллиативной целью в качестве единственного варианта лечения в течение 13 месяцев.
Результаты иммунологических исследований представлены в таблице 1, в которой приведена динамика исследованных показателей после 4 курсов, 8–19 курсов ДКВ, а также во время достигнутой ремиссии после проведенного лечения. В таблице 1 также представлены показатели больных контрольной группы, получавшей ПХТ без иммунотерапии.
Таблица 1
Динамика показателей иммунного статуса у больных РШМ, получавших лечение, включающее ДКВ (Т-, В-, NK-клетки), по сравнению с контрольной группой
|
Группы больных |
Сроки исследования |
Показатели, % |
|||||
|
CD3+ |
CD3+ CD4+ |
CD3+ CD8+ |
CD16/56+ |
CD19+ |
T regs |
||
|
Основная |
До начала лечения |
74,9±2,7 |
48,7±4,2 |
21,9±1,8 |
12,0±2,0 |
13,0±3,4 |
6,7±0,5 |
|
1 курс ДКВ |
70,4±3,1 |
51,0±5,1 |
19,0±2,0 |
17,1±4,2 |
12,5±2,9 |
8,8±0,3 * ? |
|
|
4 курса ДКВ |
72,1±4,2 |
44,4±3,1? |
23,6±3,2 |
14,5±1,9 |
13,6±2,4 |
7,2±1,3 |
|
|
8–19 курсов ДКВ |
65,0±2,1* *** |
32,9±2,3* *** ? |
28,8±1,5 * ? |
21,2±3,0* *** |
12,5±1,9 |
6,1±0,8 ** *** |
|
|
Ремиссия |
62,8±2,2* *** ? |
37,7±2,3* *** ? |
20,9±3,7 |
21,2±1,9* *** ? |
14,9±3,3 |
6,9±0,7 ** |
|
|
Контрольная |
До лечения |
75,7±3,3 |
43,7±1,9 |
28,2±2,7 |
15,5±3,2 |
7,1±0,6 |
7,1±0,6 |
|
После ПХТ |
77,2±2,0 |
47,1±2,3 |
26,0±2,3 |
12,9±1,6 |
8,8±0,6 |
8,9±0,9? |
|
|
Здоровые |
75,6±5,2 |
55,2±2,9 |
22,0±2,5 |
14,6±2,6 |
10,2±2,2 |
6,0±0,7 |
|
Примечание. * – статистически достоверные отличия от показателя до лечения; ** – статистически достоверные отличия от показателя после 1-го курса ДКВ; *** – статистически достоверные отличия от показателей контрольной группы после лечения; ? – статистически достоверные отличия от показателей здоровых женщин (p<0,05)
Как видно из таблицы 1, проведение 1 курса ДКВ у больных основной группы приводит к транзиторному статистически достоверному повышению уровня T regs; остальные показатели состава основных популяций и субпопуляций лимфоцитов остаются без изменений по сравнению с исходными параметрами. Дальнейшее проведение лечения, включающего 4 курса ДКВ, также не вызывает изменений исследованных параметров, хотя в эти сроки уровень T regs возвращается к исходному. Только после 8 и более курсов развивается выраженная и, на наш взгляд, в целом благоприятная динамика. Так, отмечено статистически значимое повышение уровней лимфоцитов, потенциально обладающих цитотоксичностью, а именно CD3+CD8+ и NK-клеток, причем количество последних возрастает почти в 2 раза. На этом фоне наблюдается снижение процентного содержания CD3+ и CD3+CD4+ клеток, по-видимому, происходящее за счет T regs, имеющих сходный с Т-хелперами иммунофенотип. Статистически значимое снижение уровня T regs регистрируется по сравнению с отмеченным после 1-го курса лечения. Подобные изменения, касающиеся CD3+, CD3+CD4+, T regs и NK-клеток, продолжают сохраняться у больных, находящихся в ремиссии после проведенного лечения с включением ДКВ. В эти же сроки (8 и более курсов ДКВ и в период ремиссии) отмечены аналогичные статистически значимые отличия исследованных показателей от данных больных контрольной группы, получавшей ПХТ, в которой изменений исследованных показателей иммунного статуса после лечения не наблюдается. При сравнении с показателями иммунного статуса группы здоровых женщин после окончания лечения в контрольной группе отмечено статистически достоверно более высокое содержание T regs, тогда как у больных после 8–19 курсов ДКВ – перераспределение основных субпопуляций лимфоцитов в сторону CD3+CD8+, а у находящихся в ремиссии – в сторону натуральных киллеров.
В таблице 2 представлена динамика уровней «наивных» Т-лимфоцитов и Т-клеток памяти у больных, получавших лечение, включающее ДКВ.
Таблица 2
Динамика показателей иммунного статуса у больных РШМ, получавших лечение, включающее ДКВ (Т-лимфоциты «памяти» и «наивные» Т-лимфоциты)
|
Сроки исследования |
Показатели, % |
|||
|
CD3+CD45RO+CD45RA- (Тm) |
CD3+CD45RA+CD45RO-CD62L+ (Th0) |
|||
|
CD4+ |
CD8+ |
CD4+ |
CD8+ |
|
|
До начала лечения |
51,7±6,3 |
28,5±2,1 |
16,8±4,2 |
17,0±3,6** |
|
1 курс ДКВ |
57,1±5,8 |
29,0±4,7 |
15,6±3,6 |
17,1±3,4** |
|
4 курса ДКВ |
58,0±7,8 |
29,1±6,0 |
15,2±4,1 |
13,7±2,3** |
|
8–19 курсов ДКВ |
69,7±4,3* ** |
34,6±7,4 |
15,0±3,4 |
11,8±4,8** |
|
Ремиссия |
53,2±6,2 |
40,4±5,3* |
24,1±6,8 |
19,4±5,3 |
|
Здоровые |
55,0±3,7 |
35,0±4,3 |
23,4±3,2 |
27,7±3,7 |
Примечание. * – статистически достоверные отличия от показателя до лечения; ** – статистически достоверные отличия от показателя здоровых женщин (p<0,05)
Как видно из представленных в ней данных, проведение 1 и 4 курсов ДКВ не приводит к изменению этих показателей по сравнению с исходными. После 8 и более курсов ДКВ развивается статистически достоверное повышение по сравнению с исходным уровнем хелперно-индукторных Т-клеток с фенотипом Тm, а при достижении ремиссии – цитотоксических Тm-клеток. В ремиссии, кроме того, отмечена тенденция к повышению уровней «наивных» Т-лимфоцитов обеих основных субпопуляций, хотя статистически значимых отличий от показателей до лечения и в динамике лечения, включающего вакцинотерапию, не выявлено. Интересным оказалось сравнение полученных данных больных с показателями здоровых женщин: у больных РШМ после проведения 8–19 курсов ДКВ отмечен статистически значимо более высокий уровень Тm в субпопуляции CD4+ лимфоцитов, а содержание Th0 в субпопуляции CD8+ на протяжении всего срока лечения было ниже, хотя статистически достоверных различий по уровням Тm CD8+ не получено. Более наглядную картину дает анализ соотношения Тm/Th0 лимфоцитов в динамике лечения (рисунок).
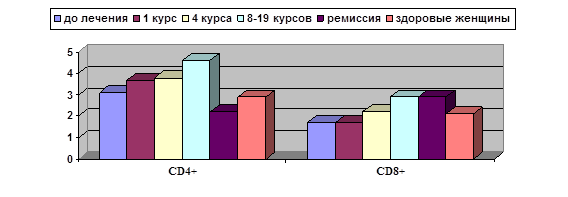
Динамика соотношения Tm/Th0 лимфоцитов субпопуляций CD4+ и CD8+
в динамике лечения с применением ДКВ. Ось Y – Tm/Th0
Как видно из данных, представленных на рисунке, по мере применения курсов ДКВ увеличивается соотношение Tm/Th0 лимфоцитов в обеих основных субпопуляциях, что говорит о развитии иммунологической памяти и, видимо, является одним из механизмов, обеспечивающих наблюдаемый клинический эффект. Следует отметить, что в ремиссии достигнутое соотношение сохраняется только для CD8+ (цитотоксических) лимфоцитов, которым отводится ведущая роль в противоопухолевой защите.
Заключение. Итак, наиболее выраженные изменения по сравнению с первоначальными показателями клеточного иммунитета отмечены у больных, получавших длительную вакцинотерапию ДКВ (от 8 до 19 курсов). Они связаны с выраженным повышением уровней NК- и СD3+СD8+ лимфоцитов, ответственных за врожденную и адаптивную цитотоксичность соответственно, а снижение общего уровня СD3+СD4+ лимфоцитов сопровождается повышением доли клеток «памяти» внутри этой субпопуляции. Описанную динамику, а также снижение уровня T regs вполне можно расценить как благоприятную, по всей вероятности, вносящую вклад в развитие ремиссии, при которой часть этих изменений сохраняется. Как известно, Т-лимфоциты, обеспечивающие иммунологическую память, играют важную роль при различных хронических заболеваниях и, в частности, участвуют в противоопухолевой защите. Данная субпопуляция гетерогенна, содержит эффекторные (Тem) и центральные (Тсm) клетки памяти; Тem выполняют «сторожевую» функцию, населяя периферические ткани (печень, легкие), а также область воспалительного или опухолевого очага, а Тсm обеспечивают защиту на системном уровне и быстрый ответ на последующие введения антигена [13]. Обе эти разновидности имеют также принадлежность к субпопуляциям СD3+СD4+ и СD3+СD8+, причем особое значение придается СD8+ клеткам «памяти»; частота встречаемости лимфоцитов, проявляющих специфическую цитотоксичность против опухолевых антигенов, намного выше среди СD8+ клеток памяти, чем среди наивных [14]. Уровень СD8+ клеток Тm в опухоли при ряде солидных новообразований рассматривается как ключевой фактор общей выживаемости больных [15]. Поэтому повышение их уровня при развитии ремиссии у больных, получавших ДКВ, характеризуется нами как позитивный фактор.
Оценка динамики состояния больных, несмотря на неоднородность группы, позволила заключить, что многократная вакцинация с помощью ДКВ удовлетворительно переносится больными РШМ и при применении в комплексном лечении вызывает клинический эффект. Наблюдения над больными, находящимися в ремиссии, продолжаются.
Библиографическая ссылка
Меньшенина А.П., Златник Е.Ю., Моисеенко Т.И., Франциянц Е.М., Новикова И.А., Вереникина Е.В., Сагакянц А.Б., Бондаренко Е.С., Шульгина О.Г. ИММУННЫЙ СТАТУС БОЛЬНЫХ РАКОМ ШЕЙКИ МАТКИ ПРИ ЛЕЧЕНИИ С ПРИМЕНЕНИЕМ ДЕНДРИТНО-КЛЕТОЧНОЙ ВАКЦИНАЦИИ // Современные проблемы науки и образования. 2018. № 6. ;URL: https://science-education.ru/ru/article/view?id=28349 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.28349



