Рак предстательной железы (РПЖ) занимает одно из ведущих мест в структуре заболеваемости мужского населения злокачественными новообразованиями, лидируя по среднегодовому темпу прироста, особенно в возрастной группе до 60 лет (15,6%). За последние десятилетия достигнуты успехи в совершенствовании технологий его диагностики и лечения, повысилась частота выявления локализованных форм заболевания – до 44,8% среди вновь выявленных больных [1]. В дополнение к радикальной простатэктомии, сопряженной со значительным количеством осложнений, предложены альтернативные малоинвазивные методы лечения, одним из которых является абляция предстательной железы высокоинтенсивным фокусированным ультразвуком (HIFU) [2, 3].
Ключевой проблемой на пути более широкого применения HIFU-терапии в первичном лечении РПЖ является необходимость разработки критериев отбора и более четкой стратификации пациентов по риску прогрессирования заболевания, прежде всего в группе опухолей низкого и промежуточного риска [4]. Наиболее ценную информацию для этого дает патоморфологическое исследование – степень дифференцировки опухоли по шкале Глисона, а также косвенная оценка ее объема по данным мультифокальной биопсии относятся к факторам прогноза I и II категории согласно рекомендациям Коллегии американских патологов [5].
Помимо рутинного гистологического исследования, для характеристики злокачественного потенциала новообразования все чаще используются молекулярно-биологические маркеры, которые отражают аберрантную активность регуляторных путей, ассоциированных с высоким пролиферативным и метастатическим потенциалом [4, 5]. Для включения таких маркеров в перечень рекомендуемых для применения необходима оценка их прогностического значения при различных видах лечения.
Мутация гена опухолевого супрессора р53 (TP53), приводящая к потере его регуляторных и проапоптотических функций, относится к наиболее распространенным молекулярно-генетическим дефектам при опухолях различных локализаций [6]. По некоторым данным, мутация TP53 свидетельствует об агрессивном подтипе РПЖ и может являться независимым прогностическим фактором специфической выживаемости после консервативного лечения и радикальной простатэктомии [7, 8]. Мутантный белок p53 характеризуется увеличенным временем полужизни и накоплением в ядрах клеток, что делает возможным его выявление иммуногистохимическим методом [6]. При этом имеющиеся в литературе данные о значении данного маркера в условиях ультразвуковой абляции предстательной железы (ПЖ) единичны и носят противоречивый характер [9].
Цель исследования – изучить патоморфологические особенности первичной опухоли и экспрессию белка p53 при локализованном РПЖ для уточнения критериев прогноза локального рецидива в условиях воздействия высокоинтенсивным сфокусированным ультразвуком в сочетании с андрогенной депривацией.
Материал и методы исследования
Обследованы 119 пациентов с РПЖ, которым за период 2011–2017 гг. проведено лечение HIFU на аппарате Ablatherm (EDAP TMS S.A., Франция) с предшествующей трансуретральной резекцией ПЖ (ТУРП) на базе урологического отделения ОКБ ст. Барнаул ОАО «РЖД». Показанием для проведения HIFU был морфологически верифицированный локализованный РПЖ (стадия Т2а-сN0M0) у пациентов, имеющих соматические противопоказания для радикальной простатэктомии или отказавшихся от ее выполнения. Период мониторинга результатов лечения составил от 3 месяцев до 3 лет. Контрольные мультифокальные биопсии носили плановый характер (12±3 месяца) либо выполнялись при подозрении на биохимический рецидив. Показаниями к проведению ТУРП в период мониторинга были снижение объема ПЖ перед повторным сеансом HIFU, а также стриктуры простатического отдела уретры.
По результатам патоморфологического анализа контрольного материала все пациенты были разделены на две группы: 1-я группа – 91 пациент (средний возраст 65,8±8,5 лет), у которых за период мониторинга не выявлено признаков местного прогрессирования; 2-я группа – 28 пациентов (средний возраст 67,6±7,9 лет) с местным рецидивом (резидуальным ростом) РПЖ. В 21 случае (75%) рецидив диагностирован в относительно ранние сроки – через 6–18 месяцев после сеанса HIFU.
В 27 (30%) наблюдениях 1-й и 11 (39%) случаях 2-й группы ультразвуковая абляция ПЖ проведена в сочетании с гормональной терапией (ГТ). Использовали флутамид (250 мг х 3 раза в день) в течение 1–3 месяцев перед HIFU и гозерелин (Золадекс) в дозировке 3,6 мг каждые 28 дней или 10,8 мг каждые 3 месяца на протяжении 3–6 месяцев.
Патоморфологическое исследование проведено на материале 162 образцов первичных биопсий, а также ТУРП 31 пациентов (16 пациентов 1-й и 15 пациентов 2-й группы), отобранных случайным методом из общего массива наблюдений. Распределение пациентов по возрасту, клинико-лабораторным показателям и режимам ГТ в исследуемых группах и соответствующих подгруппах общего массива наблюдений достоверно не отличалось.
Для светооптического исследования биоптаты и образцы, полученные при ТУРП, фиксировали в 10%-ном растворе нейтрального формалина, обрабатывали по общепринятой методике и заключали в парафин. Срезы толщиной 5 мкм окрашивали гематоксилином и эозином в комбинации с реакцией Перлса, по ван Гизону с докраской эластических волокон резорцин-фуксином Вейгерта, ставили ШИК-реакцию. Парафиновые срезы анализировали в универсальном исследовательском микроскопе Leica DM 4000B, для получения микрофотографий использовали цифровую камеру Leica DFC320 и компьютерную программу Leica QWin V3.
При косвенной оценке объема опухоли в каждом наблюдении по данным анализа диагностически значимых биоптатов определяли относительную долю положительных (содержащих опухоль) столбиков, а также измеряли суммарную объемную плотность опухолевых структур (%) во всех биопсийных столбиках. Морфометрический анализ проводили при помощи компьютерной программы Leica QWin V3. При анализе ассоциации данных показателей с рецидивом заболевания проведены их дихотомизация и подбор пороговых уровней (точек отсечения), обеспечивавших наибольшую силу и достоверность полученной связи (≥ 40% для относительной доли позитивных столбиков и ≥ 10% для показателя объемной плотности).
Для оценки взаимосвязи между степенью дифференцировки (суммой баллов по шкале Глисона) и вероятностью местного прогрессирования после сеанса HIFU-терапии все наблюдения были разделены на три группы риска на основании современных данных по прогнозу 5-летней выживаемости при использовании традиционных методов лечения РПЖ [10]: 1) ≤ 3+4 балла (20 случаев); 2) 4+3 балла (7 случаев); 3) 8–9 баллов (4 случая), был также выбран порог отсечения (≤ 3+4 / ≥ 4+3).
Для оценки злокачественного потенциала опухоли проведено иммуногистохимическое исследование с использованием моноклональных антител к белку-онкосупрессору p53 (клон DO7, Monosan). Интенсивность экспрессии p53 оценивали визуально полуколичественным способом (0, 1+, 2+, 3+), затем подсчитывали долю меченых клеток (учитывали только ядерную экспрессию). Окончательный результат определяли по следующим критериям: отрицательная реакция – отсутствие окрашивания или экспрессия p53 менее чем в 10% опухолевых клеток; слабоположительная реакция – 1+-экспрессия в ≥10% или 2+-экспрессия в 10–50%; выраженная реакция – 2+-экспрессия в >50% или 3+-экспрессия в ≥10% клеток [8].
Учет интенсивности окрашивания обусловлен тем, что, по некоторым данным, высокая степень экспрессии в значительной степени коррелирует с наличием мутации, в то время как слабая реакция может быть связана с физиологическим накоплением белка в условиях клеточного стресса или нарушения регуляторных взаимодействий [11]. Порог отсечения 10% часто использовался для определения положительной экспрессии при исследовании РПЖ [8, 12, 13]; меньшая доля позитивных ядер (<10%) сильнее коррелировала с наличием дикого типа гена при анализе карциномы яичников [11].
Статистический анализ результатов проводили с помощью программы STATISTICA версии 12.0 компании StatSoft, Inc (США). Для относительных величин значения представлены в виде процентного соотношения, для непрерывных – в виде медианы (Me) и межквартильного интервала (IR) (25–75-й процентили). С целью сравнения двух независимых групп по количественному признаку использовали U-критерий Манна–Уитни. При анализе таблиц сопряженности применяли точный критерий Фишера и критерий χ?2 Пирсона, рассчитывали отношение шансов (OR) и границы 95%-ного доверительного интервала (95% CI). Коррелятивные взаимоотношения оценивали с помощью критерия Спирмена. Различия в сравниваемых группах считались достоверными при уровне статистической значимости p<0,05.
Результаты исследования и их обсуждение
По данным большинства исследований объем опухоли в материале мультифокальной биопсии ПЖ имеет прогностическое значение в оценке вероятности биохимического рецидива, метастазирования и летального исхода при различных методах лечения РПЖ [4]. Простым и наиболее часто используемым методом его косвенной оценки является подсчет относительной доли позитивных биопсийных столбиков. Медианное значение данного показателя у пациентов с рецидивом (66,7%; IR 41,6–90,0%) достоверно превышало соответствующее значение 1-й группы (25,0%; IR 16,7–35,4%; p<0,001).
При анализе распределения пациентов обнаружено, что у большинства (81%) пациентов 1-й группы доля положительных образцов в дооперационном материале не превышала 40% (≤ 4 столбиков при 12-точечной биопсии), в то время как наличие рецидива в 80% случаев было ассоциировано с более высокими значениями данного показателя (OR=17,3; 95% CI 2,9–103,0; p=0,002) (табл. 1).
Таблица 1
|
Распределение пациентов 1-й и 2-й групп по показателям объема опухоли |
|||||
|
Показатели |
1-я группа, |
2-я группа, |
OR |
p |
|
|
Доля позитивных |
< 40 |
13 (81,3) |
3 (20,0) |
17,3 |
0,002 |
|
≥ 40 |
3 (18,7) |
12 (80,0) |
|||
|
Относительная площадь опухолевых структур, % |
< 10 |
12 (75,0) |
2 (13,3) |
19,5 |
0,002 |
|
10 – 29 |
3 (18,8) |
8 (53,3) |
|||
|
≥ 30 |
1 (6,2) |
5 (33,3) |
|||
|
Индекс Глисона |
≤ 3+4 |
14 (87,5) |
6 (40,0) |
10,5 |
0,011 |
|
4+3 |
2 (12,5) |
5 (33,3) |
|||
|
8-9 |
0 (0) |
4 (26,7) |
|||
|
Примечание: пунктиром обозначен порог отсечения, использованный при дихотомизации признака; OR – отношение шансов, CI – доверительный интервал. |
|||||
Определение суммарной объемной плотности опухолевых структур во всех биопсийных столбиках – более сложный, хотя и более строгий с морфометрической точки зрения способ оценки объема опухолевого поражения. У пациентов с рецидивом медианное значение данного показателя (20,4%; IR 14,2–30,8%) значительно превосходило соответствующее значение 1-й группы (3,5%; IR 2,3–12,2%; p=0,001), при этом в 75% наблюдений без рецидива показатели объемной плотности были ниже порога отсечения (10%). Местное прогрессирование в большинстве случаев (87%) было ассоциировано с более высокими значениями этого параметра (OR=19,5; 95% CI 3,0–126,5; p=0,002), причем в 1/3 наблюдений 2-й группы объем опухоли превышал 30% (табл.).
Установлена положительная корреляционная зависимость между косвенными показателями объема опухоли (относительной долей положительных столбиков и объемной плотностью опухолевых структур в первичных биоптатах) и наличием местного рецидива после сеанса HIFU-терапии (r=0,63 и 0,59 соответственно; p<0,001).
При оценке степени дифференцировки РПЖ на дооперационном этапе в группе без рецидива значительно преобладали наблюдения невысокого риска с суммой Глисона ≤ 3+4 (87,5% случаев), градация 7 (4+3) зарегистрирована только в 2 (12,5%) наблюдениях. Во 2-й группе отмечался существенный сдвиг в сторону менее дифференцированных форм – градации 7 (4+3), 8 и 9 в сумме диагностированы в 60% случаев, а их выявление было достоверно ассоциировано с прогрессированием РПЖ после HIFU-терапии (OR = 10,5; 95% CI 1,7–63,9; p=0,011) (табл.). Зарегистрирована положительная корреляция между группой риска по шкале Глисона и выявлением местного рецидива (r=0,52, p=0,003).
Опухолевые структуры 4-й градации представляют собой разнородную группу паттернов, некоторые из них могут иметь особое прогностическое значение. На сегодняшний день имеются данные, подтверждающие достоверную связь крибриформного паттерна с биохимическим рецидивом и отдаленными метастазами после лучевой терапии и радикальной простатэктомией [14]. В нашем исследовании криброзные комплексы (рис. 1, а), отмеченные в 21% предоперационных образцов 2-й группы в качестве ведущего компонента и еще в 5% – в качестве вторичного, в материале 1-й группы полностью отсутствовали, различия носили достоверный характер (p=0,012).
В единичных случаях в первичных биоптатах пациентов с рецидивом встречались другие гистологические маркеры неблагоприятного прогноза, такие как периневральная инвазия и внутрипротоковая карцинома простаты (7 и 5% образцов 2-й группы соответственно). Последняя имела крибриформную структуру с очагами солидаризации, местами сохраняла контур ветвящихся протоков (рис. 1, б).
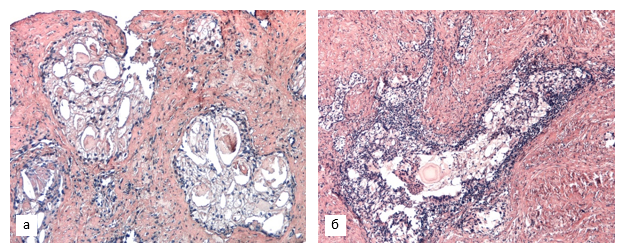
Рис. 1. Криброзные структуры в биоптате (а) и материале ТУРП (б) пациентов 2-й группы:
а – светлоклеточная аденокарцинома криброзного строения; б – крибриформные структуры в просвете ветвящегося протока (внутрипротоковая карцинома простаты).
Окраска гематоксилином и эозином. Ув. х200
Анализ биоптатов и материала ТУРП пациентов с РПЖ показал, что основными фоновыми изменениями неопухолевой паренхимы ПЖ были доброкачественная гиперплазия (ДГПЖ) различной степени выраженности, признаки которой наблюдались в 75% доступных образцов ТУРП, а также очаговые атрофические и атрофически-пролиферативные изменения, преобладавшие в периферической зоне простаты и во многих случаях ассоциированные с признаками хронического воспаления. Солокализацию участков простой атрофии и постатрофической гиперплазии с зонами умеренной и выраженной воспалительно-клеточной инфильтрации (наблюдавшуюся в 35% наших наблюдений) в настоящее время принято обозначать термином «пролиферативная воспалительная атрофия». Топографические и молекулярно-генетические параллели с простатической интраэпителиальной неоплазией высокой степени (ПИН) и РПЖ позволяют некоторым авторам рассматривать данные изменения в качестве предопухолевых [15].
При иммуногистохимической оценке экспрессии белка p53 отмечено практически полное отсутствие специфического окрашивания в неопухолевых железах нормального строения и узлах ДГПЖ, в некоторых случаях наблюдалась слабоположительная реакция в единичных рассеянных клетках базального слоя (рис. 2, а). Очаговые скопления слабопозитивных ядер преимущественно базальной локализации (1+-экспрессия в 10 – 30% ядер) нередко встречались в участках пролиферативной воспалительной атрофии (рис. 2, б), а также в очагах ПИН вблизи опухоли. В отдельно расположенных очагах ПИН реакция была менее выражена, но также превосходила базальный уровень (рис. 2, в).
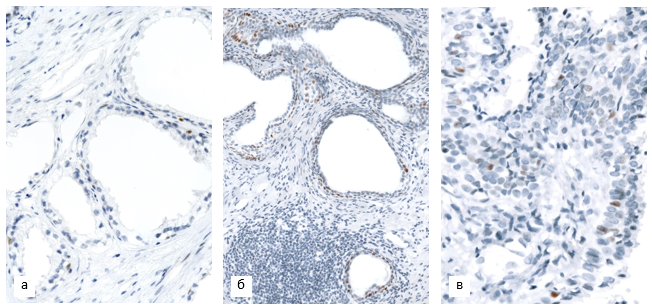
Рис. 2. Экспрессия p53 в неопухолевой паренхиме ПЖ в материале ТУРП пациентов 1-й группы: а – единичные p53-позитивные базальные клетки в зоне доброкачественной гиперплазии ПЖ. Ув. х400; б – слабоположительная реакция в клетках базального слоя в зоне пролиферативной воспалительной атрофии (1+, 28% клеток). Ув. х200; в – слабая экспрессия p53 в очаге ПИН (1+, 6% клеток). Ув. х400
Экспрессия р53 в структурах РПЖ отличалась гетерогенностью. В 18 (58%) наблюдениях экспрессия отсутствовала или наблюдалась в единичных ядрах опухолевых клеток (менее 1%). В 7 наблюдениях (23% всех случаев) отмечено слабое по интенсивности окрашивание немногочисленных (до 10%) ядер, что рассматривалось как негативная реакция (рис. 3, а). Достоверных различий по данному признаку между группами не выявлено.
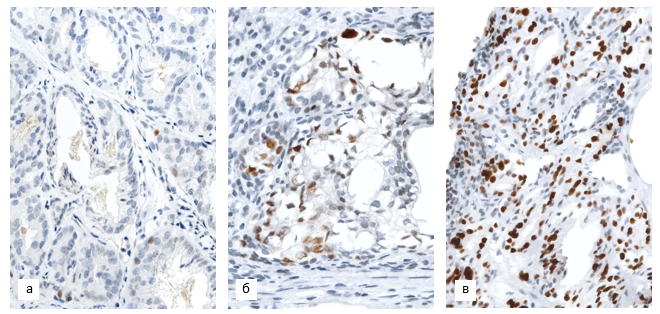
Рис. 3. Экспрессия p53 в структурах РПЖ в биоптатах пациентов 1-й (а) и 2-й групп (б, в):
а – единичные позитивные опухолевые клетки в очаге умеренно дифференцированной аденокарциномы; б – слабоположительная реакция в очаге аденокарциномы криброзного строения (2+, 31% клеток); г – выраженная реакция в очаге умеренно дифференцированной аденокарциномы (3+, 73% клеток). Ув. х400
В 6 наблюдениях (19% всех случаев) в дооперационных образцах зафиксирована повышенная экспрессия p53 – умеренное или выраженное по интенсивности окрашивание 22–73% ядер опухолевых клеток (рис. 3, б, в). У всех пациентов с аномальной реакцией через 10–21 месяц после сеанса HIFU-терапии диагностирован рецидив РПЖ (40% наблюдений 2-й группы). Достоверная ассоциация между гиперэкспрессией p53 и местным прогрессированием (OR=22,6; 95% CI 1,1–446,8; p=0,040) подтверждалась данными корреляционного анализа (r=0,53, p<0,001).
Во многих первичных биоптатах с повышенной экспрессией p53 имели место и другие гистологические признаки, которые указывали на низкую степень дифференцировки опухоли и неблагоприятный прогноз (рис. 3, б). Установлена статистически значимая, хотя и довольно слабая корреляция между экспрессией p53 и группой риска по шкале Глисона (r=0,40, p=0,024). Тем не менее тот факт, что в отдельных наблюдениях с рецидивом гиперэкспрессия наблюдалась в клетках умеренно дифференцированной аденокарциномы (рис. 3, г), указывает на то, что в ряде случаев данный маркер может иметь существенное независимое значение для прогноза и выбора тактики лечения.
Экспрессия p53-протеина в очагах прекурсорных изменений (пролиферативной воспалительной атрофии, ПИН высокой степени) указывает на то, что потеря функции данного гена может играть ключевую роль уже на ранних этапах канцерогенеза [15]. И, хотя слабоположительная реакция не обязательно означает наличие мутации [11], в ряде работ на основе сочетания методов лазерной микродиссекции, секвенирования и гибридизации in situ удалось показать повышенный уровень мутаций TP53 и хромосомной нестабильности в очагах ПИН высокой степени у пациентов с РПЖ [12].
Заключение
Существенными факторами, определяющими вероятность сохранения опухолевых клеток после воздействия высокоинтенсивного сфокусированного ультразвука на ткань ПЖ, являются особенности самой опухоли, в первую очередь ее объем и злокачественный потенциал.
По нашим данным, повышение частоты местного прогрессирования при лечении локализованного РПЖ методом HIFU-терапии ассоциировано с преобладанием менее дифференцированных форм аденокарциномы (4+3, 8 и 9 баллов по Глисону), наличием криброзных структур в первичных биоптатах, а также с характеристиками опухоли, указывающими на ее значительный объем, – относительной долей позитивных биопсийных столбиков ≥ 40% (более 4 столбиков при 12-точечной биопсии) и относительной площадью опухолевых структур во всех образцах ≥ 10%. Тот факт, что даже небольшое содержание криброзных элементов может быть ассоциировано с последующим развитием местного рецидива, свидетельствует о целесообразности специального учета криброзного подтипа для выделения пациентов с повышенным риском местного прогрессирования после HIFU-терапии.
Продемонстрированная нами достоверная взаимосвязь между аномальной экспрессией p53-протеина и местным рецидивом подтверждает значимость иммуногистохимической оценки данного маркера как фактора неблагоприятного прогноза при HIFU-терапии локализованного РПЖ.
Библиографическая ссылка
Бакарев М.А., Левин В.П., Неймарк А.И., Лушникова Е.Л. ПАТОМОРФОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ПЕРВИЧНОЙ ОПУХОЛИ И ЭКСПРЕССИЯ БЕЛКА P53 КАК ФАКТОРЫ ПРОГНОЗА МЕСТНОГО РЕЦИДИВА АДЕНОКАРЦИНОМЫ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ В УСЛОВИЯХ HIFU-ТЕРАПИИ // Современные проблемы науки и образования. 2018. № 6. ;URL: https://science-education.ru/ru/article/view?id=28265 (дата обращения: 07.01.2026).
DOI: https://doi.org/10.17513/spno.28265



