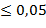Белки, как основные биомакромолекулы, являются главными участниками всех клеточных процессов. Поэтому построение схемы процессов жизнедеятельности невозможно без всего объема данных динамической протеомики, которая изучает, кроме всего прочего, некритичные изменения структуры белков и их взаимодействия друг с другом [5; 12]. Проблемы динамики структурных изменений молекул белков под действием температуры имеют большое значение как для фундаментальной, так и для прикладной науки. Изучение механизмов денатурации белковых молекул представляет интерес и с точки зрения выяснения механизмов формирования третичной структуры белка. Такие исследования устанавливают связь между структурой белка и его стабильностью и определяют, какие факторы необходимы для поддержания нативной конформации молекулы белка [9; 13].
С другой стороны, наблюдаемые в некоторых случаях [1] изменения термоустойчивости функционально значимых белков, и в частности ферментов, могут служить маркерами отклонений в жизненно важных процессах, вызванных как внешними, так и внутренними факторами.
Известно, что на репродуктивную систему самцов белых крыс, и в частности на концентрацию сперматозоидов и продукцию половых гормонов, негативно влияют разнообразные химические факторы (соли тяжелых металлов, серосодержащий природный газ), а также к подобным изменениям приводит периодическое лишение животных пищи или воды, длительные физические нагрузки, гипотермия и миллиметровое излучение низкой интенсивности [3; 4]. Это говорит о значительном напряжении функции семенников, что впоследствии приводит к необратимому нарушению их функционального состояния [4]. Все эти, на первый взгляд, совершенно разрозненные виды воздействий объединяет механизм ответа организма в виде оксидативного стресса [4]. Ранее [6] мы сообщили об увеличении термостабильности эстераз репродуктивной системы самцов крыс под воздействием некоторых стрессогенных факторов. Причем наиболее выраженные изменения термоустойчивости проявляют эстеразы в группе животных, подверженных воздействию микроволнового излучения низкой интенсивности (МИНИ) [6]. Исходная активность эстеразы при 40 °С близка к контрольным значениям. Микроволновое излучение не влияет на активность эстераз репродуктивных органов самцов белых крыс, но при исследовании устойчивости к температурному воздействию обнаружено, что МИНИ максимально повышает устойчивость эстераз к температуре. Применение МИНИ приводит к тому, что более 15% эстеразной активности экстрактов эпидидимисов и семенников самцов крыс сохраняется до 80 °С. Кроме того, МИНИ вызывает структурирование гидратных оболочек молекул, сокращая длину и несколько изменяя угол водородной связи между молекулами воды [2; 13]. Очевидно, что повышение температурной устойчивости этих ферментов связано с конформационными переходами в третичной структуре белка [10]. Этот фактор может служить основой патологических изменений в репродуктивной системе, приводящих к бесплодию или снижению фертильности [3].
Целью нашей работы стало сравнительное выделение, очистка и исследование физико-химических параметров эстеразы репродуктивной системы самцов крыс в норме и при воздействии микроволнового излучения.
Материалы и методы исследования. В работе использовано 246 самцов белых крыс линии Wistar средней массой 225 ± 15,0 г, содержавшихся в обычных условиях вивария. Эксперименты на животных осуществлялись в соответствии с требованиями Женевской конвенции (1985). Все животные были разделены на контрольную и опытную группы.
В опытной группе проводили исследование воздействия низкоинтенсивного микроволнового излучения (МИНИ). Животные были подвергнуты воздействию микроволнового излучения с частотой 42 ГГц (λ = 7,1 мм) в течение 30 дней по 60 минут ежедневно с помощью генератора монохроматических волн «Явь-1-7,1» (Россия).
Объектом нашего исследования был белковый экстракт эпидидимисов и семенников интактных белых крыс и крыс, подвергавшихся воздействию МИНИ.
Экстракты готовили на трис-солянокислом буфере рН = 7.8 в соотношении вес/объем 1/4, после предварительного измельчения тканей, многократного замораживания оттаивания и центрифугирования при 10000 g в течение 30 мин, образцы хранили при -24 °С до исследования.
Общая эстеразная активность измерялась по гидролизу 1,0 мМ раствора альфа-нафтилацетата на 0,05М трис-солянокислом буфере рН=7,8 за 30 мин при 37 °С. Хромогеном служил раствор прочного синего RR. Оптическая плотность измерялась при 500 нм. Единицей активности считали количество фермента, способное отщепить 1.0 мкмоль альфа-нафтола в минуту при 37 °С. Отношение эстераз к ингибиторам исследовали преинкубацией препарата фермента с 10-5 М эзерином, 10-5 М фосфаколом, 10-4 М пара-хлормекурибензоатом (ПХМБ) и 0,1 М фторидом натрия [7].
Динамическое исследование термолабильности проводили прогреванием аликвот (0,4 мл) исследуемого экстракта в термостатируемых ячейках микротермостата М-208 от 40 до 80 °С в течение 20 мин при каждой температуре.
Электрофорез в полиакриламидном геле проводили с использованием вертикальной камеры (модель 05-01-00, BioTech, Чехия) в 8%-ном акриламидном геле на трис-глициновом буфере рН 8,3 [11]. 50 микролитров каждого образца загружали в каждую лунку и электрофоретическое разделение проводили при постоянном напряжении 150 мВ 1,5 часа при комнатной температуре. Широкий ассортимент (3000-108000 дальтон) молекулярных маркеров (Geni, Бангалор) был использован для оценки молекулярной массы. Для выявления эстеразной активности гели окрашивали в 0,2 М натрий фосфатном буфере (pH=6,5), содержащего 1% альфа-нафтилацетата и 0,13% прочного синего RR (4-бензоиламино-2,5-диметоксибензолдиазоний хлорид).
Изофокусирование [11] проводили на пластинах полиакриламидного геля (LKB,) pН 3.5-9.5, и 7,0-9,0 согласно руководству изготовителя с использованием стандартного оборудования для фокусировки LKB. Фиксация: 30 мин (3%-ный раствор сульфосалициловой кислоты в 33%-ном метаноле). Окрашивание: кумасси синий в течение 30 мин при 60 °С. Препаративное изофокусирование проводили, смешивая тщательно обессоленный раствор белков c амфолинами (LKB) и сахарозой и заполняли колонку объемом 95 мл. Фокусирование продолжалось 58-60 часов при напряжении 800 в. Затем колонка освобождалась через коллектор фракций BIO-RAD-2110 со скоростью 9,0 мл/мин и дискретностью 2,5 мл. В каждой фракции определяли активность эстераз.
Гель-хроматография [11] проводилась с аналитическими и препаративными целями. Для аналитических целей использовали высокоэффективную жидкостную хроматографию при комнатной температуре в колонках TSK Gel G3000 SW (30 х 0,75 см). Cloyo Soda (Tokyo 107, Japan), Трис-буфер (рН 6,8), скорость потока была постоянной, 0,8 мл / мин (насос модели 100 А; Beckman Instruments Inc., Fullerton, CA). Для препаративных целей применяли классический вариант гель-проникающей хроматографии на TOYOPERL HW 55F, колонка 2,5х150 см, скорость потока 20 мл в час. Колонку элюировали, используя 0,05 М трис-буфер.
Результаты. Экстракт ткани эпидидимисов и семенников интактных крыс проявляет очень высокий уровень эстеразной активности. В среднем активность эстераз составляет 1236,5±61,0 ЕД. Нагревание до 65 °С в течение 30 мин приводит к снижению средней эстеразной активности до 5,9±3,2 ЕД, что составляет 0,6% от активности в не обработанных повышенной температурой экстрактах. Наблюдается выраженная термолабильность ферментов, проявляющих эстеразную активность в экстрактах эпидидимисов и семенников самцов белых крыс контрольной группы [6].
В экстрактах эпидидимисов и семенников самцов крыс, подвергнутых воздействию МИНИ, зависимость эстеразной активности от температуры принципиально отличается от контрольной группы. Исходная эстеразная активность (при 40 °С) была на уровне контрольной группы и составила в среднем 1118,5±42,5 ЕД/мл (при n=127,Р≥0,5). При 65 °С средняя эстеразная активность не изменяется и составляет 918,3 ±16,7 ЕД, или 82,1% от исходной активности. При 70 °С эстеразная активность в этой группе даже недостоверно повышается до 925,0 ± 31,3 ЕД. При 80 °С эстеразная активность снижается до 310,9±32,1 ЕД, или 27,8% от исходной величины.
Естественно предположить, что такие изменения являются проявлением перегруппировки пространственной структуры белков репродуктивной системы самцов крыс под влиянием МИНИ. Известно, что МИНИ вызывает в биологических объектах несколько характерных эффектов [3; 8]. В том числе существенно влияет на гидратную оболочку молекул, вплоть до образования пероксидных и гидроксильных радикалов, вызывая проявления окислительного стресса [3].
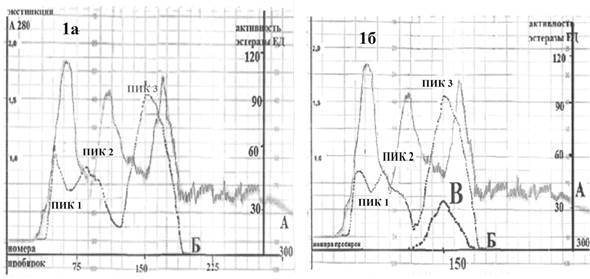
Рис. 1. Гель-проникающая хроматография экстрактов эпидидимисов и семенников самцов белых крыс в норме (1а) и после воздействия МИНИ (1б). Кривые А соответствуют экстинкции при А280 нм; кривые Б соответствуют эстеразной активности; кривая В соответствует эстеразной активности после прогрева экстракта эпидидимисов и семенников белых крыс, подвергнутых воздействию МИНИ при 80 °С
На следующем этапе исследования мы провели выделение и очистку эстераз из нативной ткани самцов крыс и тканей самцов, подвергнутых влиянию МИНИ. При анализе хроматографических фракций экстракта эпидидимисов и семенников интактных белых крыс (рис. 1а) выявлено 3 пика эстеразной активности во всем белковом спектре от 200 до 60 KD. Наиболее высокая активность эстераз отмечена в пике № 3 с максимумом молекулярной массы около 70-75 KD. При анализе хроматографических фракций экстракта эпидидимисов и семенников белых крыс, подвергнутых воздействию МИНИ, заметных изменений в спектре эстераз не выявлено (рис. 1б). Однако после температурной обработки экстрактов эпидидимисов и семенников белых крыс, подвергнутых воздействию МИНИ при 80 °С, этот спектр резко упрощается и эстеразная активность регистрируется только в области, соответствующей пику № 3 в исходных экстрактах (рис. 1б, кривая В). Исходя из этих наблюдений нами принято решение о выделении и очистке именно этой хроматографической фракции эстераз как из нативной ткани эпидидимисов и семенников белых крыс, так и из экстрактов эпидидимисов и семенников белых крыс, подвергнутых воздействию МИНИ. На первом этапе очистки мы использовали преципитацию 2 М сульфатом аммония. Предварительное исследование показало, что эстеразная активность, соответствующая пику № 3 в гель-проникающей хроматографии, сосредоточена в осадке. Это относится как к контрольной группе, так и к прогретым экстрактам. И на следующей стадии проводилась препаративная гель-фильтрация полученных осадков. Фракции, проявляющие эстеразную активность из зоны, соответствующей 85-55 KD, собирали и хранили при -24 °С. Далее накопленные фракции наносились на колонку катионообменного сефадекса С-50, уравновешенную фосфатным буфером рН=7,4. Элюировали ступенчатым градиентом хлористого натрия, и основная эстеразная активность выходила во фракциях, соответствующих концентрации хлорида натрия 0,155 М. Изоэлектрическое фокусирование приводит к окончательной очистке фермента. Раствор эстеразы, полученный после ионообменной хроматографии, обессоливали в ячейке для ультрафильтрации, смешивали с амфолинами и сахарозой и заполняли колонку объемом 185 мл. Колонка освобождается через коллектор фракций, и эстеразная активность обнаруживается во фракциях с рН=8,2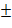 0,15. Полученные препараты диализовали, лиофилизировали и проводили физико-химический анализ.
0,15. Полученные препараты диализовали, лиофилизировали и проводили физико-химический анализ.
Исследование препаратов эстераз из экстракта эпидидимисов и семенников белых крыс контрольной группы и из экстракта эпидидимисов и семенников белых крыс, подвергнутых воздействию МИНИ, на отношение их к ингибиторам показало, что исследуемые нами ферменты принадлежат к группе карбоксилэстераз, т.к. не ингибируются ПХМБ и эзерином, но их активность полностью подавляется 0,1 М фторидом натрия и фосфаколом.
Препарат эстеразы из экстракта эпидидимисов и семенников белых крыс контрольной группы получил условное название КЭ-1ТЛ (карбоксилэстераза-1 термолабильная), а из экстракта эпидидимисов и семенников белых крыс, подвергнутых воздействию МИНИ, получил условное название КЭ-1ТС (карбоксилэстераза-1 термостабильная).
Исследование термолабильности, проведенное путем прогрева аликвот препаратов КЭ-1ТЛ и КЭ-1ТС в термостатируемых ячейках микротермостата М-208, показало, что КЭ-1ТЛ теряет 100% своей активности уже после прогревания до 65 °С, а КЭ-1ТС сохраняет до 26,5% исходной активности при 80 °С. В основе изменения температурной устойчивости любого белка, и исследованного нами фермента в частности, лежат фундаментальные изменения формирования третичной структуры молекулы [1; 8; 10]. Выяснить эти изменения позволяет, по нашему мнению, сравнительный физико-химический анализ полученных препаратов. Аналитическое изоэлектрофокусирование, проведенное в узком диапазоне рН от 7,0 до 9,0, показало (рис. 2), что очищенный препарат КЭ-1ТЛ имеет изоэлектрическую точку, равную 8,2, а очищенный препарат КЭ-1ТС имеет изоэлектрическую точку, равную 8,08. Это различие обусловлено, видимо, снижением на поверхности молекулы фермента положительно заряженных радикалов.
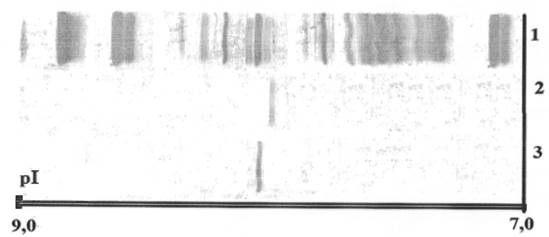
Рис. 2. Изоэлектрическое фокусирование в полиакриламидном геле. Амфолиты-носители: pH 7,0-9,0 0,6 мл. 1 - исходный экстракт эпидидимисов и семенников белых крыс; 2 - препарат КЭ-1ТС; 3 - препарат КЭ-1ТЛ
Электрофорез в SDS-полиакриламидном геле (рис. 3) позволил определить молекулярную массу исследуемых препаратов, и она оказалась равной 72,5 KDa. По этому показателю препараты КЭ-1ТЛ и КЭ-1ТС не отличались друг от друга.
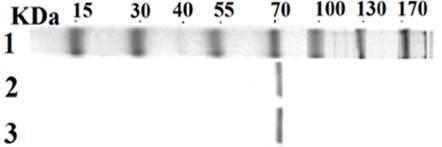
Рис. 3. Электрофорез в SDS-полиакриламидном геле. 1 - стандарт молекулярной массы белков (Geni, Бангалор); 2 - препарат КЭ-1ТС; 3 - препарат КЭ-1ТЛ
Сравнительное исследование эстеразной активности полученных препаратов показало, что КЭ-1ТЛ обладает удельной активностью 12,45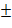 0,62 ЕД/мг белка, а КЭ-1ТС обладает удельной активностью 7,69
0,62 ЕД/мг белка, а КЭ-1ТС обладает удельной активностью 7,69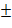 0,87 ЕД/мг, что на 38.2% ниже (Р
0,87 ЕД/мг, что на 38.2% ниже (Р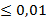 ). Исходя из того что после воздействия МИНИ общая эстеразная активность экстрактов эпидидимисов и семенников белых крыс достоверно не отличается от контрольной группы [6], можно предположить, что компенсаторно увеличивается активность других эстераз экстрактов эпидидимисов и семенников белых крыс. Эти ферменты представлены, как видно из данных гель-фильтрации (рис. 1), более тяжелыми фракциями в пиках 1 и 2. Либо происходит компенсаторное увеличение массы фермента КЭ-1ТС, замещающее низкую удельную активность.
). Исходя из того что после воздействия МИНИ общая эстеразная активность экстрактов эпидидимисов и семенников белых крыс достоверно не отличается от контрольной группы [6], можно предположить, что компенсаторно увеличивается активность других эстераз экстрактов эпидидимисов и семенников белых крыс. Эти ферменты представлены, как видно из данных гель-фильтрации (рис. 1), более тяжелыми фракциями в пиках 1 и 2. Либо происходит компенсаторное увеличение массы фермента КЭ-1ТС, замещающее низкую удельную активность.
Полученные данные о физико-химических свойствах исследуемых ферментов сведены в таблице.
Сравнительный физико-химический анализ препаратов эстеразы КЭ-1ТЛ и КЭ-1ТС
|
параметры |
КЭ-1ТЛ
|
КЭ-1ТС |
Р |
|
Ингибитор 0,1М NaF |
Подавляет |
Подавляет |
- |
|
Ингибитор фосфакол 10-5М |
Подавляет |
Подавляет |
- |
|
Ингибитор Эзерин 10-5М |
Не подавляет |
Не подавляет |
- |
|
Ингибитор ПХМБ 10-5М |
Не подавляет |
Не подавляет |
- |
|
Удельная ферментативная активность |
12,45 |
7,69 |
|
|
Изоэлектрическая точка |
8,2 |
8,08 |
|
|
Молекулярная масса |
72,5 KD |
72,5 KD |
|
Изменения термостабильности фермента эстеразы эпидидимисов и семенников самцов белых крыс под воздействием МИНИ могут быть объяснены специфическим действием микроволнового излучения на белковые молекулы. Изменение изоэлектрической точки КЭ-1ТС может служить косвенным доказательством образования пероксидных и гидросильных радикалов в гидратной оболочке белка, т.к. вероятной причиной снижения заряда белка является окисление некоторых аминогрупп на его поверхности. Кроме того, видимо, оксидативный стресс, вызванный МИНИ, структурирует гидратные оболочки эстеразы, сокращая длину и несколько изменяя угол водородной связи между молекулами воды. Это приводит к повышению плотности белковой молекулы, ее «гиперфолдингу». И, как следствие, повышению термостабильности.
Библиографическая ссылка
Ушакова М.В., Кузнецова М.Г., Узбякова Р.Р., Бородкова А.А. ИЗМЕНЕНИЕ СВОЙСТВ ЭСТЕРАЗЫ РЕПРОДУКТИВНОЙ СИСТЕМЫ САМЦОВ КРЫС ПОД ВОЗДЕЙСТВИЕМ НИЗКОИНТЕНСИВНОГО МИКРОВОЛНОВОГО ИЗЛУЧЕНИЯ // Современные проблемы науки и образования. 2017. № 5. ;URL: https://science-education.ru/ru/article/view?id=27094 (дата обращения: 14.02.2026).