На сегодняшний день рак молочной железы (РМЖ) по-прежнему занимает лидирующие позиции среди онкологических патологий у женщин в мире [1].
Генетическая предрасположенность является одним из главных факторов риска развития данного заболевания, на долю которого приходится от 5 до 10 % случаев всех злокачественных новообразований данной локализации [2].
В основе развития семейных форм РМЖ лежат наследственные мутации в генах BRCA 1/2, CHEK2, TP53, NBN, PALB2 и др. Однако около 30 % из всех наследственных случаев обусловлено мутациями в генах BRCA (Breast Cancer Associated) 1 и BRCA2. Эти гены относятся к высоко пенетрантным, функцией которых является участие в поддержании целостности генома и обеспечении репарации двойных разрывов ДНК, возникающих при воздействии различных повреждающих факторов [3].
Женщины, несущие наследственные мутации в гене BRCA1, имеют риск развития РМЖ 45–60 % в возрасте до 40 лет. В свою очередь, при наличии мутаций в гене BRCA2, риск РМЖ составляет 25–40 % [4]. Среди здоровых лиц можно выделить группу носителей мутаций, у которых онкологическая патология разовьется с высокой вероятностью в течение жизни. Также известно, что риск развития рака в контрлатеральной молочной железе в случае обнаружения мутантного типа гена BRCA в возрасте 41–50 лет составляет 6,3 %, в то время как среди больных старше 60 лет риск развития контрлатерального РМЖ равен нулю [4]. Генетически обусловленные формы РМЖ, в отличие от спорадических, имеют свои особенности течения и прогноза и требуют индивидуального подхода как в диагностике, так и в профилактике данного заболевания.
Международная база данных (Breast Cancer Information Core) содержит свыше 300 различных вариантов мутаций генов BRCA 1/2. Несмотря на то, что мутации генов BRCA1/2 чрезвычайно многообразны, при обследовании населения в разных странах часто можно проследить т.н. «эффект основателя» (foundereffect), заключающийся в преобладании каких-либо конкретных мутаций BRCA1/2 в данной популяции (табл.1). Так, повышенная частота мутаций BRCA1 185delAG, BRCA1 5382insC и BRCA2 6174delT характерна для евреев Ашкенази – на эти три мутации приходится 98−99 % всех мутаций в генах BRCA1 и BRCA2 [5]. В Италии из всех обнаруженных мутаций в гене BRCA1 мутации BRCA1 3347delAG, BRCA1 3404delA, BRCA1 1499insA, BRCA1 5181delGTT составляют более 73 % [6]. Для Норвегии характерны мутации в гене BRCA11675delA, 3347delAG, 816delGT и 1135insA, на которые приходится свыше 68 % всех обнаруженных мутаций [7]. В Исландии практически единственной мутацией является 999del5 гена BRCA2 [8]. В странах Восточной Европы более чем в 70 % случаев выявляются мутации BRCA1 5382insC, BRCA1 4154delA и BRCA1 T300G [9-12].
Таблица 1
Спектр преобладающих мутаций в разных странах
|
Страна |
Преобладающая мутация |
|
Австрия |
BRCA1 300T>G (C61G) |
|
Италия |
BRCA13404delA, BRCA1 3347delAG |
|
Германия |
BRCA1 4184del4, BRCA1 2457C> T |
|
Греция |
BRCA1 5331G> A, BRCA15370C> T |
|
Норвегия |
BRCA1 1675delA, BRCA1 3347delAG |
|
Финляндия |
BRCA1 4216-2A> G, BRCA2 999del5 |
|
Исландия |
BRCA2999del5 |
Согласно ряду российских исследований преобладающими мутациями на территории Российской Федерации являются: 5382insC, С61G, 185delAG, 4154delA, 2080delA, 6174delТ, которые охватывают до 70–90 % всего спектра выявленных мутаций в этих генах. Однако большое количество работ доказывают тот факт, что спектр мутаций в генах BRCA1 и BRCA2 разнится от региона к региону [13, 14, 15].
Влияние генетической предрасположенности к РМЖ у женщин в Южном Федеральном Округе изучено недостаточно, таким образом, целью нашей работы стало выявление спектра и частот встречаемости мутаций в генах BRCA1 и BRCA2 в популяциях ЮФО среди пациенток с клиническими признаками наследственного рака молочной железы.
Материалы и методы
Нами был проведен молекулярно-генетический анализ ДНК 133 пациенток с верифицированным РМЖ и клиническими признаками наследственного РМЖ, проходивших стационарное лечение в ФГБУ «Ростовский научно-исследовательский онкологический институт» (РНИОИ) Минздрава Российской Федерации, постоянно проживающих в ЮФО. Медиана возраста на момент постановки диагноза составляла 49 лет, а возраст варьировал в диапазоне от 24 до 79 лет.
При отборе пациенток для включения в исследование учитывались следующие клинические признаки [2,13]:
- молодой возраст начала заболевания (до 50 лет);
- онкологически отягощенный семейный анамнез;
- наличие первично-множественных опухолей;
-трипл-негативный статус рецепторов ER, PR, Her2.
Геномную ДНК выделяли из лейкоцитов периферической крови с помощью лизирующего SDS-содержащего буфера в присутствии протеиназы-К и последующей фенол-хлороформной экстракции. Концентрацию полученных препаратов ДНК измеряли на флюориметре Qubit 2.0® (Invitrogen, США) с использованием набора Quant-iT™ dsDNA (HS) AssayKit (Invitrogen, США) и доводили до 2 нг/мкл. Постановку реакции ПЦР-амплификации проводили с помощью комплекта реагентов «BRCA-скрин» (ИнтерЛабСервис, Россия), предназначенного для определения 6 мутаций в генах BRCA1/2 (табл. 2) согласно протоколу производителя на термоциклере MaxygeneGradient (Axygen). Для идентификации ПЦР-продуктов использовали метод электрофореза в 2 % агарозном геле и систему гель-документирования GelDoc XR PLUS (BioRad, USA). В дальнейшем продукт амплификации подвергали очистке, денатурации и отмывке при помощи станции для пробоподготовки (VacuumPrepWorkstation, Qiagen, Germany). Затем одноцепочечный ПЦР-продукт отжигали с секвенирующими праймерами при 80 0С и использовали для проведения реакции пиросеквенирования в системе генетического анализа PyroMark Q24 (Qiagen, Germany). Полученные данные анализировали с помощью программного обеспечения PyroMark Q24 Software (Qiagen, Germany).
Таблица 2
Спектр анализируемых мутаций в генах BRCA1 и BRCA2 с использованием набора реагентов "BRCA-скрин" («ИнтерЛабСервис», Россия):
|
Локус |
Полиморфизм |
Последовательность нуклеотидов для анализа |
|
BRCA1 |
185delAG |
TCTAAGATTTTC |
|
BRCA1 |
300T>G (C61G) |
T/GGTCCTTTA |
|
BRCA1 |
2080delA |
TCTTTATC |
|
BRCA1 |
4154delA |
GAAGAAAGAGGA |
|
BRCA1 |
5382insC |
GATTCTCTTG |
|
BRCA2 |
6174delT |
ACTTGCTGT |
Результаты и обсуждение
В ходе проведения молекулярно-генетического исследования 133 образца геномной ДНК выделенной из лейкоцитов периферической крови пациенток с клиническими признаками наследственного рака молочной железы были выявлены 19 образцов, несущих мутацию в исследованных генах, что составило 14,2 % (рис.1).
Из всего проанализированного спектра было выявлено два типа мутаций: 16 образцов несли мутацию 5382 insC в 20 экзоне гена BRCA1 и 3 образца содержали мутацию 300T>G в этом же гене. Генетических изменений в гене BRCA2, в рамках нашего исследования, не было выявлено.
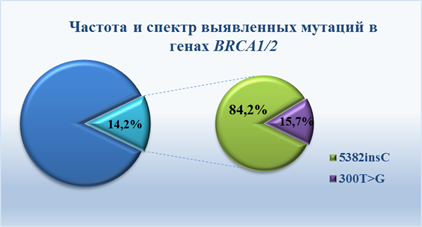
Рис. 1. Частота и спектр мутаций в генах BRCA1 и BRCA2
Для пациенток, несущих мутации, были характерны инфильтрирующий протоковый, медулярный, билатеральный и криброзный раки. По гистологическим заключениям преобладала инфильтрирующая карцинома. Трижды негативный подтип РМЖ среди пациенток, имеющих мутации 5382 insC в гене BRCA1, был выявлен в двух случаях или в 12,5 % случаев от всех мутаций 5382 insC в гене BRCA1. Люминальный тип В наблюдался в 3 случаях (18,75 %), Неr2-положительными были 2 пациента (12,5 %), а люминальный А подтип встретился только 1 раз (6,25 %).
При анализе семейного онкологического анамнеза РМЖ был отмечен у 14 кровных родственников по материнской линии (76,9 %), у четырех пациенток с мутациями в гене BRCA1 5382 insC, в семейном анамнезе онкозаболеваний отмечено не было (23,1 %). Таким образом, можно сделать вывод, что сбор анамнеза о случаях онкологических заболеваний в семье не является достаточным и единственным критерием отбора при назначении молекулярно-генетического тестирования мутаций генов BRCA1/2.
В проведенном нами исследовании также была обнаружена мутация 300T>G в гене BRCA1 с частотой встречаемости данного типа мутаций 15,7 %. При гистологическом исследовании, так же, как и при наличии мутаций 5382insC в гене BRCA1 была отмечена инфильтрирующая протоковая карцинома. Возраст пациенток на момент постановки диагноза составлял 30, 48 и 60 лет. Семейный анамнез также был отягощен.
При оценке роли клинических составляющих наследственного РМЖ обнаружено, что у 10-ти пациенток (в 52,6 %) с сочетанием двух признаков наследственного РМЖ во всех случаях присутствовали мутации в гене BRCA1. У четырех пациенток с мутацией 5382 insC (21,1 %) в гене BRCA1 наблюдалось сочетание трех клинических признаков НРМЖ (молодой возраст манифестации заболевания, онкологически отягощенный анамнез и синхронный или метахронный рак). Одна пациентка (5,2 %), носительница мутантного аллеля, имела в личном анамнезе рак яичников. И четыре пациентки (21,05 %) имели лишь один из перечисленных признаков наследственного рака молочной железы.
Анализ распределения мутаций в зависимости от возраста показал (рис. 2), что наиболее часто мутации в гене BRCA1 манифестируются у пациенток в возрасте от 30–39 лет – 57,9 %, в группе 40–49 лет – 26,3 % и в группе старше 50 лет в 15,8 % случаев, что хорошо согласуется с критериями возрастной пенетрантности наследственного РМЖ.
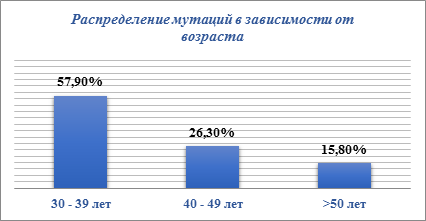
Рис. 2. Встречаемость мутаций гена BRCA1 у пациенток с РМЖ в зависимости от возраста
Заключение
Результаты проведенного нами анализа наглядно демонстрируют качественный спектр и частоту встречаемости мутаций в генах BRCA1 и BRCA2, аналогичную ранее проведенным исследованиям на территории Российской Федерации у пациенток славянской группы [12]. Это позволяет сделать вывод, что используемая нами диагностическая панель инструментов может быть корректно использована для скрининга «классических» наследственных полиморфизмов в генах BRCA1/2у пациенток Юга России, среди которых представители славянской группы составляют подавляющее большинство.
Библиографическая ссылка
Богомолова О.А., Шатова Ю.С., Верескунова М.И., Черникова Е.Н., Кучкина Л.П., Луганская Р.Г., Бакулина С.М., Водолажский Д.И. ГЕРМИНАЛЬНЫЕ МУТАЦИИ В ГЕНАХ BRCA1 И BRCA2 У ПАЦИЕНТОК ЮГА РОССИИ С КЛИНИЧЕСКИМИ ПРИЗНАКАМИ НАСЛЕДСТВЕННОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ // Современные проблемы науки и образования. 2017. № 5. ;URL: https://science-education.ru/ru/article/view?id=26920 (дата обращения: 29.01.2026).



