Варьирование числа копий участков ДНК человека (Copynumbervariation – CNV) относится к одному из видов полиморфизма, встречающемуся в нормальных клетках в процессе дифференцировки и функционирования, и затрагивающего, по меньшей мере, 10 % генома. Исследования последних лет свидетельствуют о важной роли аберрантных изменений CNV в онкогенезе [10]. Накопление CNV-событий в онкотрансформированных клетках может служить селективным фактором преимущества по сравнению с нормальными клетками тканей. В ряде работ были выявлены потери проапоптотических генов в образцах раковых опухолей желудка и одновременно противоположный процесс – амплификация генов, связанных с ростом, делением и метастазированием [1, 8].
Всё больше фактов свидетельствует о том, что CNV могут стать информативными биомаркерами для ранней диагностики рака желудка, последующего контролирования течения заболевания и эффективности терапии, а также служить маркерами таргетной химиотерапии. Кроме того, предложено использовать CNV для молекулярного субтипирования рака желудка [6, 7]. Не менее важной задачей является поиск прогностических маркеров метастазирования, так как метастазы возникают у 80–90 % больных раком желудка, при этом выживаемость составляет 65 % в случае ранней диагностики заболевания и менее 15 % на поздних стадиях процесса [12].
Цель настоящего исследования заключалась в изучении числа копий генетических локусов в неопластических опухолях желудка, как без признаков метастатического поражения регионарных лимфатических узлов, так и с метастазами в них. Относительную копийность (RCQ) определяли для 16-ти генов ядерной локализации – участников ключевых сигнальных путей, регулирующих рост клетки, выживание, метастазирование и устойчивость к химиотерапии, и некодирующего локуса митохондриальной ДНК (HV2), потеря копийности которой является наиболее распространенным событием при неоплазиях различной локализации.
Материалы и методы
Клиническим материалом для исследования относительной копийности генов служили ткани (опухолевые и условно здоровые) 47-ми пациентов Юга России с гистологически подтвержденным диагнозом аденокарциномы G2-G3 (Таблица 1), проходивших плановое лечение в ФГБУ «РНИОИ» МЗ РФ. Медиана возраста составила 67 лет (от 36 до 83 лет). Образцы тканей были получены в процессе хирургического вмешательства в период с 2015 по 2016 г. Все пациенты, вошедшие в данное исследование, имели ECOG статус от 1 до 2. Для работы с биоптатами пациентов были получены добровольные информированные согласия, в соответствии с этическим регламентом проведения медико-биологических исследований.
По клинической классификации заболевания были сформированы две группы пациентов: группа T3-4N0M0 с локализованной формой опухоли (n=18) и группа T3-4N1-2M0 с местнораспространенной формой рака желудка (n=29). Для верификации образцов тканей проводилось стандартное патолого-морфологическое исследование с окрашиванием фиксированных срезов гематоксилин-эозином. Биоптаты тканей после проведения патолого-морфологического исследования классифицировали на две группы: опухолевые (малигнизированные) и контрольные (не малигнизированные) образцы.
Таблица 1
Клинико-морфологическая характеристика пациентов
|
Характеристика |
Переменные |
Количество (%) |
|
Клиническая классификация |
T3-4N0M0 |
18 (38%) |
|
T3-4N1-3M0 |
29 (62%) |
|
|
Стадия дифференцировки опухоли (G) |
2 |
24 (51%) |
|
2-3 |
12 (26%) |
|
|
3 |
11 (24%) |
|
|
Пол |
женщины |
14 (30%) |
|
мужчины |
33 (70%) |
|
|
Возраст, лет |
<60 |
11 (23%) |
|
>60 |
36 (77%) |
Геномную ДНК экстрагировали из свежезамороженных операционных биоптатов тканей желудка с использованием лизирующего SDS-содержащего буфера в присутствии протеиназы-К и последующей фенол-хлороформной экстракцией [2]. Концентрацию полученных препаратов ДНК измеряли на флюориметре Qubit 2.0® (Invitrogen, США) с использованием набора Quant-iT™ dsDNAHigh-Sensitivity (HS) AssayKit (Invitrogen, США).
Для определения дозы гена (RCQ) проводили ПЦР в реальном времени (RT-qPCR). Прямые и обратные праймеры были разработаны с использованием соответствующих референсных последовательностей NCBI GenBank в программе Primer-BLAST. Каждые 25 мкл ПЦР-смеси содержали 10 нг геномной ДНК, 0,2mM dNTP’s, по 600 нМ прямого и обратного праймеров, 2,5 mM MgCl2, ПЦР-буфер, 0,05u/µl ДНК-полимеразы Thermusaquaticus («Синтол», Россия). В качестве красителя использовали EvaGreen (Biotium, США). Амплификацию каждой из проб осуществляли в трех повторностях. Количественную RT-qPCR проводили с использованием термоциклера CFX96 (Bio-Rad, США) в соответствии с инструкциями производителя по следующей программе: 95 °C 3 мин., и 40 циклов при 95 °C 10 сек, 58 °C 30 секунд (чтение оптического сигнала FAM для красителя EvaGreen) и 72 °C 15 секунд. Первичные данные RT-qPCR получали с использованием программного обеспечения Bio-Rad CFX Manager (ver. 2.1). Генетический локус GAPDH использовали в качестве референсного для нормализации полученных показателей количественной RT-qPCR.
Относительную копийность генетического локуса (RСQ) рассчитывали по формуле 2-ΔCt. Дозу исследованного локуса считали равной диплоидному набору (2n), если отношение RCQопухоль/норма ~1. Если отношение RCQопухоль/норма было > 1,5 или< 0,5, дозу локуса считали увеличенной (>3n) или уменьшенной (<1n), соответственно.
Статистический анализ проводили с помощью непараметрических критериев в программах Statisticav.7 и SPSSStatistics 19.
Результаты исследования и их обсуждение
Для всех вошедших в исследование пациентов были получены данные по копийности 17-ти генетических локусов. В целом, 33 образца неоплазий желудка (70 %) продемонстрировали амплификацию и/или потерю хотя бы по одному локусу. Среднее значение локусов амплифицированных и/или с потерей в группе T3-4N0M0 (без регионарных метастазов) составило 1,06+0,83 на одного пациента, а в группе T3-4N1-3M0 (с регионарными метастазами) – 2,14+2,2.
Выявлено аберрантное изменение RCQ 14-ти исследованных генов хромосомной локализации, за исключением АРС и GKN1 (рисунок 1).
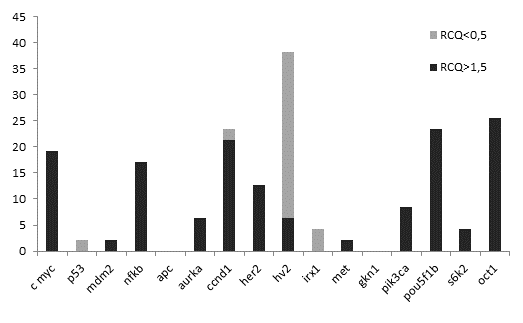
Рис. 1. Частота амплификаций и потерь 16-ти генетических локусов в образцах аденокарциномы желудка
Потеря копийности зафиксирована для двух генов-онкосупрессоров (IRX1 и p53). Напротив, для 11-ти онкогенов было характерно увеличение относительной копийности, тем не менее в одном образце опухоли с регионарными метастазами была отмечена потеря копийности локуса CCND1, кодирующего белок циклин D1. Наиболее частыми CNV-изменениями в образцах аденокарциномы желудка стало уменьшение копийности локуса мтДНКHV2 в 15-ти случаях (32 %), кроме этого в трёх случаях HV2 был амплифицирован по сравнению с неопухолевой тканью желудка (рисунок 1).
Распределение случаев аберрантного изменения RCQ по локусам в исследованной выборке в зависимости от ряда клинико-патологических показателей приведено в таблице 2.
Таблица 2
Клинико-морфологические характеристики и частота аберрантных RCQ в исследованных локусах
|
Локус |
Возраст |
Пол
|
G |
N-классификация |
||||||||
|
<60, (%) |
>60, (%) |
P* |
мужчины, (%) |
женщины, (%) |
P |
G2, (%) |
G2-3, (%) |
P |
N0, (%) |
N1-3, (%) |
P |
|
|
c-myc |
1(9) |
8(22) |
0,595 |
6(18) |
3(21) |
0,883 |
2(8) |
7(30) |
0,056 |
1(6) |
7(24) |
0,099 |
|
p53 |
0 |
1(3) |
0,526 |
1(3) |
0 |
0,655 |
1(4) |
0 |
0,982 |
0 |
1(3) |
0,807 |
|
mdm2 |
0 |
1(3) |
0,526 |
1(3) |
0 |
0,655 |
0 |
1(4) |
0,983 |
0 |
1(3) |
0,807 |
|
nfkb |
1(9) |
7(19) |
0,734 |
7(21) |
1(7) |
0,453 |
3(13) |
5(22) |
0,649 |
0 |
7(24) |
0,047 |
|
aurka |
1(9) |
2(6) |
0,775 |
2(6) |
1(7) |
0,607 |
0 |
3(13) |
0,070 |
0 |
3(10) |
0,425 |
|
ccnd1 |
2(18) |
8(22) |
0,893 |
10(30) |
0 |
0,053 |
5(21) |
5(22) |
0,779 |
4(22) |
6(21) |
0,808 |
|
her2 |
2(18) |
4(11) |
0,921 |
3(9) |
3(21) |
0,490 |
4(17) |
2(9) |
0,703 |
1(6) |
5(17) |
0,433 |
|
hv2 |
5 |
13(36) |
0,838 |
13(39) |
5(36) |
0,928 |
8(33) |
10(44) |
0,678 |
8(44) |
10(35) |
0,708 |
|
irx1 |
2(18) |
3 |
0,713 |
4(12) |
1(7) |
0,991 |
2(8) |
3(13) |
0,959 |
1(6) |
4(14) |
0,405 |
|
met |
0 |
1(3) |
0,526 |
1(3) |
0 |
0,655 |
1(4) |
0 |
0,982 |
0 |
1(3) |
0,807 |
|
pik3ca |
1(9) |
3(8) |
0,890 |
3(9) |
1(7) |
0,724 |
1(4) |
3(13) |
0,570 |
1(6) |
3(10) |
0,480 |
|
pou5f1b |
1(9) |
10(28) |
0,382 |
9(27) |
2(14) |
0,626 |
3(13) |
8(35) |
0,074 |
1(6) |
10(35) |
0,045 |
|
s6k2 |
1(9) |
1(3) |
0,956 |
2(6) |
0 |
0,879 |
0 |
2(9) |
0,451 |
0 |
2(7) |
0,692 |
|
oct1 |
4(36) |
8(22) |
0,585 |
11 |
1(7) |
0,129 |
6(25) |
6(26) |
0,803 |
4(22) |
8(28) |
0,947 |
|
N |
11 |
36 |
33 |
14 |
24 |
23 |
18 |
29 |
||||
Примечание: * – вероятность в χ2-тесте.
Статистический анализ данных выявил тенденцию влияния пола на частоту изменения числа копий гена ccnd1 (р=0,053), все 10 случаев аберрантных RCQccnd1 были определены у мужчин. В качестве тенденции также определена ассоциация амплификации двух локусов aurka и pou5f1b с низкой степенью дифференцировки (G3) опухоли (Р=0,070 и Р=0,074, соответственно). Дискриминация групп с локализованной формой опухоли (T3-4N0M0) и местнораспространенной формой рака желудка (T3-4N1-3M0) возможна по двум исследованным ядерным локусам nfkb и pou5f1b (χ2= 5,10 и 5,18, соответственно, Р<0,05). В группе T3-4N1-3M0 частота амплификации гена nfkb составила 24 %, гена pou5f1b – 34 %, тогда как в группе T3-4N0M0 изменений RCQ локуса nfkb не было зафиксировано, а амплификация pou5f1b отмечена в 6 % опухолей (OR=8,95, 95 %CI: 1,035-77,37, P<0,05). Потенциально для идентификации местнораспространенной формы рака желудка возможно использование ещё одного онкогена c-myc, амплификация которого также преобладала в группе T3-4N1-3M0 (χ2=2,72, Р=0,099).
Корреляционный анализ полученных данных выявил статистически достоверные ассоциации между амплификацией трёх локусов c-myc, nfkb, pou5f1b и метастазированием в региональные лимфоузлы (р=0,026; 0,009; 0,009, соответственно), а также степенью дифференцировки опухоли (р=0,042; 0,014;0,016, соответственно).
Отметим, что в группе T3-4N1-3M0 статистически достоверно коррелировала амплификация генов C-MYCи POU5F1B (R=0,609, р<0,01), локализованных рядом на 8q24 хромосоме.
Ранее нами обсуждалось снижение числа копий митохондриальной ДНК (мтДНК), оцениваемое по RCQ локуса HV2, в различных гистологических типах рака желудка относительно нормальных клеток и по мере потери дифференцировки опухоли [1]. Тенденция снижения числа копий мтДНК, как отражение известного эффекта Варбурга – перехода малигнизированных клеток в режим преимущественного использования гликолиза [9], отражена и в настоящем исследовании, однако данный маркер не дискриминировал опухоли с метастазами в регионарные лимфоузлы. Тем не менее частота снижения числа копий HV2 в группе с локализованной формой опухоли составила 44 % против 28 % в группе с местнораспространенной формой рака желудка. Кроме того, в последней присутствовали два случая амплификации локуса HV2. Полученная тенденция согласуется с описанным повышением копийности мтДНК в опухолевых тканях у пациентов с метастазами, что может отражать особенности энергетического метаболизма, переводящей клетки в аэробный режим для обеспечения их распространения из первичного очага в другие органы [9].
Одной из основных задач исследования CNV генома является выявление нарушения баланса онкогенов и онкосупрессоров, которые вызывают функциональные нарушения в клетке, способствующие её малигнизации. Согласно литературным данным охарактеризованы изменения копийности множества генов в опухолях различного происхождения. Отметим однако, что оценки встречаемости изменения копийности одного и того же гена часто значительно разнятся. Так, приводимые частоты амплификации онкогена HER2, ассоциированного, как правило, с плохим прогнозом заболевания, варьируют от 6 до 23 % от числа исследованных случаев рака желудка [7]. Вклад в вариативность оценок, по-видимому, могут вносить как методы и схема исследования, так и популяционная принадлежность пациентов. Например, в двух недавних работах методами PCR-RT и FISН оценивалась копийность другого онкогена MET, который считают перспективным в качестве мишени для таргетной терапии при раке желудка. Относительно высокая частота амплификации гена MET (21,8 %) была определена группой Haetal. [3], исследовавших пациентов этнических корейцев (n=495). В работе Janijisiaetal. [5], изучавших пациентов западных регионов США (n=38), амплификации MET не было обнаружено, несмотря на повышенную экспрессию мРНК и белка в 63 % и 50 % случаев, соответственно.
В нашей работе не были идентифицированы образцы опухолей с аберрантной копийностью генов APC и GKN1, что может быть обусловлено и недостаточной численностью выборки для идентификации редких событий, и популяционным составом выборки пациентов (европеоиды), а также ограничениями при формировании групп сравнения (отбирали опухоли с инвазией всех слоев желудка – Т3-4). Экспрессия гена GKN1, недавно идентифицированного мощного супрессора опухоли желудка, значительно падает в большинстве метаплазий и раковых опухолях [15]. Однако механизмы негативной регуляции активности GKN1 изучены недостаточно, рассматривается участие в этом процессе, как уменьшение копий гена, так и инактивирующие мутации и гиперметилирование промотора.
В целом, выявленные нами частоты аберрантных RCQ в злокачественных опухолях желудка T3-4N0-3M0 в большинстве случаев согласуются с данными более ранних исследований. Условно генетические локусы, вошедшие в настоящую работу, можно разделить на группу, показатели аберрантной относительной копийности которых редко изменяются при малигнизации (частота менее 10 %), такие как – P35, MDM2, AURKA, IRX1, MET, PIK3CA, S6K2, и на группу, показатели RCQ которых чаще изменяются при малигнизации тканей желудка, такие как – C-MYC, NFKB, CCND1, HER2, HV2, POU5F1B, OCT1.
Два из 17-ти исследованных локусов продемонстрировали статистическую значимость для дискриминации групп T3-4N0M0 и T3-4N1-3M0-NFKB (чувствительность Se-88 %; специфичность Sp – 45 %) и POU5F1B(Se-91 %; Sp – 47 %); в отношении локуса C-MYC наблюдалась тенденция влияния на риск образования метастазов (чувствительность Se-78 %; специфичность Sp – 44 %). Ранее сообщалось о значительном увеличении числа копий гена с-Мyс в процессе канцерогенеза [11], в том числе была показана тесная связь этого события с глубиной метастазов в лимфатических узлах и инвазией опухоли желудка [13]. Для гена POU5F1B с ещё не вполне описанными функциями была продемонстрирована связь увеличения числа копий и избыточной экспрессии при раке желудка, что в свою очередь, коррелировало с ростом опухоли [4]. Биологическое значение активации ядерного фактора-каппа-B (NF-kappaB) в неопластических образованиях желудка человека неясно. Тем не менее была выявлена ассоциация активации NF-kappa B с канцерогенезом, агрессивностью опухоли желудка и инфекцией H.pylori с повышенной экспрессией MMP-9, IL-1beta и IL-8 [14].
В целом, обнаружение в опухоли желудка амплификации по одному из трёх описанных выше маркеров и/или изменение RCQ более чем по двум ядерным локусам, оцененным в настоящей работе, повышает риск метастазирования в регионарные лимфатические узлы в 6,9 раз (OR=6,933; 95 % CI:1.3-35.3; Se – 87 %, Sp – 52 %).
Заключение
Относительная копийность исследованных генетических локусов в опухолях желудка разных N-типов изменяется не одинаково. Для аденокарцином T3-4N1-3M0, в отличие от аденокарцином T3-4N0M0, характерна амплификация онкогенов NFKB и POU5F1B.
Библиографическая ссылка
Водолажский Д.И., Тимошкина Н.Н., Маслов А.А., Колесников Е.Н., Татимов М.З. КОПИЙНОСТЬ 17-ТИ ГЕНЕТИЧЕСКИХ ЛОКУСОВ У ПАЦИЕНТОВ С ДИАГНОЗОМ АДЕНОКАРЦИНОМА ЖЕЛУДКА // Современные проблемы науки и образования. 2017. № 3. ;URL: https://science-education.ru/ru/article/view?id=26405 (дата обращения: 02.01.2026).



