Одной из главных задач послеоперационного ведения пациентов является купирование болевого синдрома.Несмотря на то, что в арсенале современной анестезиологии существует большой выбор лекарственных препаратов и методик, эффективность аналгезии часто оказывается неудовлетворительной [1], в том числе, и при сравнительно малотравматичных операциях.
Гинекологические операции традиционно относятся к вмешательствам средней травматичности, однако интенсивность послеоперационного болевого синдрома при них зачастую оказывается выше, по сравнению с операциями на органах верхнего этажа брюшной полости, являющимися «эталоном» травматичности [5]. Недооценка значимости послеоперационного болевого синдрома может усугубляться, когда речь идет об эндоскопических вмешательствах. Несмотря на очевидные преимущества эндоскопической техники, различия с «открытыми» вмешательствами в плане именно интенсивности боли могут быть не столь заметными [3].
Последствиями недостаточной анальгезии являются увеличение числа осложнений, времени восстановления пациентов после операции и, как следствие, увеличение продолжительности госпитализации и экономических затрат на лечение [4].
Для послеоперационного обезболивания в России в 60 % случаев используют опиоиды, однако при монотерапии их эффективность недостаточна и весьма вариабельна [2]. Кроме субъективных факторов вариабельность эффектов наркотических анальгетиков может определяться генетическими особенностями пациента. В частности, продемонстрировано, что чувствительность к наркотическим анальгетикам (а соответственно и их клиническая эффективность) может быть снижена у пациентов с наличием полиморфизмовв генахмю-опиоидного рецептора и катехол-О-метилтрансферазы [6].
Генетические особенности пациента могут определять и фармакокинетику препаратов. В частности, в реакции I фазы биотрансформации трамадола (препарата, широко рекомендуемого и используемого при боли средней интенсивности) происходит деметилирование с участием изофермента Р-450, CYP2D6. В результате образуется О-десметилтрамадол, обладающий существенно более высокой анальгетической активностью [7]. Наличие полиморфизмов гена CYP2D6 может значимо изменять скорость биотрансформации и определять эффективность применения трамадола [8]. Вместе с тем, исследования генетических аспектов клинической эффективности и безопасности применения трамадола в целях послеоперационного обезболивания весьма немногочисленны и разноречивы.
Цель исследования: оценка адекватности послеоперационной анальгезии на основе трамадола и выраженности его побочных эффектов при крупных эндоскопических операциях в гинекологии в зависимости от аллельных вариантов гена CYP2D6, изофермента цитохрома P-450.
Материалы и методы
Исследование проводилось с одобрения этического комитета ФГБОУ ВО ЯГМУ Минздрава России, имело проспективный характер. Материал исследования составили наблюдения за 48 пациенткамив возрасте до 65 лет, без значимой сопутствующей патологии, которым в плановом порядке выполнялись операции по поводу миомы матки: гистерэктомия (в 17 случаях) и консервативная миомэктомия (в 31 случае). Исследование проводилось в период с ноября 2015 года по сентябрь 2016 года на базе ГБУЗ ЯО ОПЦ (Областной перинатальный центр). Возраст пациенток составил 40 (34; 45) лет, рост – 164 (162; 168) см, масса тела – 64 (57; 70) кг, продолжительность оперативных вмешательств – 165 (137,5; 210) минут.
Методика анестезии и послеоперационного обезболивания была стадартной и состояла в следующем. Премедикация на операционном столе включала в себя внутривенное введение атропина в дозе 10 мкг/кг, тримеперидина 0,3 мг/кг и диазепама 0,15 мг/кг. Индукция проводилась пропофолом в дозе 2 мг/кг, миорелаксация – рокуронием 0,5 мг/кг. Выполнялась интубация трахеи, начиналась искусственная вентиляция легких c поддержанием нормокапнии под контролем EtCO2, анестезия поддерживалась севофлюраном по методике низкопоточной анестезии и болюсным введением фентанила и рокурония. После окончания операции и анестезии пациентки переводились в отделение интенсивной терапии. В течение первых суток после операции схема послеоперационного обезболивания также была стандартной и включала в себя внутримышечные инъекции трамадола по 100 мг каждые 6 часов и кеторолака по 30 мг каждые 8 часов.
В послеоперационном периоде проводился мониторинг показателей гемодинамики и пульсоксиметрии. Каждые 3 часа оценивалась интенсивность боли по 100-миллиметровой визуально-аналоговой шкале (ВАШ) в покое и при активизации пациенток, степень седации по шкале оценки возбуждения – седации Richmond (RASS) и выраженность послеоперационной тошноты и рвоты (0 – отсутствие симптомов, 1 – тошнота, 2 – рвота). Для оценки состояния вегетативной нервной системы использовался метод кардиоинтервалографии по Р.М. Баевскому с помощью аппарата ВНС-Ритм (Нейрософт, Россия) с автоматической записью и анализом электрокардиограммы. Регистрировались показатели частоты сердечных сокращений, моды (Мо), амплитуды моды (АМо), вариационного размаха (DX) и индекса напряжения (ИН) в 18 часов накануне оперативного вмешательства и в день операции.
Определение генотипа проводилось из образцов цельной крови с ЭДТА методом полимеразной цепной реакции в реальном времени с помощью детектирующего амплификатора DTlite (ДНК-технология, Россия) и наборов реагентов для определения полиморфизма C100T и полиморфизма G1846A гена CYP2D6 (Синтол, Россия).
Полученные результаты подвергались статистической обработке пакетами программ MicrosoftExcel 2013 (MicrosoftCorp, США) и Statistica 8.0 (StatSoftInc, США); вычислялись медиана (Ме) и интерквартильный размах (LQ; UQ), для сравнения групп использовались методы непараметрической статистики: для количественных признаков – U-критерий Манна – Уитни, для качественных – точный критерий Фишера. Критический уровень значимости р во всех расчетах был принят равным 0,05.
Результаты и обсуждение
При исследовании гена CYP2D6 у 13 пациенток был выявлен гетерозиготный полиморфизм G1846A (замена гуаниа на аденин в позиции 1846), полиморфизм C100T (замена цитозина на тимин в позиции 100) был обнаружен у 1 пациентки в гомозиготном (Т/Т) и у 1 – в гетерозиготном (С/Т) варианте.
В зависимости от наличия / отсутствия указанных полиморфизмов пациентки были разделены на 2 группы: 1-ю группу составили 33 пациентки без полиморфизмов («дикий» тип), 2-ю – 15 пациенток с полиморфизмами гена CYP2D6.
Между группами пациенток не было выявлено различий в антропометрических данных, видах и продолжительности оперативных вмешательств (таблица 1).
Таблица 1
Исходные характеристики пациенток
|
1 группа (n = 33) |
2 группа (n = 15) |
р |
|
|
Возраст, лет |
39,5 (33,5; 44,5) |
40,5 (35; 45) |
0,87 |
|
Рост, см |
165 (160; 170) |
164 (163; 168) |
0,85 |
|
Масса тела, кг |
64 (58; 70) |
67 (53; 79) |
0,96 |
|
Вид операции (гистерэктомия / миомэктомия) |
12 / 21 |
5 / 10 |
0,55 |
|
Длительность операции, мин. |
165 (140; 210) |
180 (160; 210) |
0,39 |
В целом послеоперационное обезболивание было достаточно адекватным, интенсивность послеоперационного болевого синдрома находилась в пределах допустимого [2]. Вместе с тем, при оценке интенсивности боли в покое были выявлены значимые отличия между группами: она была выше у пациенток с полиморфизмами гена CYP2D6 как вечером в день операции, так и на следующее утро (рисунок 1).
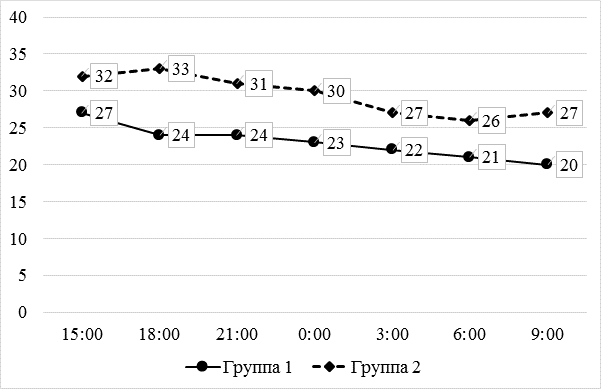
* – p<0,05 по сравнению с 1-й группой (U-критерий Манна – Уитни).
Рис. 1. Динамика интенсивности боли (мм ВАШ) в покое
Схожая картина наблюдалась и при оценке интенсивности болевых ощущений при активизации пациенток (рисунок 2), хотя различия по данному показателю были менее значимы как математически, так и статистически.
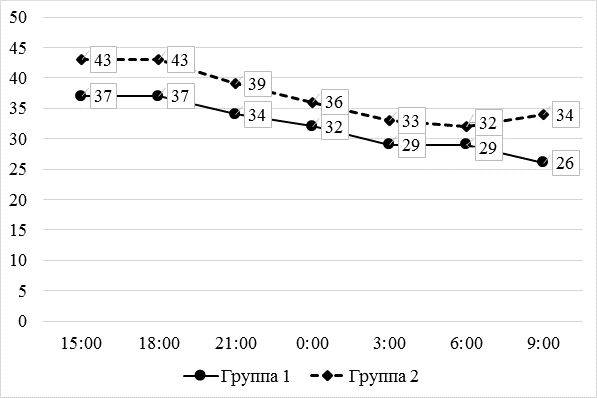
* – p< 0,05 по сравнению с 1-й группой (U-критерий Манна – Уитни).
Рис. 2. Динамика интенсивности боли (мм ВАШ) при активизации
Между группами не было выявлено статистически значимых различий в частоте и выраженности побочных эффектов наркотических анальгетиков. Уровень седации по RASS у большинства пациенток находился на уровне от -1 до 0. Послеоперационная тошнота и рвота несколько чаще встречалась у пациенток без исследованных полиморфизмов гена CYP2D6. Тошнота отмечена у 39 % пациенток первой группы и у 27 % – второй, рвота – соответственно у 18 % и 7 %, однако значимость различий не достигла критического уровня.
При оценке показателей вариабельности сердечного ритма исходных различий между группами зафиксировано не было (таблица 2).
Таблица 2
Показатели вариабельности сердечного ритма
|
Показатель |
18:00 накануне операции |
18:00 в день операции |
||||
|
1-я |
2-я |
р (1 – 2) |
1-я |
2-я |
р (1 – 2) |
|
|
Мо, мс |
780 (670;840) |
750 (640; 800) |
0,327 |
720 (650; 750) |
640 (600; 680) |
0,034 |
|
АМо, % |
48 (38; 58) |
48 (42; 56) |
0,878 |
45 (41; 55) |
54 (52,5; 64,7) |
0,025 |
|
DX, мс |
160 (140; 180) |
174 (140; 210) |
0,241 |
198 (157; 250) |
161 (120; 200) |
0,052 |
|
ИН, ед. |
193 (146; 277) |
176 (150; 258) |
0,843 |
168 (129; 259) |
255 (210; 451) |
0,016 |
В послеоперационном периоде у пациенток 2-й группы отмечены значимо более высокие показатели амплитуды моды и индекса напряжения и низкие значения моды и, что может свидетельствовать о более выраженной симпатикотонии, возможно, на фоне недостаточно адекватной анальгезии.
Заключение
Частота встречаемости полиморфизмов С100T и G1846A гена CYP2D6 изофермента цитохрома Р-450, участвующего в биотрансформации трамадола, может достигать 30 %. Наличие у пациенток указанных полиморфизмов снижает эффективность послеоперационной анальгезии при крупных эндоскопических вмешательствах в гинекологии, что сопровождается более выраженной симпатикотонией. Одновременно у данных пациенток наблюдается тенденция и к снижению частоты послеоперационной тошноты и рвоты. Полученные данные могут использоваться для выбора персонализированных схем послеоперационной анальгезии, основанных на анализе генетических особенностей пациентов.
Библиографическая ссылка
Соколов Д.А., Любошевский П.А., Левшин Н.Ю., Жемчугов А.В., Куликов М.А. ЭФФЕКТЫ ТРАМАДОЛА ПРИ ПОСЛЕОПЕРАЦИОННОМ ОБЕЗБОЛИВАНИИ В ГИНЕКОЛОГИИ – ФАРМАКОГЕНЕТИЧЕСКИЙ АСПЕКТ // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25780 (дата обращения: 24.02.2026).
DOI: https://doi.org/10.17513/spno.25780



