Анализ черноморских прибрежных вод последних десятилетий свидетельствует о том, что концентрация кадмия, свинца, меди, цинка и других ионов тяжелых металлов в результате работы промышленных предприятий и сельскохозяйственной деятельности постоянно растет [4, 5]. Особую опасность в этой связи представляют ионы двухвалентного кадмия (Cd2+). Опасность ионов Cd2+ заключается в том, что их атомный радиус практически полностью совпадает с радиусом ионов двухвалентного кальция (Ca2+) [16]. Поэтому кадмий, «маскируясь» под кальций, который является важнейшим регулятором многих внутриклеточных процессов, осуществляет свое разрушающее, токсическое воздействие, вызывает гибель клеток, тканей и организма в целом. Не менее токсичным воздействием наделены ионы свинца (Pb2+), которые быстро аккумулируются в организме и вызывают деструкцию мембран клеток, нарушают работу ферментов, приводят к тканевой дисфункции и в конечном итоге к гибели организма. В этой связи способность осуществлять мониторинг состояния прибрежной морской акватории принадлежит гидробионтам, которые постоянно обитают в этой зоне моря, не совершая миграционных перемещений. В этом отношении выбор оседлых видов моллюсков и малоподвижных рыб является удачным сочетанием, способным объективно отражать состояние среды. Для моллюсков, достаточно толерантных к тяжелым металлам и способных накапливать их в своих тканях [3, 8, 9], этот период определяется их возрастным статусом. Для оценки состояния прибрежной акватории моря мы исследовали накопление катионов четырех тяжелых металлов, таких как Cd2+, Pb2+, Cu2+, Zn2+, у полуторагодовалых мидий (Mytilus galloprovincialis Lamark) и гигантских устриц (Crassostrea gigas Thunberg), недавно интродуцированных в Черноморском регионе [15].
Для прибрежных рыб, менее толерантных к действию поллютантов, влияние того или иного токсиканта точнее исследовать в экспериментальных условиях, где можно вычленить влияние именно этого фактора, с последующей возможностью экстраполяции полученных результатов на натурные объекты [11]. Для этого мы изучали воздействие Cd2+ и Pb2+ на проницаемость эритроцитов скорпены для одновалентных катионов Na+ и K+. Как известно, внутриклеточное содержание K+ является важнейшим показателем «благополучия» клетки. Калий в клетке осуществляет поддержание осмотического давления и кислотно-щелочного равновесия; участвует в ферментативных реакциях, т.е. необходим для синтеза протеинов (на 1 г синтезированного протеина требуется 20 мг К+), АТФ, гликогена; принимает участие в формировании потенциала покоя, действия, вызывает конформационные перестройки протеинов, способствуя активации ферментов. Калий вместе с натрием участвует в создании на мембране электрохимического потенциала [10]. Поэтому в основные задачи настоящего исследования входило определение содержания некоторых тяжелых металлов в тканях двух видов двухстворчатых моллюсков и исследование перераспределения Na+ и K+ в эритроцитах придонной костистой рыбы скорпены при воздействии различных концентраций ионов Cd2+ и Pb2+.
Материал и методы
Объектами исследования были моллюски – средиземноморская мидия (Mytilus galloprovincialis Lamark) и дальневосточная устрица (Crassostrea gigas Thunberg), а также костистая рыба – скорпена (Scorpaena porcus Linnaeus) – донный малоподвижный, устойчивый к дефициту кислорода вид. Для исследования накопления тяжелых металлов в мягких тканях моллюсков животных в возрасте 1,5 года отбирали с коллекторов, установленных в море на глубине 17–20 м, в зимнее время (декабрь). Рыб отлавливали ставным неводом и дифоном в районе Карадага — восточного побережья Крыма — в весенне-летний (май–июнь) период. Перед опытом рыб в течение суток выдерживали без кормления в бассейнах с проточной морской водой при температуре от +18 до +20оС.
Исследование накопления тяжелых металлов в мягких тканях моллюсков
Для анализа с коллекторов, выставленных в Карадагской бухте, отбирали по 12 экз. одноразмерных 1,5–2-годовалых животных: мидий весом в 25–30 г и устриц весом в 60–70 г. Навески мягких тканей осушали бумажными фильтрами и доводили при 50–60оС в термостате до постоянного веса. Определение содержания тяжелых металлов в тканях моллюсков проводили в измерительной лаборатории завода «Море» (пгт. Приморский, г. Феодосия). Содержание тяжелых металлов в мягких тканях моллюсков (мг/кг) определяли на атомно-абсорбционном спектрофотометре AAS–1 (Австрия) в пламени пропан-бутан после обработки проб методом «мокрого» озоления в смеси азотной и хлорной кислот [12].
Приготовление клеточных суспензий эритроцитов скорпены
Пробы крови скорпены получали пункцией хвостовой артерии стеклянной пипеткой и вносили в охлажденную стандартную среду, содержащую гепарин. Эритроциты отделяли центрифугированием (1800 g, 10 мин, 4оС), надосадочную жидкость и верхний слой клеток удаляли, а оставшиеся клетки промывали этим же раствором трижды. Стандартная среда имела следующий состав в мМ: 180 NaCl, 10 трис-HCl, (pH 7,4 при 20оС). Суспензию эритроцитов в этой среде (30–40%) сохраняли при 4оС и использовали в течение 1–2 ч, гематокрит определяли на гематокритной центрифуге.
Определение содержания ионов натрия и калия в эритроцитах скорпены
Для исследования транспорта ионов клетки инкубировали при 20оС в ультратермостате МК–70 (Германия). Суспензию эритроцитов добавляли к инкубационным средам до конечного гематокрита 1–2%. Стандартная инкубационная среда дополнительно содержала 10 мМ глюкозы. В опытах по воздействию ионов кадмия концентрация CdCl2 составляла в инкубационной среде 20 мкМ и 200 мкМ, а продолжительность инкубации клеток — 2 ч. Концентрация Pb(NO3)2 в инкубационной среде составляла 1, 2, 5, 10, 20 и 50 мкМ, время инкубации — 20 мин. После инкубации клеточную суспензию центрифугировали (1800g, 1 мин, 4оС), среду удаляли, эритроциты дважды промывали холодным отмывочным раствором. Отмывочный раствор имел следующий состав, мМ: 120 MgCl2, 10 трис-HCl (pH 7,4 при 4оС). Отмытые клетки лизировали бидистиллированной водой, в лизатах определяли концентрацию ионов калия и натрия на пламенном фотометре. Концентрацию ионов рассчитывали в ммоль на 1 литр упакованных клеток (ммоль/л).
Все полученные данные обработаны статистически и представлены в виде средней ± стандартная ошибка 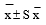 [14].
[14].
Результаты и обсуждение
Содержание тяжелых металлов в мягких тканях гигантской устрицы и средиземноморской мидии
Мидии и устрицы по способу питания являются активными фильтраторами. Как и другие двустворчатые моллюски, они питаются взвешенным в толще воды детритом (мельчайшими остатками отмерших растений и животных) и микропланктоном (одноклеточными водорослями, бактериями и очень мелкими животными). Двустворчатые моллюски профильтровывают очень большие объемы воды. Так, гигантская устрица массой в 60 г может профильтровать за 1 ч около 10 л воды, или 87,6 м3 в год [7]. За год одна мидия массой в 2 г при средней концентрации взвеси 5 мг/л-1 профильтровывает 2,8 м3, массой в 10 г – 5,8 м3 и весом в 30 г – 9,8 м3 воды. Образуя плотные скопления на прибрежных камнях (банках), мидии и устрицы могут профильтровать за сутки от 50 до 280 м3 воды на 1 м2 популяции [17]. Таким образом, большие поселения моллюсков представляют собой мощный биофильтр, всасывающий из окружающей воды большое количество взвеси, как минеральной, так и органической [18]. Мидии и устрицы являются перспективными объектами прибрежной марикультуры [15]. В этой связи исследование содержания тяжелых металлов в мягких тканях этих видов моллюсков имело вполне прикладной аспект. Изучение содержания тяжелых металлов осуществлялось в мягких тканях 1,5–2-летних мидий и устриц, взятых с коллекторов в зимний период. Результаты этих исследований представлены в таблице 1.
Таблица 1
Содержание тяжелых металлов в мягких тканях мидий (M. galloprovincialis) и дальневосточной устрицы (С. gigas) (в мг/кг сырого веса ткани), находящихся на коллекторах в море
|
Вид |
медь |
цинк |
свинец |
кадмий |
|
C.gigas |
79,2 ± 5,4 |
227,9 ± 10,8 |
0,09 ± 0,01 |
0,8 ± 0,03 |
|
M.galloprovincialis |
0,04 ± 0,01 |
24,1 ± 3,6 |
0,2 ± 0,02 |
0,3 ± 0,02 |
|
|
30,0* |
200,0* |
10,0* |
2,0* |
Примечание: * — предельно допустимые концентрации (ПДК) в морской воде для тяжелых металлов по ГОСТ – 26931-86; число исследованных животных в каждой серии опытов составляло 10–12 особей.
Полученные результаты показали, что содержание свинца и кадмия в тканях исследованных видов было незначительным и много ниже установленных уровней ПДК. Как известно, мидии относятся к организмам, способным быстро и в больших количествах накапливать кадмий и другие тяжелые металлы. Так, было показано, что 3-суточное содержание беломорской мидии (Mytilus edulis) в аквариумах с 500 мкг/л CdCl2 приводило к 30-кратному увеличению концентрации поллютанта в мягких тканях моллюска [3]. Поэтому полученные нами результаты по содержанию этих тяжелых металлов в тканях моллюсков свидетельствовали об относительной чистоте среды их обитания. Кроме того, в наших исследованиях был получен результат значительного накопления устрицами меди и цинка. Так, в тканях устрицы содержание меди в 2,6 раза превышало установленную ГОСТом ПДК и было выше в 2000 раз, чем в тканях мидии. Концентрация цинка у устриц практически совпадала с ПДК и была на порядок выше, чем содержание этого элемента в мягких тканях исследованных мидий (табл. 1).
Ранее было показано, что устрицы по сравнению с мидиями имеют высокую эффективность ассимиляции и медленное выведение из организма металлов [21]. Возможно, этим и объясняются различия в содержании этих металлов в исследуемых моллюсках. Кроме этого, устрицы уже давно известны как медийно-цинковые концентраторы, способные в норме накапливать огромные количества этих металлов [2]. Наши данные по содержанию цинка сопоставимы с данными, полученными по накоплению этого металла гигантскими устрицами из Амурского залива, которое составило 875–1262 мг/ кг сухого веса ткани [8]. Диапазон концентрации меди в устрицах из Уссурийского залива колебался в пределах 79–135 мг/кг сухого веса ткани [9], что также соответствовало нашим результатам по накоплению этого поллютанта в тканях моллюска. Причины столь высокой избирательности накопления цинка и меди в тканях моллюсков неясны. На наш взгляд, существенное различие по содержанию меди и цинка в тканях исследованных моллюсков кроется в различной «востребованности» этими видами указанных двухвалентных ионов. Медь и цинк входят в металлопротеиновые комплексы большого числа ферментов и белков гемолимфы. Возможно, потребности в этих металлах можно связать также с высокой репродуктивной способностью моллюсков. Так, одна женская особь C. gigas во время нереста способна выметать в среду за несколько часов до 100 млн яйцеклеток, а одна мужская – до 500 млн сперматозоидов. Плодовитость мидий тоже достаточно велика и оценивается в несколько миллионов яйцеклеток за один нерестовый цикл [7]. Как мы полагаем, накопление меди и цинка у устриц и цинка у мидий обусловлено биохимическими потребностями их организма.
Таким образом, несмотря на ухудшение состояния морской среды, в районе Карадага полученное нами низкое накопление кадмия и свинца (табл. 1) мидиями и устрицами (с учетом их высокой способности к накоплению меди и цинка) не свидетельствует о драматическом характере загрязнений прибрежной акватории заповедника. Эти показатели могут быть надежными тестами в пользу развития в регионе марикультурных хозяйств.
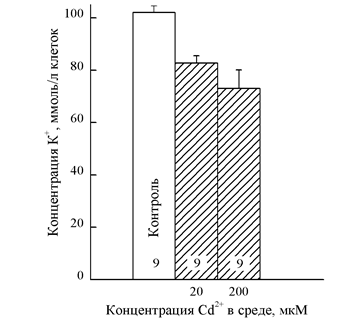
Рис. 1. Снижение концентрации K+ в эритроцитах под влиянием Cd2+. Цифры внутри столбиков показывают число измерений. Все величины, полученные в присутствии Cd2+, достоверно отличаются от контроля (p < 0,01). Влияние Cd2+ и Pb2+ на транспорт Na+ и K+ в эритроцитах скорпены
В отмытых эритроцитах скорпены перед инкубацией выявились высокое содержание ионов K+ (102 ± 2,5 ммоль/л клеток) и низкая концентрация Na+ (8,9 ± 1,9 ммоль/л клеток). По ионному составу эритроциты скорпены не отличались существенно от красных клеток крови человека [13]. В серии экспериментов по влиянию Cd2+ на транспорт ионов через мембрану эритроцитов скорпены оценивали после двухчасовой инкубации в средах, содержащих 20 мкМ и 200 мкМ токсиканта (рис. 1).
Как видно из представленных данных, Cd2+ значительно стимулировал потерю K+ из эритроцитов. На эритроцитах человека показано, что Cd2+ может транспортироваться внутрь клетки, но данные о нарушении транспорта одновалентных катионов отсутствуют [20]. Снижение внутриклеточной концентрации K+ после 2-часовой инкубации эритроцитов скорпены в среде с Cd2+ было значительным. При концентрации Cd2+ в 20 мкМ это падение составляло 19% от исходного уровня, а при концентрации Cd2+ в 200 мкМ – 28% (рис. 1). Однако остается не ясным, является ли этот вход открытием специфического ионного канала или обусловлен общим увеличением проницаемости мембраны для К+, вызванным деструктивными действиями Cd2+. Вход Na+ в эритроциты под действием токсического стресса не был значимым при 20 мкМ Cd2+ (14,6 ± 1,8 ммоль/л клеток), а при 200 мкМ Cd2+ — достоверно более высоким по сравнению с контролем (20,9 ± 1,9 ммоль/л клеток).
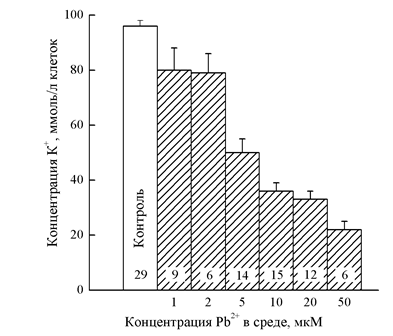
Рис. 2. Снижение концентрации K+ в эритроцитах под влиянием Pb2+. Цифры внутри столбиков показывают число измерений. Все величины, полученные в присутствии Pb2+, достоверно отличаются от контроля (p < 0,01)
Действие ионов Pb2+ на выход K+ из эритроцитов скорпены сходно c действием ионов Cd2+ (рис. 2). Как показали исследования на эритроцитах человека, выход ионов K+ обусловлен способностью ионов Pb2+ вызывать в плазматических мембранах активизацию K+-каналов [22]. В отношении механизма действия ионов Pb2+ на мембрану эритроцитов рыб данные практически отсутствуют. Мы предприняли попытку выявить эту способность на эритроцитах скорпены. Эритроциты скорпены инкубировали в стандартной среде, не содержащей Ca2+, в присутствии различных концентраций Pb2+ в течение 20 мин при 20–22oC. Как видно из рисунка 2, инкубация эритроцитов в средах с низкими концентрациями Pb2+ (1 и 2 мкМ) сопровождалась статистически значимым уменьшением содержания K+ в клетках (в среднем на 17%). При дальнейшем повышении концентрации Pb2+ в среде потери клетками ионов K+ существенно возрастали, достигая 75% от содержания K+ в необработанных эритроцитах. Как и в случае с Cd2+, наблюдали относительно небольшое увеличение внутриклеточной концентрации Na+ при обработке эритроцитов скорпены 5–50 мкМ Pb2+. По сравнению с контрольным уровнем (в этой серии опытов, равной 21,0 ± 5,2 ммоль/л клеток) содержание Na+ возрастало до 25,0 ± 2,1 и 37,2 ± 5,2 ммоль/л клеток в присутствии 5 и 50 мкМ Pb2+ соответственно. Прирост содержания Na+ в эритроцитах составлял только 15% от потерь внеклеточного K+, и суммарное содержание обоих катионов уменьшалось приблизительно на 50% после 20 мин инкубации клеток в присутствии Pb2+. Прямым доказательством открытия ионами Pb2+ в эритроцитах скорпены K+-каналов было использование блокатора этих каналов – хинидина. Хинидин в концентрации 1 мМ полностью блокировал вызываемый ионами Pb2+ выход ионов K+ из эритроцитов скорпены. Полученные нами данные свидетельствуют, что активация K+-каналов ионами Pb2+ происходит в концентрационном диапазоне (1–50 мкМ), близком для эритроцитов человека [19]. Механизм индуцирования каналов остается неясным, хотя нами предполагается, что ионы Pb2+ участвуют в их образовании, т.е. можно говорить о Pb2+-активируемых K+-каналах. По всей вероятности, образование Pb2+-активируемых K+-каналов происходит после проникновения Pb2+ в эритроциты. Известно, что вход Pb2+ в эритроциты человека происходит через анион-транспортные пути в виде отрицательно заряженных комплексов [23]. Возможно, аналогичным образом это происходит и в эритроцитах скорпены, хотя для более точного подтверждения требуются дополнительные исследования.
Способность Cd2+ и Pb2+ вызывать значительные потери K+ эритроцитами имеет далеко идущие последствия, связанные с их морфофункциональными изменениями. Потеря эритроцитами таких количеств K+ может вызывать уменьшение объема клетки, гиперполяризацию мембраны и сдвиг внутриклеточного pH. Исследования на эритроцитах крыс показали, что Cd2+ вызывал снижение диаметра, периметра и площади клеток; увеличение их фазовой высоты, микроцитоз, увеличение интенсивности перекисного окисления липидов и кислотной резистентности клеток; эхиноцитоз и снижение деформируемости клеток, т.е. типичные признаки развития токсической анемии [6]. В эритроцитах сеголеток карпа под действием Cd2+ и Pb2+ происходят уменьшение гемоглобина и эритроцитов в целом, снижение их кислотной резистентности и нарастание анемии [1]. Эти исследования и наши наблюдения убедительно свидетельствуют, что эритроциты рыб могут быть использованы как надежные тест-системы для выявления токсического воздействия тяжелых металлов при мониторинге прибрежной акватории моря.
Заключение
В результате проведенных исследований показано, что превышение уровня (ПДК) Cu2+ и Zn2+ в мягких тканях дальневосточной устрицы не может служить биоиндикатором состояния качества морской среды вследствие накопления этих элементов, обусловленных биохимическими потребностями существования данного вида. Напротив, накопления по кадмию и свинцу у моллюсков могут быть хорошими биомаркерами, которые показали относительную чистоту прибрежной акватории Карадагского заповедника. Эти показатели являются весомыми аргументами в пользу развития в регионе марикультурных хозяйств.
Наши наблюдения и работы других исследователей [19, 22, 23] убедительно свидетельствуют о том, что перераспределение Na+ и K+ в эритроцитах рыб может быть использовано как надежный биоиндикатор для выявления токсического воздействия тяжелых металлов при мониторинге прибрежной акватории моря.
Библиографическая ссылка
Силкина Е.Н., Силкин Ю.А., Силкин М.Ю., Столбов А.Я., Силкина А.Ю. ВЛИЯНИЯ ТЯЖЕЛЫХ МЕТАЛЛОВ НА ФУНКЦИОНАЛЬНЫЕ И БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ МОРСКИХ ГИДРОБИОНТОВ КАК БИОИНДИКАТОРОВ ЭКОЛОГИЧЕСКОГО СОСТОЯНИЯ СРЕДЫ // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25712 (дата обращения: 03.02.2026).



