Норадренергические нейроны области А5 моста моносинаптически связаны с боковыми рогами спинного мозга и дыхательным центром, что обеспечивает их важную роль в регуляции кровообращения и дыхания во время различных афферентных воздействий и физиологических процессов [10]. Во многих исследованиях продемонстрировано, что область А5 моста участвует в регуляции дыхания, кровообращения и симпатической активности при гипоксии [3; 4; 9]. Электрофизиологическими и иммуногистохимическими методами было выявлено, что норадренергические А5 нейроны имеют низкочастотную фоновую активность до 10 Гц и активируются при стимуляции периферических хеморецепторов гипоксией [3; 9]. Также показано, что норадренергические А5 нейроны чувствительны к бароцептивным раздражениям, но слабо или совсем не реагируют на механоноцицептивный стимул [9]. В то же время экспериментально выявлено торможение температурного болевого рефлекса отдергивания хвоста (tail-flick reflex) у крыс при микроинъекции глутамата в область А5 моста [8]. Целью настоящего исследования было: 1) изучение возможной интеграции норадренергическими А5 нейронами афферентации от болевых рецепторов с использованием tail-flick теста, 2) определение периода болевой реакции РДН и АД, который регулируют норадренергические А5 нейроны.
Методика исследования
Во всех проведённых экспериментах придерживались положений Хельсинкской декларации Всемирной медицинской ассоциации и рекомендаций по уходу за животными и экспериментальным процедурам, содержащихся в директивах Европейского союза (86/609/ЕС). Экспериментальные протоколы были утверждены Комитетом по биоэтике Самарского государственного медицинского университета.
Эксперименты были сделаны на 12 белых крысах массой 260–320 г. До исследований животные содержались в виварии Самарского государственного медицинского университета в вентилируемых клетках. В комнате с клетками контролировалась температура не ниже 22 °C и поддерживался цикл искусственного освещения день-ночь (свет с 08.00 до 20.00 часов). Вода и стандартное питание были в свободном доступе.
Операционная подготовка. Анестезия была индуцирована пентобарбиталом натрия (начальная доза 40 мг/кг внутрибрюшинно и при необходимости дополнена 4 мг/кг внутривенно). Катетеры были введены в левую бедренную артерию для измерения артериального давления и левую бедренную вену для введения лекарств. Трахею интубировали ниже гортани. Животные дышали спонтанно атмосферным воздухом. Температура тела измерялась ректально и поддерживалась на уровне 37-38 °C с помощью сервогрелки. Концентрация CO2 в конечной порции выдыхаемого газа контролировалась в ходе эксперимента быстрореагирующим анализатором углекислоты (ГАУ-5; Россия) и варьировала в диапазоне значений от 4 до 5%. Глубина анестезии оценивалась по корнеальному рефлексу и рефлексу отдергивания при щипке лапы, которые поддерживались очень слабыми или отсутствовали в течение эксперимента. Через каждые 15 минут мы проводили контроль этих рефлексов и при необходимости вводили дополнительные дозы анестетика. Голова животного фиксировалась в стереотаксическом аппарате вентральной поверхностью вверх с помощью ушных баров, неповреждающих слуховых перепонок, и планки, фиксирующей верхнюю челюсть. Конечности привязывались к горизонтальному столику, соединенному с сервогрелкой. Для выхода к каудальным вентролатеральным отделам моста перевязывали и пересекали трахею с пищеводом выше трахеостомы и отводили их рострально. Отделяли длинные и вентральные прямые мышцы от костей черепа, с помощью бормашины удаляли крыловидную кость до нужного уровня, вскрывали твёрдую и мягкую мозговые оболочки. Для подхода к правому диафрагмальному нерву экзартикулировали и удаляли ключицу, перевязывали и пересекали подключичную вену вместе с мягкими тканями, под веной в нервном сплетении находили диафрагмальный нерв. Затем его выделяли на протяжении 5-6 мм, заливали смесью силиконового геля и вазелинового масла, периферический конец нерва пересекали и накладывали на биполярные вольфрамовые электроды. Более подробно оперативный подход к вентральной поверхности ствола мозга и диафрагмальному нерву описан в наших предыдущих работах [2; 7].
Регистрация физиологических процессов. Электрическую активность нейронов области А5 отводили внеклеточно стеклянными микроэлектродами, заполненными 2,5 М КСl с диаметром кончика менее 1 мкм и сопротивлением 5-10 МОм. Внеклеточные потенциалы были усилены с помощью усилителя переменного тока (DL 314N-725; Neurobiolab Company; Россия). Анализировали частоту генерации потенциалов действия и длительность реакций нейронов на раздражающие воздействия. АД измеряли в левой бедренной артерии, в которую вводили катетер, заполненный гепарином с физиологическим раствором в соотношении 1:1000. Катетер соединяли с комплексом аппаратуры, состоящей из малогабаритного индукционного датчика давления и полиграфа. Для регистрации РДН использовали усилитель переменного тока (DL 314N-725; Neurobiolab Company; Россия), фильтрацию сигнала производили в диапазоне 0,01-10 kHz. В нейрограммах анализировали длительность РДН, частоту генерации РДН, длительность экспираторной паузы между РДН и общее время дыхательного цикла. Амплитуду РДН оценивали по его интегрированной активности (время интеграции 50 мс). Данные были обработаны с использованием аналого-цифрового преобразователя (L-Card E14-440, FBM Engineering; Россия) и сохранены на жестком диске персонального компьютера при помощи программного обеспечения PowerGraph software (version 3.3. Professional).
Афферентные раздражители. Периферические хеморецепторы стимулировали кратковременной гипоксией (вдыхание N2 в течение 10 с). По данным других исследователей, такая методика проведения гипоксической стимуляции не оказывает влияния на центральные хеморецепторы [9]. Для ноцицептивной стимуляции использовали модель термического раздражения ноцицепторов хвоста (tail-flick тест). Для этого конец хвоста (примерно 1/3 всей длины) погружали в термостатированную ячейку, заполненную водой (52 °С). После первых движений хвоста его вынимали из водной термоячейки и помещали в воздушную термоячейку (37 °С) для восстановления исходной температуры.
Экспериментальный протокол. Для устранения помех от дыхательных движений и пульсации сосудов при регистрации активности нейронов использовали «плавающий» микроманипулятор. Стеклянные микроэлектроды были позиционированы в область A5 моста контрлатерально по отношению к оперированному диафрагмальному нерву в соответствии со стереотаксическим атласом мозга крыс со следующими координатами: от 0,2 до −1,6 мм в рострокаудальном направлении от интерауральной линии, от 2 до 3 мм латеральнее средней линии и от 1 до −0,5 мм в глубину к интерауральной линии. Микроэлектроды погружали в область А5 со стороны вентральной поверхности моста и с шагом 5 мкм зондировали в глубину до 2 мм. Следующие проводки были в пределах исследуемой зоны на расстоянии 200 мкм в рострокаудальном или медиолатеральном направлении. Зарегистрированные клетки в области A5 моста были отнесены нами к норадренергическим A5 нейронам, когда они соответствовали следующим критериям [9]: 1) низкая и стабильная частота разрядов менее 5 Гц; 2) длительность потенциалов действия более 0,6 мс; 3) сильная активация на гипоксический стимул; и 4) соответствие места регистрации клетки координатам расположения группы A5. После того как записанные образцы были отнесены к норадренергическим A5 нейронам, клетки тестировали на ноцицептивный стимул. В ходе экспериментов фиксировались стереотаксические координаты положения кончика микроэлектрода относительно вентральной поверхности моста и интерауральной линии при каждой успешной регистрации нейрона области А5, которые в дальнейшем были использованы для реконструкции локализации клеток по атласу мозга крысы.
Статистическая обработка данных. При нормальном распределении данных (Kolmogorov-Smirnov test and Shapiro-Wilk’s W test) для сравнения параметров АД, РДН, активности А5 нейронов до и после воздействия использовали paired T-test. Для сравнения латентных периодов и длительностей реакций АД, РДН, А5 нейронов применяли unpaired T-test. В других случаях использовали Wilcoxon test and Mann-Whitney U-test. Числовые данные представлены в виде средних величин и ошибок среднего. Изменения средних величин каждого из параметров считались статистически значимыми при Р< 0,05.
Результаты исследования
В серии опытов на 12 крысах была зарегистрирована электрическая активность 32 нейронов области А5 моста с длительностью потенциалов действия более 0,6 мс, у которых во время кратковременной гипоксии происходило увеличение частоты разрядов с 2,3±0,4 до 9,6±1,5 Гц (Р<0,001). Большинство исследованных нами нейронов области А5 моста, чувствительных к гипоксии, были локализованы от уровня нижней границы оливарного комплекса и в глубину до 2 мм от вентральной поверхности мозга. Образцы внеклеточной электрической активности были зарегистрированы в области каудального вентролатерального моста со следующими стереотаксическими координатами: от 0,2 до -1,6 мм в рострокаудальном направлении от интерауральной линии, от 2 до 3 мм латеральнее средней линии и от 1 до -0,5 мм в глубину от интерауральной линии. Активации нейронов области А5 моста во время гипоксии соответствовало увеличение частоты РДН с 38,7±1,0 до 65,9±1,6 Гц, а также рост амплитуды этих разрядов с 16,0±0,6 до 19,2±0,4 относительных единиц (во всех случаях Р < 0,001 by paired t test). Латентный период и длительность реакции на гипоксический стимул РДН (8,5±0,4 и 17,4±0,6 с соответственно) и нейронов зоны А5 (8,3±0,7 и 17,8±0,5 с соответственно) достоверно не отличались между собой. В ответ на гипоксию у крыс возникала гипотензия, латентный период которой составлял 14,2±0,7 с, а время гипотензивной реакции - 35,4±2,9 с. АД во время гипоксии максимально снижалось с 106,2±0,4 до 76,7±0,5 мм рт. ст. (Р < 0,001 by unpaired t test).
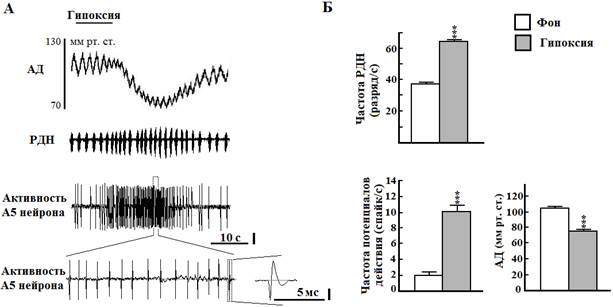
Рис. 1. Влияние кратковременной гипоксии на артериальное давление (АД), разряды диафрагмального нерва (РДН) и активность норадренергического А5 нейрона моста крысы. А - длительность гипоксии 10 с (верхняя линия, ингаляция 100% азота). Вертикальная линия - 50 мкВ. Б - графические данные. *** - Р < 0.001 относительно фона
Все чувствительные к гипоксии нейроны области А5, протестированные на термический болевой стимул (23 из 32 клеток), увеличивали залповую активность с 2,3±0,3 до 11,4±0,5 Гц. Латентный период и длительность реакции А5 нейронов на болевой стимул составили соответственно 3,6±0,2 и 7,6±0,3 с. При болевой стимуляции у крыс увеличивалась частота генерации РДН с 39,0±1,0 до 61,9±1,6 Гц за счёт уменьшения их длительности с 0,46±0,02 до 0,39±0,02 с и экспираторного времени с 1,06±0,01 до 0,84±0,01 с. Амплитуда РДН возрастала с 15,9±0,1 до 18,2±0,2 относительных единиц (во всех случаях Р<0,001 by paired t test). Латентный период респираторной реакции составлял 3,4±0,2 с, а длительность - 7,6±0,3 с и достоверно не отличались от этих же параметров реакции нейронов зоны А5. Болевой стимул также вызывал кратковременное повышение АД с 106,7±0,5 до 129,6±0,4 мм рт. ст. (Р < 0.001 by paired t test). Латентный период гипертензивной реакции составлял 4,45±0,10 с, а её длительность - 25,19±0,27 с, что достоверно отличалось от подобных параметров активности А5 нейронов и РДН (Р<0,001 в обоих случаях by unpaired t test).
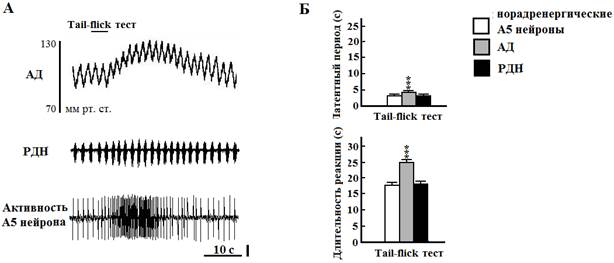
Рис. 2. Влияние термической стимуляции болевых рецепторов на артериальное давление (АД), разряды диафрагмального нерва (РДН) и активность норадренергического А5 нейрона моста крысы. А - длительность болевого стимула (верхняя линия, tail-flick тест). Вертикальная линия - 50 мкВ. Б - графические данные. *** - Р < 0.001 относительно РДН и норадренергических А5 нейронов
Обсуждение
В нашей работе продемонстрировано, что в ретикулярной формации каудального вентролатерального моста/А5 область у взрослых крыс локализованы нейроны, активировавшиеся на гипоксию, с низкой регулярной частотой разрядов и длительностью потенциалов действия более 0,6 мс. Данные свойства и местоположение позволяют с большой вероятностью отнести эти клетки к норадренергическим [9]. У взрослых крыс микроинъекция глутамата в область А5 моста достоверно увеличивала время (tail-flick reflex) болевого рефлекса отдергивания хвоста [8]. Также существуют анатомические данные, указывающие на участие нейронов зоны А5 в механизмах ноцицепции. Показано, что аксоны норадренергических А5 клеток имеют проекции в задние рога спинного мозга, структуры которых принимают участие в механизмах ноцицепции [10]. В то же время другие исследователи выявили лишь слабые реакции норадренергических А5 нейронов на механоноцицептивную стимуляцию [9]. В проведённых нами опытах все норадренергические А5 нейроны, протестированные на термический болевой стимул (tail-flick тест), сильно увеличивали залповую активность (в 5-6 раз), так же как при гипоксии. Это показывает важную физиологическую роль норадренергических А5 клеток в механизмах регуляции вегетативных функций при боли. Мы предполагаем, что высокая чувствительность норадренергических А5 нейронов к болевым раздражителям является часто встречающимся или постоянным их свойством, как и чувствительность к гипоксии. Возможно, что такая разница в реакциях норадренергических А5 клеток на механо- и термоноцицептивный стимулы связана с тем, что щипок лапы (механоноцицептивный стимул) действует очень кратковременно и не избирательно раздражает различные типы рецепторов поверхностной и глубокой чувствительности.
В наших предыдущих исследованиях [6] было выявлено, что после блокады НМДА-рецепторов в области А5 моста болевой стимул вызывал меньшее повышение АД и большее увеличение частоты РДН у анестезированных крыс. Также мы показали, что нейроны зоны А5 регулируют АД и активность дыхательного центра при участии ГАМК и оксида азота [2; 5]. Воздействие L-глутаматом на тела нейронов области А5 моста вызывало повышение АД и увеличение времени экспирации у крыс, что свидетельствует о тормозном влиянии А5 нейронов на дыхательный генератор и активирующем влиянии на симпатический тонус. В настоящем исследовании выявлено, что латентный период и длительность ответной реакции норадренергических А5 нейронов и РДН на ноцицептивную стимуляцию достоверно не отличались между собой. Это показывает, что норадренергические А5 нейроны активируются во время болевого стимулов одновременно с дыхательным центром и оказывают своё тормозное влияние за счёт моносинаптических связей с каудальным отделом вентральной дыхательной группы в течение всего периода действия болевого раздражителя. Также норадренергические А5 нейроны были активны в первую половину болевой реакции АД (фаза подъема), что свидетельствует о контроле норадренергическими А5 клетками периода повышения АД при ноцицептивной стимуляции.
Библиографическая ссылка
Пятин В.Ф., Татарников В.С., Глазкова Е.Н., Широлапов И.В. РОЛЬ НОРАДРЕНЕРГИЧЕСКИХ А5 НЕЙРОНОВ МОСТА В РЕГУЛЯЦИИ РЕАКЦИИ ДЫХАНИЯ И АРТЕРИАЛЬНОГО ДАВЛЕНИЯ НА БОЛЕВОЙ СТИМУЛ У КРЫС // Современные проблемы науки и образования. 2016. № 3. ;URL: https://science-education.ru/ru/article/view?id=24474 (дата обращения: 16.02.2026).



