В составе хроматина, кроме белков, обнаружены фосфолипиды и нейтральные липиды. Причем состав липидов хроматина отличается по качественному и количественному составу от липидов ядерных мембран и изменяется при изменении функционального статуса хроматина [3,4,5]. В настоящее время показано, что взаимодействие с нуклеотидными последовательностями хроматина различных химических соединений, в частности низкомолекулярных веществ (липидов, ионов металлов, биологически активных веществ) играет важнейшую роль в регуляции функциональной активности ДНК, реализуемой в различных генетических процессах (репликации, транскрипции, репарации, рекомбинации) [3,4].
По-видимому, изменение липидного состава может выступать в качестве одного из механизмов регуляции генной экспрессии, основанной на динамичности конформации ДНК, определяемой не только белками, но и липидами. В связи с этим актуальной задачей является поиск регуляторных молекул, способных взаимодействовать с нуклеотидными последовательностями ДНК и изменять функциональную активность генов и других структурных элементов ДНК.
В настоящем исследовании с помощью биоинформатического подхода и метода компьютерного моделирования изучена способность холестерина взаимодействовать с ДНК и экспериментально оценены некоторые возможные функциональные последствия образования подобного молекулярного комплекса.
Материалы и методы исследования. Молекулярную динамику взаимодействия холестерина с олигонуклеотидной последовательностью регуляторно-промоторной области гена р53 человека (http://www.ncbi.nlm.nih.gov) проводили с помощью программы HyperChem 7.0, расчеты проводили методом молекулярной механики Mm+.
Выделение ДНК проводили согласно методике Laura-LeeBoodram с небольшими модификациями [6].
Амплификацию фрагмента ДНК размером 152 п.н., содержащего сайт рестрикции к рестриктазе HinfI, проводили с использованием фланкирующих праймеров: F 5’agcagtctgtctcctccaaa, R 5’cgatatttggatcacatttctg в амплификаторе Veriti. Параметры циклов ПЦР:
1) 95ºС – 180 сек. – 1 цикл;
2) 60ºС – 30 сек.
3) 72ºС – 30 сек. 30 циклов.
4) 95ºС – 20 сек.
Рестрикцию проводили с помощью рестриктазы HinfI, реакционную смесь, содержащую рестриктазу, SE-буферО (50 мМTris-HCl, 10 мМMgCl2, 100 мМNaCl, 1 мМDTT) и ампликоны, инкубировали в течение 1 часа при 37 ºС.
Электрофорез проводили в полиакриламидном геле (36 мл 0,5х TBE, 9 мл 30% PAAG, 250 мклPSA, 40 мклTEMED), содержащем бромистый этидий (0,5 мг/л) при разных значениях pH.
Результаты исследования и их обсуждение. Для обоснования целесообразности исследования влияния холестерина (ХС) на конформацию ДНК нами проведено моделирование взаимодействия ХС с фрагментами ДНК.
Способность ХС к взаимодействию с ДНК оценивалась путем определения энергетически выгодного расположения липида в бороздках В-формы двойной спирали фрагмента ДНК, соответствующей промоторной последовательности гена р53, а также энергии образования комплексов липид-ДНК. Критерием наиболее вероятного связывания ХС с участком молекулы ДНК являлось значение энергии связи. Энергия связи ДНК с ХС определялась как разность полных энергий комплекса ДНК-ХС и изолированных молекул ДНК и ХС. Молекулы ХС, с учетом геометрических особенностей В-формы двойной спирали ДНК, размещались в малой бороздке [1,2].
Ранее показано, что взаимодействие холестерина с ДНК (АТ)5(ТА)5 более сильное, чем с ДНК (ГЦ)5(ГЦ)5 [1].
Нами в компьютерном эксперименте показано, что наиболее предпочтительными сайтами связывания ХС с ДНК являются последовательности: ctAAAaa, agTATct, ttTTAac и некоторые другие (табл. 1).
Таблица 1
Наиболее предпочтительные сайты связывания холестерола с ДНК
|
№ |
Последовательность |
Есвkal/mol |
|
1 |
ctAAAaa |
43.53 |
|
2 |
agTATct |
42.77 |
|
3 |
ttTTAac |
42.54 |
|
4 |
ccAAAat |
42.1 |
|
5 |
taGGGtg |
41.43 |
|
6 |
acCCCaa |
41.3 |
|
7 |
ctGGGct |
41.17 |
|
8 |
agAAAac |
40.76 |
|
9 |
tcGGGct |
40.62 |
|
10 |
aaAAAtg |
40.55 |
|
11 |
gcAAAag |
40.24 |
|
12 |
ttTTCca |
40.1 |
Поскольку наибольшую энергию связи ХС образует в комплексе с тремя нуклеотидами ДНК, то в дальнейших экспериментах молярное соотношение холестерола и анализируемых олигонуклеотидов определялось как 1:3.
Исходя из наличия более или менее предпочтительных сайтов связывания ХС с ДНК, мы выявили наличие этих участков на последовательности гена, включающего область промотора гена р53 (рис. 1).

Рис. 1. Места возможного связывания холестерина с промоторной областью гена р53
Поиск триплетов, обладающих повышенным сродством к определенным последовательностям ДНК, показал, что они распределены по олигонуклеотидной последовательности неравномерно. В частности, в области -48 – -24 промотора гена р53 человека существует последовательность, с которой связывается транскрипционный фактор белка р53 (на рисунке выделено желтым цветом). В этой области не содержится ни одного триплета с характерным фланкированием для предпочтительного связывания с ХС. Всего триплетов с характерным рисунком фланкирования для предпочтительного связывания ХС на фрагменте анализируемого гена длиной 680 нуклеотидов – 14, что является косвенным подтверждением неравномерного распределения липидов в разных локусах ДНК.
В эксперименте изучали взаимодействие ХС с амплифицированным фрагментом ДНК, содержащим сайт рестрикции к рестриктазе HinfI размером 152 п.н. с использованием фланкирующих праймеров: F 5’agcagtctgtctcctccaaa, R 5’cgatatttggatcacatttctg. Данный фрагмент содержал замену нуклеотида в положении gtttg:
аgcagtctgtctcctccaaacagagggtcaccggtttggacttcatccctgggctccatcctgtcctgagtttgtccaagatggaccagaccctggcgatctaccaacagatcctcaccagtctgccttccagaaatgtgatccaaatatcg
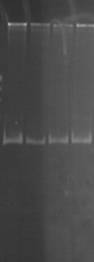
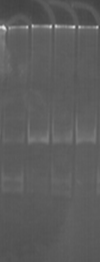
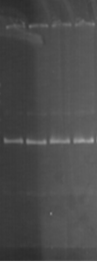
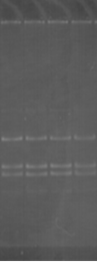
К ампликонам добавляли холестерин в концентрации 1:3, 1:6, 1:9 и инкубировали в течение 60 минут. Для рестрикции данного фрагмента использовали эндонуклеазу HinfI (рис. 2).
Результаты экспериментов свидетельствуют о том, что при рН 8,3 HinfI полностью рестрицирует ампликоны как в контроле, так и при воздействии ХС в различной концентрации (рис. 2А). При увеличении значения рН до 9,4 способность HinfI рестрицировать ампликоны по сравнению с контролем не изменилась, однако в этом случае рестрикция всех образцов ДНК была не полной (рис. 2В). Однако при значениях рН 7,4 по сравнению с контролем способность HinfI рестрицировать ампликоны понижается (рис. 2Б).
|
рН 8,3 |
рН 7,4 |
рН 9,4 |
|||
|
ДНК |
Рестрикт |
ДНК |
Рестрикт |
ДНК |
Рестрикт |
|
К1 2 3 |
К 1 2 3 |
К 1 2 3 |
К 1 2 3 |
К 1 2 3 |
К 1 2 3 |

А Б В
Рис. 2. Электрофореграмма геля с ДНК и рестриктами
(К – контроль (проба без холестерина); 1 – соотношение ДНК:ХС – 1:3; 2 – соотношение ДНК:ХС – 1:6; 3 – соотношение ДНК:ХС – 1:9)
Таким образом, рестриктаза режет комплекс ДНК-ХС по сайтам рестрикции с разной эффективностью в слабощелочной и сильнощелочной средах.
По-видимому, при снижении величины отрицательного заряда ДНК, сродство ХС к олигонуклеотидам ДНК возрастает, а образующийся устойчивый комплекс ДНК-ХС подвергается рестрикции в меньшей степени. При смещении рН в щелочную область величина отрицательного заряда олигонуклеотидов возрастает, вследствие чего сродство ХС к ДНК уменьшается.
Известно, что при действии повышенных температур в щелочной среде ДНК начинает разворачиваться, расплетаться. В клетке хроматиновая ДНК тоже локально расплетается при генетических процессах, в результате чего изменяется величина отрицательного заряда, что может выступать фактором изменения сродства биомолекул, в частности, холестерина к определенным нуклеотидным последовательностям и играть регуляторную роль, по крайней мере, изменяя чувствительность к действию ферментов, в том числе к нуклеазам.
Рецензенты:Ерофеев В.И., д.б.н., профессор, проректор по учебной и методической работе ФГБОУ ДПОС «Мордовский институт переподготовки кадров агробизнеса», г. Саранск;
Шубина О.С., д.б.н., профессор, зав. кафедрой биологии, географии и методик обучения ФГБОУ ВПО «МГПИ им. М.Е. Евсевьева», г. Саранск.
Библиографическая ссылка
Сидоров Д.И., Трофимов В.А. ТЕОРЕТИЧЕСКОЕ И ЭКСПЕРИМЕНТАЛЬНОЕ ОБОСНОВАНИЕ ВЛИЯНИЯ ХОЛЕСТЕРИНА НА ФУНКЦИОНАЛЬНУЮ АКТИВНОСТЬ ДНК // Современные проблемы науки и образования. 2015. № 6. ;URL: https://science-education.ru/ru/article/view?id=23194 (дата обращения: 06.01.2026).



