Развитие медицинской науки, в особенности в области биокомпозитных материалов, позволило эффективно использовать полиметилметакрилат в качестве матрицы для создания длительно-существующего депо антибиотика, что сразу нашло широкое распространение в лечении гнойно-воспалительных заболеваний опорно-двигательной системы, в частности – глубокой перипротезной инфекции [1; 4; 6]. Наиболее широкое применение в качестве антимикробного агента в составе спейсеров получили лекарственные химиопрепараты (гентамицин, ванкомицин и тобрамицин, реже цефалоспорины, другие аминогликозиды и пенициллины). Предпринимаются попытки внедрить в состав ПММА антисептики или частицы галогенов, металлов, обладающих антимикробной активностью, но эти работы пока единичны [2; 7; 9; 10].
Учитывая данные о том, что эллюция антибиотика происходит только из поверхностных слоев ПММА, а значит, распределенное по всему объему действующее вещество остается интактным в отношении патогенных микроорганизмов и не выполняет свою основную функцию [5], нам представляется перспективным разработка покрытий, способных сочетать бактерицидные и бактериостатические свойства наравне с высокой степенью биосовместимости с тканями организма.
Синтетический чистый гидроксиапатит, (Сa10(PO4)6(OH)2), является неорганическим основным компонентом костной ткани, разрешенным для нанесения на хирургические имплантаты. Материал инертен к тканям человека, малотоксичен и при его применении не наблюдается побочных явлений (воспаления, аллергии, мутагенного действия). Регулируя обмен кальция и фосфора, является матриксом костных тканей с неорганической природой, усиливает пролиферацию остеобластов и ускоряет процесс репаративного остеогенеза в месте его введения [3; 8].
Цель исследования. Исследовать in vitro антимикробные свойства покрытий на основе гидроксиапатита и наночастиц различных металлов по отношению к выделенным у больных с глубокой перипротезной инфекцией коленного сустава штаммам Staphylococcus aureus.
Материалы и методы. В качестве экспериментальных образцов применялся порошок гидроксиаппатита с добавлением наночастиц металлов. Синтез замещенных порошков (степень замещения до 20%) проводился методом осаждения из водных растворов по реакции при комнатной температуре t = 20º С и влажности воздуха 58%, pH раствора поддерживался на уровне 9-12. Полученный в результате синтеза осадок оставляли на созревание на 24 часа в химическом стакане, фильтровали и сушили, затем далее в течение 6 часов прокаливали при температуре 600 ºС. Полученный порошок охлаждали при комнатной температуре в течение суток, после чего размалывали в керамической ступе нажатием пестика и выполняли фракционирование с применением сит.
Плазменное напыление полученных порошков производилось на полуавтоматической установке УПН-28 в лаборатории кафедры ФМБИ СГТУ им. Гагарина Ю.А. Покрытие формировалось последовательным нанесением порошка титана (дисперсность до 350 мкм, дистанция напыления 150 мм, ток дуги плазмотрона 350 А) и ГА покрытием и порошка замещенного ГА (дисперсность до 90 мкм, дистанция напыления 50 мм, ток дуги плазмотрона 300 А).
Исследование ИК-спектров, замещенных ГА порошков проводилось с применением Фурье-спектрометра FT-801 в интервале волновых чисел 500…4000 см -1, таблетки с KBr. По итогам анализа ИК-спектров, замещенных ГА установлено, что образцы порошков в основном соответствует образцу синтетического ГА.
На рисунке 1 представлена сканирующая электронная микроскопия плазмонапыленных покрытий на основе порошков, замещенных ГА. На поверхности частиц преимущественно округлой формы имеются скопления наночастиц различных размеров. Так, для напыленных порошков Mg-ГА и Si-ГА выявлены редкие частицы размерами порядка 40-50 нм, собранные в агломераты размерами до 200 нм. Для плазмонапыленных цинк-, медь, сереброзамещенных ГА покрытий характерно большое скопление наночастиц округлой формы размерами около 50 нм.
В качестве основной группы применены комбинации гидроксиаппатита с наночастицами меди, серебра, магния и цинка (№1 - Cu-ГА, №3 – Ag-ГА, №4 – Mg-ГА, №6 – Zn-ГА). В качестве группы сравнения выбраны образцы ГА без примесей (№5) и с включением наночастиц кремния (№2 – Si-ГА), заведомо не обладающие антимикробной активностью. В эксперименте использованы образцы в виде порошка и в виде покрытия, нанесенного на пластины из медицинского титана, размерами 5х5х2 мм.
В качестве основной группы применены комбинации гидроксиаппатита с наночастицами меди, серебра, магния и цинка (№1 - Cu-ГА, №3 – Ag-ГА, №4 – Mg-ГА, №6 – Zn-ГА). В качестве группы сравнения выбраны образцы ГА без примесей (№5) и с включением наночастиц кремния (№2 – Si-ГА), заведомо не обладающие антимикробной активностью. В эксперименте использованы образцы в виде порошка и в виде покрытия, нанесенного на пластины из медицинского титана, размерами 5х5х2 мм.
|
|
|
|
|
А |
Б |
В |
|
|
|
|
|
Г |
Д |
|
Рис.1. Сканирующая электронная микроскопия микроскопия плазмонапыленных покрытий на основе порошков, замещенных ГА: А) Mg-ГА; Б) Zn-ГА; В) Si-ГА; Г) Cu-ГА; Д) Ag-ГА.
Микробиологическое исследование образцов с различными типами напыления проводилось на базе отделения лабораторной диагностики ФГБУ «Саратовский научно-исследовательский институт травматологии и ортопедии» Минздрава России.
Для изучения антимикробных свойств различных типов напыления были получены суточные культуры штаммов Staphylococcus aureus, выделенных от пациентов с инфекционными осложнениями после эндопротезирования крупных суставов.
Полный перечень штаммов микроорганизмов, использованных при исследовании антимикробных свойств образцов приведён в таблице 1.
Таблица 1
Штаммы микроорганизмов, использованных в работе
|
Обозначение |
Название |
Источник получения |
|
ATCC 25923 |
Staphylococcus aureus ATCC 25923 |
Типовой штамм (музейный) |
|
131 |
Staphylococcus aureus 131 |
Раневое отделяемое |
|
139 |
Staphylococcus aureus 139 |
Раневое отделяемое |
|
149 |
Staphylococcus aureus 149 |
Раневое отделяемое |
|
150 |
Staphylococcus aureus 150 |
Раневое отделяемое |
|
161 |
Staphylococcus aureus 161 |
Раневое отделяемое |
|
168 |
Staphylococcus aureus 168 |
Раневое отделяемое |
|
169 |
Staphylococcus aureus 169 |
Раневое отделяемое |
|
173 |
Staphylococcus aureus 173 |
Раневое отделяемое |
|
241 |
Staphylococcus aureus 241 |
Раневое отделяемое |
|
237 |
Staphylococcus aureus 237 |
Раневое отделяемое |
|
237/14 |
Staphylococcus aureus 237/14 |
Раневое отделяемое |
|
237/15 |
Staphylococcus aureus 237/15 |
Раневое отделяемое |
Штаммы стафилококков выращивали на плотных питательных средах
(5%-й кровяной агар «Himedia», Индия) при 37 °С в течение 1-2 суток. Использованные в работе штаммы по морфологическим и культурально-биохимическим свойствам являлись типичными представителями вида Staphylococcus aureus.
Учитывая то, что бактерии рода Staphylococcus относятся к агентам IV группы патогенности, работа с ними проводилась в соответствии с СП 1.3.2322-08 «Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных инфекций».
Определение чувствительности бактерий к антимикробному воздействию образцов с напылением проводили на пластинах агара Мюллер-Хинтон («Himedia», Индия) и в пробирках с сахарным бульоном (МПБ + 0,2 % глюкозы). Для посева на чашки из суточных бактериальных культур готовили бактериальные взвеси в 0,15 М NaСl (pН 7,0). Для стандартизации бактериальных взвесей использовали нефелометр Densi La METER («Erba Lachema», Чехия). Полученные взвеси соответствовали мутности 0,5 по Мак-Фарланду. Перед внесением микроорганизмов в бульон добавляли навеску соответствующего образца (50 мг). После получения суспензии в бульон вносили 100 мкл бактериальной взвеси. Инкубацию проводили при температуре 37 °С в течение 24 часов. В качестве отрицательного контроля использовали пробирки с суспензией образца без добавления бактериальной взвеси.
Аликвоты бактериальных взвесей наносили на поверхность агара и растирали по всей поверхности стерильным L-образным шпателем. Посевы подсушивали и помещали на их поверхность с помощью прокалённого над пламенем спиртовки пинцета образцы титановых пластин и нанесенных на них покрытий ГА с наночастицам различных веществ. В пробирки с сахарным бульоном вносили 0,1 мл суспензии бактерий, куда также помещали образцы.
Чашки и пробирки с образцами помещали в термостат для инкубации при 37°С в течение одних суток. Учёт результатов образцов в виде напыления на титановые пластины производили через 20 - 24 ч путём учёта наличия зоны задержки роста в чашках с агаром и видимого изменения мутности в бульонных культурах. По окончании инкубации для визуализации антибактериальной активности образцов в виде порошка проводили высев из пробирок с бульоном на чашки с 5%-м кровяным агаром. Результаты оценивали через 20 - 24 ч путём учёта различий количества выросших колоний на чашках с агаром.
Результаты. Результаты исследования материалов, напыленных на титановые пластины.
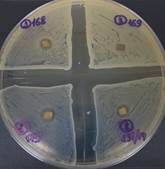
В результате проведённых наблюдений выявлена чувствительность большинства исследуемых штаммов Staphylococcus aureus к антимикробному действию образца с напылением Ag-ГА при росте на плотных питательных средах (рис. 2А), в отношении бульонной культуры подобный эффект не регистрировался. Напыление Zn-ГА в 50% случаев также демонстрировало антибактериальную активность в отношении данных микроорганизмов как при инкубации на агаре, так и в бульоне – визуально отмечалась большая прозрачность бактериальной взвеси с этим образцом по сравнению с другими (рис.2Б).
|
|
|
|
А |
Б |
Рис.2. Примеры антимикробного действия образцов напыления: А) Зоны задержки роста вокруг образцов на среде Мюллер-Хинтон; Б) Суточная бульонная культура (сахарный бульон): визуально – меньшая мутность в пробирке с образцом № 6.
Полученные результаты изучения воздействия образцов с напылением на штаммы золотистого стафилококка отражены в табл. 2.
Таблица 2
Наличие зоны задержки роста
|
|
ОБРАЗЕЦ |
|||||
|
ШТАММ |
№1 Сu-ГА |
№2 Si-ГА |
№3 Ag-ГА |
№4 Mg-ГА |
№5 ГА |
№6 Zn-ГА |
|
S.aureus 139 |
- |
- |
+ |
- |
- |
+ |
|
S.aureus 150 |
- |
- |
+ |
- |
- |
- |
|
S.aureus168 |
- |
- |
+ |
- |
- |
- |
|
S.aureus 169 |
- |
- |
- |
- |
- |
- |
|
S.aureus 173 |
- |
- |
+ |
- |
- |
+ |
|
S.aureus 237/14 |
- |
- |
+ |
- |
- |
+/- |
|
S.aureus 237/15 |
- |
- |
- |
- |
- |
+/- |
|
S.aureus 237/15 (бульонная культура) |
- |
- |
- |
- |
- |
+/- |
|
Отрицательный контроль |
0 |
0 |
0 |
0 |
0 |
0 |
Результаты исследования материалов в виде порошка.
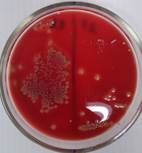
Посевы из пробирок с образцом Ag ГА демонстрировали скудный рост колоний бактерий в сравнении со сплошным ростом на чашках с другими образцами. На основании данного наблюдения можно судить о проявлении антибактериальной активности этого образца в отношении Staphylococcus aureus. На чашках с «отрицательными контролями» роста бактерий выявлено не было (рис. 3).
|
|
|
|
А |
Б |
Рис. 3. Типы роста St. aureus: А) «скудный» - слева, «единичные колонии» - справа; Б) «сплошной рост»
В результате проведённого эксперимента выявлена чувствительность большинства исследуемых штаммов Staphylococcus aureus к антимикробному действию образца с напылением AgГА при росте в сахарном бульоне с суспензией образца.
Полученные результаты изучения воздействия образцов порошков на штаммы золотистого стафилококка отражены в таблице 3.
Таблица 3
Результаты высева на плотные питательные среды бульонной культуры после суточной инкубации с суспензией образца
|
|
Результат (инкубация 24 часа) |
||
|
образец |
|||
|
Штаммы Staphylococcus aureus |
Сu-ГА |
Si-ГА |
Ag-ГА |
|
ATCC 25923 |
сплошной рост |
сплошной рост |
единичные колонии |
|
131 |
сплошной рост |
сплошной рост |
единичные колонии |
|
139 |
сплошной рост |
сплошной рост |
единичные колонии |
|
149 |
сплошной рост |
сплошной рост |
скудный рост |
|
150 |
сплошной рост |
сплошной рост |
единичные колонии |
|
161 |
сплошной рост |
сплошной рост |
единичные колонии |
|
168 |
сплошной рост |
сплошной рост |
единичные колонии |
|
173 |
сплошной рост |
сплошной рост |
скудный рост |
|
241 |
сплошной рост |
сплошной рост |
скудный рост |
|
237 |
сплошной рост |
сплошной рост |
единичные колонии |
|
отрицательный контроль |
отсутствие роста |
отсутствие роста |
отсутствие роста |
|
|
|||
|
|
Результат (инкубация 24 часа) |
||
|
образец |
|||
|
Штаммы Staphylococcus aureus |
Mg-ГА |
Zn-ГА |
ГА |
|
ATCC 25923 |
сплошной рост |
сплошной рост |
сплошной рост |
|
131 |
сплошной рост |
сплошной рост |
сплошной рост |
|
139 |
сплошной рост |
сплошной рост |
сплошной рост |
|
149 |
сплошной рост |
сплошной рост |
сплошной рост |
|
150 |
сплошной рост |
сплошной рост |
сплошной рост |
|
161 |
сплошной рост |
сплошной рост |
сплошной рост |
|
168 |
сплошной рост |
сплошной рост |
сплошной рост |
|
173 |
сплошной рост |
сплошной рост |
сплошной рост |
|
241 |
сплошной рост |
сплошной рост |
сплошной рост |
|
237 |
сплошной рост |
сплошной рост |
сплошной рост |
|
отрицательный контроль |
отсутствие роста |
отсутствие роста |
отсутствие роста |
Заключение. Изготовление принципиально новых конструкций на основе различных материалов с нанесением на их поверхность биокомпозиционных покрытий различной толщины, состава и пористости, способных обеспечить контролируемую доставку антимикробного агента в параимплантарные ткани, является перспективным направлением научно-исследовательской работы, результаты которой найдут применение не только в травматологии и ортопедии.
Решением рассматриваемой проблемы является применение электрофизических (плазменные, лазерные, ультразвуковые, ионно-лучевые) и электрохимических технологий формирования наноструктурированных биокерамических покрытий с заданными структурно-морфологическими и физико-химическими характеристиками. Высокая эффективность полученных материалов в лечении перипротезной инфекции может быть обеспечена импрегнацией пористой структуры сформированной пространственной конструкции активными субстанциями биологического и синтетического происхождения, которые будут доставляться в прилежащие ткани в течение заданного периода времени.
Немаловажное значение имеет создание методологии индивидуального подбора конструкции и структуры поверхности имплантатов для замещения дефектов костной ткани различной этиологии и формы. Помимо этого в составе покрытий могут использоваться металлозамещенные гидроксиапатиты (Cu, Zn и Ag-содержащие) и бемит (минерал из класса гидроокислов с химической формулой γ-AlO(OH)), которые отличаются повышенной бактерицидной активностью. Усиление бактерицидного эффекта также возможно за счет дополнительного введения в состав материала химиопрепарата с направленным антимикробным действием в зависимости от этиологии возбудителя у конкретного пациента.
Не смотря на значительную роль St. aureus и St.epidermidis в развитии иплантат-ассоциированной инфекции, всегда необходима предварительная верификация возбудителя с определением его чувствительности к антибиотикам для определения антимикробного препарата выбора при изготовлении спейсеров, что вместе с дебридментом полости сустава обеспечит эффективную деконтаминацию раны.
Рецензенты:
Павленко Н.Н., д.м.н., ведущий научный сотрудник Отдела инновационных проектов в травматологии и ортопедии ФГБУ «СарНИИТО» Минздрава России, г. Саратов;
Богатов В.Б., д.м.н., старший научный сотрудник Отдела инновационных проектов в травматологии и ортопедии ФГБУ «СарНИИТО» Минздрава России, г. Саратов.
Библиографическая ссылка
Шпиняк С.П., Барабаш А.П., Лясникова А.В., Шунова А.В. ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ АНТИМИКРОБНОЙ АКТИВНОСТИ ГИДРОКСИАППАТИТА И НАНОЧАСТИЦ МЕТАЛЛОВ IN VITRO // Современные проблемы науки и образования. 2015. № 6. ;URL: https://science-education.ru/ru/article/view?id=23099 (дата обращения: 06.01.2026).