Фенольные соединения – обширный класс природных веществ, обладающих различными фармакологическими свойствами. Наиболее важным является их антирадикальное действие, благодаря чему, например, флавоноиды проявляют более 40 видов фармакологической активности. На их основе создан ряд эффективных лекарственных препаратов, применяемых в качестве вазодилататоров [5], гепатопротекторов [3], улучшающих системное кровообращение [2], и др. До сих пор основными источниками получения фенольных соединений являются растения.
Наше внимание привлек кампсис укореняющейся (Campsis radicans L.). Это крупная лиана высотой до 15 м. На Северном Кавказе широко распространена как декоративная культура. В народной медицине Китая применяется при аменорее, диабете, дисменорее, краснухе, маточных кровотечениях и некоторых других заболеваниях [7, 8, 9].
Целью данной работы явилось изучение фенольных соединений надземной части кампсиса укореняющегося на наличие фенольных соединений. Сырье – листья — собирали в сентябре-октябре 2014 г.
Материалы и методы
В исследованиях использовали извлечения, полученные экстракцией воздушно-сухого сырья (листьев) спиртом этиловым 96%-ным, 70%-ным, 40%-ным, а также водой. Каждый раз для экстракции использовали 10,0 г сырья, каждую порцию измельчали до размера частиц 2–3 мм и экстрагировали смесью хлороформ – гексан 1:2 в аппарате «Сокслета» в течение 24 ч с целью удаления хлорофилла и липофильных веществ. Обработанное таким путем сырье сушили в сушильном шкафу при температуре 600С в течение 1,5 ч, после чего переносили в колбу со шлифом вместимостью 100 мл. Заливали соответствующим растворителем и нагревали на кипящей водяной бане в течение 30 мин, кратность экстракции – 3, соотношение сырье : экстрагент – 1:30. Далее полученные извлечения фильтровали через бумажный фильтр и полностью удаляли растворитель до получения сухого остатка. Для испытаний на присутствие катехинов измельченное сырье экстрагировали ацетоном в течение суток. С полученными извлечениями проводили соответствующие качественные реакции. Результаты данных исследований представлены в таблице 1.
Таблица 1
Классы соединений, идентифицированные с помощью качественных реакций
|
Исследуемые соединения |
Реактивы, использованные для идентификации веществ |
Наблюдаемый эффект |
|
Флавоны и флавонолы |
Водный раствор хлорида железа (III) цианидиновая реакция раствор свинца ацетата основного спиртовый раствор хлорида алюминия |
зелено-бурое окрашивание
оранжевое окрашивание желтый осадок
желтая флюоресценция раствора в УФ-свете
|
|
Катехины |
раствор K2S2O8 в конц. серной кислоте
|
красная окраска раствора |
|
Кумарины |
10% раствор NaOH в этаноле, нагревание на водяной бане; |
желтое окрашивание
|
|
Танины |
железоаммониевые квасцы
1%-ный раствор желатина в 10% NaCI хинина сульфат |
черно-сине-зеленое окрашивание (присутствие гидролизуемых и конденсированных дубильных веществ) белая муть
белый осадок |
На основании проведенных предварительных испытаний был сделан вывод о возможном наличии в листьях кампсиса укореняющегося флавоноидов, катехинов, кумаринов и дубильных веществ. Выбор оптимального растворителя, способного извлечь из испытуемого сырья наибольшее количество фенольных соединений, осуществляли при помощи бумажной хроматографии (БХ), для чего использовали бумагу марки «Munktell» (Chrom.-PaperSheets).
Использовались следующие системы: н-бутанол – уксусная кислота – вода — 4:1:2 и 4:1:5, а также 15%-ная и 30%-ная уксусная кислота.
Хроматограммы обрабатывали парами аммиака, 0,1%-ным водным раствором FeCI3, 5%-ным спиртовым раствором AICI3, 5%-ным водным раствором Na2CO3, реактивом Паули по Кутачеку [6]. Просматривали в видимом и УФ-свете до и после обработки соответствующими реагентами. Установлено, что фенольные соединения содержатся во всех исследуемых образцах, но их количество в извлечениях, полученных экстракцией водой и 40%-ным спиртом этиловым, выше, чем в извлечениях, полученных 70%-ным и 96%-ным этанолом. Поэтому в дальнейших исследованиях для извлечения фенольных соединений использовали 40%-ный спирт этиловый [4, 6].
Изучение качественного состава фенольных соединений проводили на высокоэффективном жидкостном хроматографе фирмы «GILSTON» (модель 305, Франция) с ручным инжектором RHEODYNE 7125 (USA). Результаты исследования обрабатывали с помощью программы «Мультихром» для Windows. В качестве неподвижной фазы была использована металлическая колонка размером 4,6х250 мм KROMASILC18, размер частиц 5 микрон, а в качестве подвижной фазы — система «метанол — вода — фосфорная кислота концентрированная» в соотношении 400:600:5. Анализ проводили при комнатной температуре. Скорость подачи элюента 0,8 мл/мин. Продолжительность анализа 60 мин. Детектирование велось с помощью УФ-детектора «GILSTON» UV/VIS, модель 151, при длине волны 254 нм.
Для подготовки пробы 10,0 г сырья экстрагировали 40%-ным этанолом вышеописанным способом. Извлечение выпаривали досуха в выпарительной чашке на кипящей водяной бане и сушили до постоянной массы в сушильном шкафу при температуре, не превышающей 600С.
Навеску экстракта помещали в колбу вместимостью 100 мл, прибавляли 20 мл спирта этилового 70%-ного, присоединяли к обратному холодильнику и нагревали на кипящей водяной бане в течение 1 ч с момента закипания спиртоводной смеси в колбе. После охлаждения смесь фильтровали через бумажный фильтр в мерную колбу объемом 25 мл и доводили спиртом этиловым 70%-ным до метки (раствор А). Параллельно готовили серию 0,05%-ных растворов сравнения в 70%-ном спирте этиловом. В качестве свидетелей использовали: рутин, кверцетин, лютеолин, лютеолин-7-глюкозид, кемпферол, кумарин, гиперозид, геспередин, апигенин, галловую, кофейную, хлорогеновую, неохлорогеновую, коричную, цикориевую, феруловую кислоты, танин, эпикатехин, катехин, нарингенин, дикумарин, дигидрокверцетин.
В хроматограф вводили по 20 мкл исследуемого раствора и растворов сравнения и хроматографировали в вышеприведенных условиях.
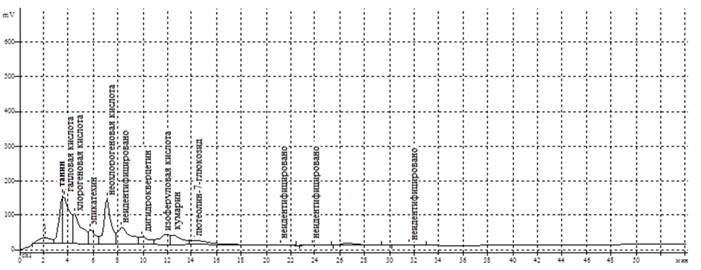
Результаты исследований приведены на рисунке 1 и в таблице 2.
Рис. 1. Хроматограмма ВЭЖХ 40%-ного водно-спиртового извлечения из листьев кампсиса укореняющегося
Таблица 2
Фенольные соединения листьев кампсиса укореняющегося, идентифицированные методом высокоэффективной жидкостной хроматографии
|
Наименование РСО |
Время удерживания, мин |
Количественное соотношение в смеси, % от суммы |
|
хлорогеновая кислота |
4,455 |
13,57 |
|
неохлорогеновая кислота |
7,028 |
17,14 |
|
изоферуловая кислота |
11,86 |
6,14 |
|
галловая кислота |
3,567 |
16,32 |
|
лютеолин-7-глюкозид |
14,10 |
5,96 |
|
дигидрокверцетин |
9,829 |
4,66 |
|
эпикатехин |
5,757 |
5,73 |
|
кумарин |
12,44 |
6,01 |
|
танин |
3,431 |
10,36 |
|
неидентифицированные вещества |
|
|
|
вещество 1 |
8,246 |
11,22 |
|
Вещество 2 |
21,17 |
0,19 |
|
Вещество 3 |
23,78 |
0,43 |
|
Вещество 4 |
31,46 |
0,28 |
Результаты и их обсуждение
Полученные методом ВЭЖХ результаты показали, что извлечение из листьев кампсиса укореняющегося, полученное экстракцией 40%-ным водным этанолом, содержит фенольные соединения, относящиеся к нескольким группам. Прежде всего это гидроксибензойные и гидроксикоричные кислоты. Доля этих веществ в сумме всех фенольных соединений составляет 53,17%. Основными фенолокислотами являются галловая и неохлорогеновая. Флавоноиды представлены гликозидом флавона – лютеолин-7-глюкозидом, катехином – эпикатехином и флаванонолом – дигидрокверцетином. На долю флавоноидов приходится 16,35%. В изучаемом извлечении, кроме вышеперечисленных соединений, идентифицированы танин и кумарин.
Влияние изучаемого извлечения на физическую работоспособность проводили на тест-модели «принудительное плавание». Исследование реализовано на 20 нелинейных мышах-самцах массой 22–25 г, разделенных на 2 равные экспериментальные группы. Первая группа — негативный контроль (НК) (n=10), получала per os 0,9%-ный раствор хлористого натрия в эквиобъемном количестве, вторая группа (n=10) в течение всего периода эксперимента получала per os извлечение из кампсиса укореняющегося (Campsis radicans L.) в дозировке 100 мг/кг. Обе группы мышей в течение 10 дней подвергались физическим нагрузкам в тесте «принудительное плавание до отказа» с 20%-ным отягощением, рассчитанным от массы тела животного [1]. Плавание осуществлялось в цилиндре диаметром 10 см и высотой 30 см с водой температурой 15°С (аверсивная среда). Время плавания фиксировалось.
Результаты опытов обрабатывали методом вариационной статистики с использованием пакета прикладных программ STATISTICA 6.0 (StatSoft, Inc., США для операционной системы Windows). Вычисляли среднее значение и стандартную ошибку среднего значения. Полученные данные проверяли на нормальность распределения с использованием критерия Шапиро—Уилка. В случае нормального распределения данных для сравнения средних использовали t-критерий Стьюдента. При ненормальном распределении результатов эксперимента дальнейшую статистическую обработку данных проводили с использованием U-критерия Манна—Уитни.
Исходная продолжительность плавания обеих экспериментальных групп животных статистически значимо не отличались друг от друга. Максимальная работоспособность мышей группы негативного контроля отмечена на 3-й день плавания с нагрузкой 369,83±96,359 с, что превосходило первоначальные показатели данной группы мышей на 128,5%. Затем у животных группы негативного контроля произошел спад физической активности, что нашло свое отражение в снижении продолжительности плавания в 1,8 раза относительно дня пиковой работоспособности.
В дальнейшем время плавания мышей группы НК не претерпела существенных изменений (рис. 2).
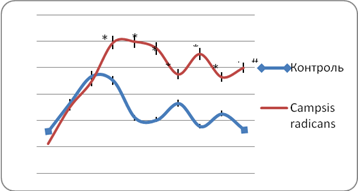
Рис. 2. Продолжительность плавания контрольной группы и животных, получавших извлечение из кампсиса укореняющегося
Примечание:
• — достоверно относительно контрольной группы (Р≤0,02)
# — достоверно относительно исходного значения (Р≤0,02)
У группы животных, получавших извлечение из кампсиса укореняющегося, работоспособность увеличивалась практически с первого дня плавания с нагрузкой. Пик физической активности у данной группы мышей отмечен на 5-й день эксперимента, время плавания при этом статистически достоверно (p>0,02) увеличилось на 346,3%. Затем, так же как и у мышей группы негативного контроля, у животных, получавших исследуемое извлечение, произошло падение работоспособности, однако изменения в продолжительности плавания носили менее выраженный характер, чем у группы НК (время плавания снизилась всего на 33% относительно дня максимальной физической активности). Затем работоспособность данной группы мышей практически не изменялась и к концу эксперимента время плавания увеличилась на 257,3% относительно исходных показателей и на 140,5% в сравнении с группой контроля. Полученные данные, вероятно, могут быть связаны с антиоксидантной активностью соединений, входящих в состав изучаемого извлечения [8].
Выводы
Методом бумажной хроматографии в сочетании с качественными реакциями установлено, что извлечение из листьев кампсиса укореняющегося, полученное экстракцией сырья 40%-ным спиртом этиловым, содержит комплекс фенольных соединений, представленный фенолокислотами, флавоноидами, кумаринами, дубильными веществами.
Методом ВЭЖХ идентифицированы 4 фенолокислоты, 3 вещества флавоноидной природы, относящихся к гликозидам флавонов, флаванонолам и катехинам, а одно вещество — к кумаринам, а также танин.
Экспериментально установлено, что под влиянием извлечения из кампсиса укореняющегося повышается работоспособность животных, что, по-видимому, связано с влиянием фенольных соединений.
Рецензенты:
Кодониди И.П., д.фарм.н., доцент, профессор кафедры органической химии, Пятигорский медико-фармацевтический институт – филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Попова О.И., д.фарм.н., профессор, профессор кафедры фармакогнозии, Пятигорский медико-фармацевтический институт – филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Библиографическая ссылка
Бжихатлова М.А., Андреева О.А., Оганесян Э.Т., Воронков А.В., Геращенко А.Д. ФЕНОЛЬНЫЕ СОЕДИНЕНИЯ ЛИСТЬЕВ КАМПСИСА УКОРЕНЯЮЩЕГОСЯ // Современные проблемы науки и образования. 2015. № 2-2. ;URL: https://science-education.ru/ru/article/view?id=22562 (дата обращения: 28.02.2026).



