Исследование влияния ионизирующей радиации на сердечно-сосудистую систему остается актуальной проблемой физиологии, радиобиологии и медицины. Сердце до недавнего времени рассматривали как радиорезистентный орган, основываясь главным образом на результатах гистологических исследований. Однако, впоследствии, с помощью электронно-микроскопического метода были обнаружены непосредственные и отдаленные изменения миокарда после локального облучения 5-10 Гр. При этом основную роль играло нарушение циркуляции вследствие облитерации капилляров [4]. В результате лучевой терапии может развиваться комплекс клинически значимых поражений тканей сердца – радиационно-индуцированная болезнь сердца [5], которая является существенным фактором ухудшения качества жизни и увеличения риска смертности [2]. В связи с этим актуальным представляется поиск эффективных радиопротекторов, способных снизить неблагоприятные последствия радиационного поражения сердца.
Цель исследования: изучение влияния широкополосного красного света на электрическую активность сердца и ультраструктуру миокарда крыс при развитии лучевой болезни.
Материалы и методы. Исследования проводились на беспородных белых крысах массой 180-250 грамм, которые были разделены на 4 группы. Первую группу (контроль) составили 14 крыс, получивших гамма-облучение проекционной области сердца с дозой 9 Гр. Облучение проводилось на установке «Луч-1» (энергия гамма-квантов, получаемых при распаде кобальта 60, имела два пика: 1,17 и 1,33 МэВ). Вторую группу (опыт) составили 10 крыс, также получивших локальную дозу облучения 9 Гр, но впоследствии проекционная область сердца которых была экспонирована низкоинтенсивным красным светом в течение 20 минут. Взятие образцов тканей миокарда у опытной и контрольной групп проводилось в день сеанса радиационного воздействия. В третью группу (хронический контроль) вошли 10 крыс, также получивших локальное облучение области сердца, но не подвергавшихся воздействию широкополосного красного света. Забор материала у данной группы производился на четвертые сутки, после развития радиационного поражения. Четвертую группу (хронический опыт) составили 10 крыс, получивших ту же дозу γ-излучения, но впоследствии ежедневно, в течение четырёх дней облучавшихся низкоинтенсивным красным светом. Время каждой экспозиции составляло 20 минут. Интенсивность света в зоне светового пятна была равна 5 мВт/см2. В эксперименте использовался широкополосный свет сверх яркого светодиода с максимумом спектрального диапазона 630 нм и шириной на полувысоте 20 нм. При прохождении через грудину интенсивность света снижалась на 20%. Забор материала у четвертой группы (хронический опыт) также производился на четвертые сутки. Кроме того, была выделена интактная группа животных, не подвергавшихся воздействию ни γ-излучением, ни светом. Запись электрокардиограммы производилась с помощью ветеринарного электрокардиографа Полиспектр-8/В. Обработка данных выполнялась с помощью программы Нейрософт.
Электрическую активность сердца оценивалась по следующим параметрам: частота сердечных сокращений (ЧСС, уд./мин), максимальное обнаруженное расстояние между двумя следующими друг за другом QRS-комплексами (RRmax, мс), минимальное расстояние между двумя следующими друг за другом QRS-комплексами (RRmin, мс), среднее расстояние между QRS-комплексами (RRср, мс), длительность Q-волны (Q, мс), длительность R-волны (R, мс), интервал PR (мс), длительность QRS-комплекса (QRS, мс), интервал QT (мс), нормализованный интервал QTc, вычисляемый по формуле Базетта (QTc, мс), электрическая ось сердца (ось QRS), напряженность зубцов Q, R, S и T (мВ).
Для электронно-микроскопического исследования иссекалась сердечную ткань, которая фиксировалась в 2,5 % растворе глютарового альдегида на фосфатном буфере (рН=7,4) с последующей дофикацией 1 % раствором осмиевой кислоты, обезвоживанием в спиртах возрастающей концентрации с дальнейшей заливкой в смесь эпона с аралдитом [3]. Ультратонкие срезы готовились на ультратоме Leica UC7 и просматривались на трансмиссионном электронном микроскопе Morgagni 268D фирмы FEI. Морфометрия выполнялась с помощью программы AnalySIS.
Для статистической обработки результатов использовался пакет прикладных программ SPSS Statistics. Для определения различий между исследуемыми группами использовался t-критерий Стьюдента. Достоверными считались различия при р≤0,05. Результаты представлялись в виде М±σ, где М – среднее значение, а σ – среднее квадратичное отклонение.
Результаты и их обсуждение. Анализ ЭКГ, полученных при облучении лабораторных животных ионизирующей радиацией, показал, что статистически значимые различия между группами наблюдались по QT- и QTc- интервалам (p≤0,05), отражающим процессы деполяризации и последующей реполяризации желудочков. Результаты по данным параметрам для всех групп лабораторных животных представлены в таблице 1.
Таблица 1
Показатели QT и QTc в четырех исследуемых группах в сравнении с нормой
|
Группа |
Иитактная группа |
Контроль |
Хронический контроль |
Опыт |
Хронический опыт |
|
QT, мс |
297,8±25,3*, ** |
597,3±24,9***, **** |
611,3±59,05***** |
491,4±32,1 |
280,4±25,6 |
|
QTc, мс |
336,6±33,1*, ** |
1179,8±31,4***, **** |
787,3±30,0***** |
464,4±23,2 |
230,0±9,93 |
Примечание: * - статистически значимые различия (р ≤ 0,05) между нормой и контролем;
** - статистически значимые различия (р ≤ 0,05) между нормой и хроническим контролем;
*** - статистически значимые различия (р ≤ 0,05) между контролем и опытом;
**** - статистически значимые различия (р ≤ 0,05) между контролем и хроническим опытом;
***** - статистически значимые различия (р ≤ 0,05) между хроническим контролем и хроническим опытом.
Исходя из данных таблицы 1, можно сделать вывод о постепенном увеличении QT- и QTc- интервалов после облучения миокарда γ-излучением, что свидетельствует об увеличении механической систолы. Этот эффект достигает максимума на четвёртый день после облучения (хронический контроль). Статистически значимые различия между группами наблюдались также при сравнении напряжения зубцов R и Т (см. таблицу 2). Изменения напряжения зубцов ЭКГ и длительности интервалов можно связать с процессом развития ишемии миокарда, спровоцированным оксидативным стрессом после воздействия ионизирующим излучением. Для синтеза АТФ необходим кислород, поэтому в ходе развития ишемии миокарда в первую очередь начинает страдать процесс реполяризации, и происходит изменение зубца Т. Нарушение реполяризации желудочков ведет к нарушениям метаболизма миокарда, острой его дистрофии и к наступлению кислородной недостаточности. Отклонение зубца Т от нормы обычно сопровождается удлинением интервала QT. Снижение напряжения зубцов Т в контрольной серии (см. таблицу 2) можно связать с появлением отрицательных значений зубцов, свидетельствующих о развитии ишемии миокарда уже на первые сутки после воздействия ионизирующим излучением. В группе «хронический контроль» наблюдалось достоверное увеличение напряжения Т-зубцов, что говорит о нарастании ишемии миокарда, которая развивалась в течение четырёх суток после воздействия ионизирующим излучением.
Последовательное воздействие низкоинтенсивным красным светом обеспечивало восстановление изучаемых характеристик ЭКГ до уровней, которые наблюдались в интактной группе (см. таблицы 1 и 2, данные для интактной группы и хронического опыта). Таким образом, спровоцированная гамма-излучением ишемия миокарда носила обратимый характер.
Таблица 2
Напряжения зубцов R и Т в четырех исследуемых группах в сравнении с нормой
|
Группа
|
Иитактная группа |
Контроль |
Хронический контроль |
Опыт |
Хронический опыт |
|
R, мВ |
0,450±0,071*, ** |
0,508±0,07***, **** |
0,777±0,0066 ***** |
0,657±0,055 |
0,491±0,088 |
|
Т, мВ |
0,079±0,0034** |
0,0586±0,017 **** |
0,153±0,0012 ***** |
0,0635±0,0074 |
0,0814±0,0072 |
Примечания к данной таблице аналогичны примечаниям к таблице 1.
Электронно-микроскопическое исследование мышцы сердца животных контрольной группы показало наличие внутриклеточного отёка кардиомиоцитов от слабой до сильной степени. В участках просветления саркоплазмы митохондрии были набухшие, с деструкцией и дезориентацией крист, с просветлением и вымыванием матрикса, наличием в них вакуолей и в ряде случаев с нарушением целостности наружной мембраны (табл.3). Наблюдались также стаз, плазматизации капилляров с агрегацией и уменьшением аморфного осмиофильного материала (плазматических белков), присутствие в просвете их пузырей, мембранных структур вплоть до закрытия отдельных сосудов (Рис. 1а).
Таблица 3
Площадь митохондрий кардиомиоцитов
|
Группа животных |
Площадь митохондрий, (мкм2) |
Количество митохондрий |
|
Норма |
0,55±0,042 |
n = 500 |
|
Контроль |
0,6862±0,10* |
n = 500 |
|
Опыт |
0,61±0,035* |
n = 500 |
|
Хронический опыт |
0,42±0,035* |
n = 500 |
Примечание: * - статистически значимые различия (р ≤ 0,05).
Исследование ультраструктуры миокарда животных группы «опыт» показало, что воздействие широкополосным красным светом способствовало уменьшению отёчности кардиомиоцитов и появлению значительного количества гранул гликогена (Рис.1б). В образцах группы «хронический опыт» наблюдалось уменьшение нарушений субмикроскопической структуры кардиомиоцитов по сравнению с контрольной группой. Для образцов этой группы была характерна гиперплазия митохондрий, что, по-видимому, связано с энергодефицитом, вызванным облучением, и является адаптивной реакцией организма (Рис.1в,г). Отметим, что несомненным признаком адаптации к гипоксии является увеличение массы митохондрий в тканях; появление новой популяции мелких митохондрий с набором ферментов, позволяющих им работать в этом новом режиме, при долговременной адаптации.
Полученные результаты подтверждают литературные данные о том, что воздействие ионизирующей радиации на область сердца лабораторного животного приводит к патологическим изменениям кардиомиоцитов, а также к изменениям электрической активности сердца. Однако эти процессы оказались обратимыми при облучении образцов широкополосным красным светом в последовательном режиме.
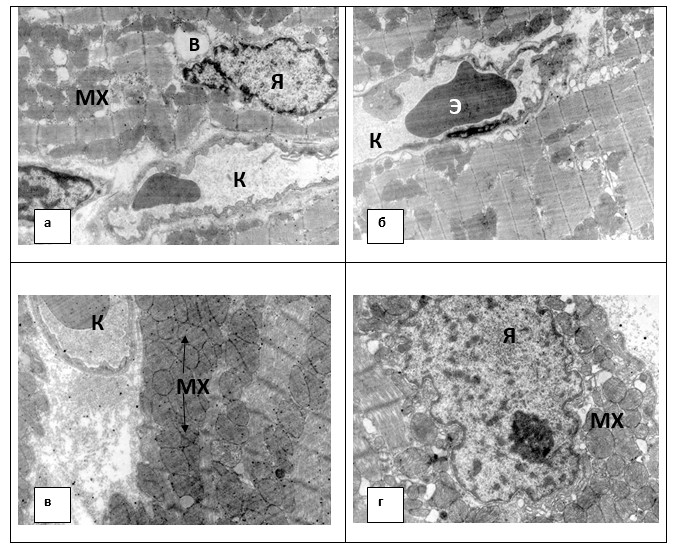
Рис. 1. Ультраструктура миокарда крыс
а) контрольной группы: вакуолизация саркоплазмы, фрагментация и набухание ядра, сокращение миофибрилл, набухание митохондрий, в просвете капилляра уменьшенное содержание аморфного осмиофильного материала, везикулярный эндотелий, очаговое набухание базального слоя;
б) опытной группы: небольшое расширение саркоплазматического ретикулума, в просвете к обычная кровь;
в) хронической опытной группы: гиперплазия митохондрий, в просвете капилляра эритроцит и плазма;
г) хронической опытной группы: ядро с хорошо выраженным ядрышком.
В – вакуоль, К – капилляр, МХ – митохондрия, Э – эритроцит, Я – ядро.
Наблюдавшиеся эффекты можно объяснить на основе имеющихся в настоящее время представлений о механизмах фотобиологического действия красного света. Активные формы кислорода, являющиеся продуктами радиолиза в живых тканях, вызывают оксидативный стресс и, как следствие, накопление продуктов перекисного окисления липидов, белков, модификацию активности ферментов антиоксидантной защиты и других биологически значимых молекул. Подобные эффекты можно наблюдать не только при воздействии ионизирующими излучениями, но и спровоцировать в миокарде после наложения экспериментальной ишемии и возобновлении перфузии [9], а также при наложении асфиксии [1]. В работах [7] было экспериментально показано, что последствия оксидативного стресса могут быть полностью или частично компенсированы действием низкоинтенсивного красного света. При этом наблюдалось и восстановление сократительной активности мышцы изолированного сердца. В основе подобных эффектов, которые часто обозначают термином фотобиомодифицикация, находятся несколько фотохимических реакций. К ним относятся происходящие под действием красного света высвобождение окиси азота, связанной с цитохром с-оксидазой [10], модификация дыхательной цепи живой клетки, изменение активности супероксиддисмутазы и NO-синтазы [8] и другие. Каждая из этих реакций способна оказать существенное влияние на функциональную активность миокарда и, соответственно, на структуру ЭКГ. Например, окись азота, синтезируемая, митохондриальной NO-синтазой, ингибирует дыхание вследствие образования связи с цитохром с-оксидазой [6]. Фотолиз этих молекулярных комплексов приводит к выходу свободной окиси азота и к реактивации переносчиков электронов в дыхательной цепи. В конечном итоге происходит восстановление процессов дыхания и активация синтеза молекул АТФ. Кроме того, высвобождаемая окись азота, которая отвечает за расслабление гладких мышц сосудов, их расширение (вазодилатацию) и предотвращает агрегацию тромбоцитов и адгезию нейтрофилов к эндотелию, может способствовать увеличению просвета сосудов коронарной системы и улучшению микроциркуляции. Эти процессы, в свою очередь, обеспечивают снижение уровня процессов перекисного окисления липидов, окислительной модификации белков, изменение микроструктуры кардиомицитов и электрической активности сердца.
Заключение. Проведенное исследование показало, что экспонирование широкополосным красным светом проекционной области сердца крыс, подвергнутых воздействию γ-излучения, способствовало нормализации показателей электрической активности миокарда, а также снижало проявления лучевой болезни на суб- и клеточном уровнях.
10. Zhang R. Near infrared light protects cardiomyocytes from hypoxia and reoxygenation injury by a nitric oxide dependent mechanism / R. Zhang, Y. Mio, P.F. Pratt, N. Lohr, D.C. Warltier, H.T. Whelan, D. Zhu, E.R. Jacobs, M. Medhora, M. Bienengraeber // J. Mol. Cell. Cardiol.- 2009. №46.- Р.4-14.
Рецензенты:
Корягин А.С., д.б.н., проф. кафедры биохимии и физиологии Нижегородского государственного университета им. Н.И. Лобачевского, г. Нижний Новгород;
Плескова С.Н., д.б.н., в.н.с. лаборатории биохимии и молекулярной биологии Томского государственного университета, г. Томск.
Библиографическая ссылка
Монич В.А., Баврина А.П., Малиновская С.Л., Яковлева Е.И. КОРРЕКЦИЯ НАРУШЕНИЙ МИОКАРДА, ВЫЗВАННЫХ ИОНИЗИРУЮЩЕЙ РАДИАЦИЕЙ, С ПОМОЩЬЮ НИЗКОИНТЕНСИВНОГО ЭЛЕКТРОМАГНИТНОГО ИЗЛУЧЕНИЯ // Современные проблемы науки и образования. 2015. № 2-2. ;URL: https://science-education.ru/ru/article/view?id=22486 (дата обращения: 28.02.2026).



