Рак полости рта, особенно плоскоклеточный, ежегодно затрагивает около 300000 человек. Его распространенность среди мужчин составляет 3%, а среди женщин – 2% от всех злокачественных новообразований [9]. Несмотря на легкий доступ к опухоли при диагностике, по-прежнему, остается высокий процент выявляемости заболевания на поздних стадиях и метастазирование в лимфатические узлы шеи. Основа лечения рака слизистой оболочки полости рта (СОПР) – хирургическое вмешательство, комбинированное с лучевой и химиотерапией. Такое воздействие на ротовую полость сопровождается снижением местного антимикробного статуса и развитием гнойно-септических осложнений в послеоперационный период. Для прогнозирования инфекционных осложнений после хирургического лечения рака СОПР не полностью раскрыты возможности масс-спектрометрии такой биологической среды как слюна. Слюна является легко доступной для проведения диагностики биологической жидкостью. Слюна является сложным гипотоническим раствором, который содержит 3397 различных белков с разнообразными биологическими функциями [11]. В слюну поступают секреты главных и дополнительных слюнных желез, десневая жидкость из десневой борозды, бронхиальный секрет, бактерии и их продукты жизнедеятельности, слущенные эпителиальные клетки, остатки пищи. Кроме того, в слюне находятся молекулы, которые фильтруются из крови (например, С-реактивный белок) [10]. Идентификация белковых молекул с высокой эффективностью при низкой себестоимости лечения осуществляется при масс-спектрометрии. Масс-спектрометрия - метод идентификации молекул путем измерения отношения их массы к заряду (m/z) в ионизированном состоянии. MALDI (Matrix Assisted Laser Desorption Ionization) - ионизация вещества с помощью матрицы и лазерного излучения. TOF MS (Time Of Flight Mass-Spectrometry) - времяпролетная масс-спектрометрия. Масса молекулы оценивается по времени пролета от источника ионизации до детектора [6]. Сравнение масс-спектра с данными, содержащимися в базе данных, приводит к высококачественной идентификации белков. Данные по протеомике слюны накапливаются в базе [12] и [13], способствуя качественному анализу слюны. Установленные белковые паттерны могут использоваться как в диагностических целях, так и для прогноза течения заболевания.
В связи с вышеизложенным, целью работы явилось выявить особенности масс-спектров белков слюны у больных раком СОПР для прогнозирования развития гнойно-септических осложнений после хирургического лечения.
Материалы и методы
У больных раком СОПР до операции собирали слюну. Затем в зависимости от течения послеоперационного периода пациенты были разделены на две группы: основная группа (n=8) - больные, у которых после операции развивались гнойно-септические осложнения: некроз мышечного или кожно- жирового лоскута, используемого для пластики, остеомиелит нижней челюсти, флегмона нижней челюсти. У больных контрольных группы (n=9) послеоперационный период протекал без инфекционных осложнений. У всех больных стадия рака СОПР соответствовала Т2. Отдаленных метастазов не наблюдалось.
Слюну собирали утром в 8 до 9 утра после 15-минутного отдыха. Чистку зубов осуществляли накануне вечером. Утром пациенты не принимали пищу и не пили воду. Слюну в течение 5 мин собирали в бумажный стаканчик путем спонтанного стекания с языка, без сплевывания. Во время сбора слюны пациенты молчали. Из стаканчика забирали 6 мл слюны и помещали в центрифужную трубку. Трубку помещали на лед для достижения температуры биожидкости 4ºС. Затем центрифугировали при 9000 об/мин в течение 7 мин. При этом удалялись нерастворимые вещества, клетки. Далее к супернатанту были добавлены 1 мM этилендиаминтетрауксусной кислоты и 1 мM фенилметил сульфонилфлуорида для ингибирования активности протеаз. Концентрацию белка определяли методом Лоури на биохимическом анализаторе. Супернатанты хранили при температуре -80ºС до проведения масс-спектрометрии. Перед анализом 5 мкл альфа-циано-4-гидроксикоричной кислоты (0,4 г/л) растворяли в 100% ацетоне и 100% этаноле, добавляли 0,8-1,2 мкл элюата слюны и смешивали. Далее, 0,8-1,2 мкл этой смеси наносили на металлическую пластину-мишень и сушили при комнатной температуре, затем исследовали образцы. На подложке масс-спектрометра смешивали биоматериал и специальную матрицу (2',5'- дигидроксибензойная кислота), раствор которой устойчив к свету. Образец помещали в прибор масс-спектрометр MALDI-TOF MS (Bruker Bio-sciences, Germany) и подвергали воздействию наносекундных лазерных импульсов (400 выстрелов лазерной энергии). При этом молекулы матрицы и белков переходят в газовую фазу, а протонированные молекулы матрицы взаимодействуют с белками, перенося на них положительный заряд. Под действием электрического поля ионизированные белки движутся от источника ионизации к детектору с ускорениями, обратно пропорциональными их атомным массам. Программное обеспечение прибора оценивает время пролета частиц и преобразует эту информацию в спектр молекулярных масс (масс-спектр). Полученный спектр представляет собой набор пиков, отражающих наиболее представленные белки в микроорганизме и является уникальным для данного организма, как отпечатки пальцев. С каждого образца накопление происходило по 50 спектров.
Результаты
У больных изучаемых групп молекулярная масса большинства пептидов слюны находилась в диапазоне от 1000 до 7000 Да. При комплексном анализе всех полученных масс-спектров было найдено в среднем 112 пиков белков. Большинство пиков по интенсивности не отличались друг от друга. Однако, интенсивность 10 пиков между двумя группами, приходящихся на 1062,104 Da, 1454,178 Da, 2212,978 Da, 2350,701 Da, 2621,386 Da, 3016,108 Da, 3154,378 Da, 3163,407 Da, 5378,508 Da, 5435,197 Da достоверно отличались (табл. 1).
Различие интенсивности масс-спектров для белков с молекулярной массой 1454,178 Da, 2350,701 Da и 3163,407 Da в основной и контрольной группах было наиболее выраженным, что представлено на рис.1.
Таблица 1
Характеристика масс-спектров у больных раком СОПР
|
Молекулярная масса пептида, Da |
Тренд изменения интенсивности спектра в основной группе |
р |
|
1062,104 |
Повышение |
0,003 |
|
1454,178 |
Повышение |
0,002 |
|
2212,978 |
Снижение |
0,026 |
|
2350,701 |
Снижение |
0,007 |
|
2621,386 |
Снижение |
0,037 |
|
3016,108 |
Снижение |
0,024 |
|
3154,378 |
Снижение |
0,045 |
|
3163,407 |
Снижение |
0,024 |
|
5378,508 |
Снижение |
0,017 |
|
5435,197 |
Снижение |
0,034 |
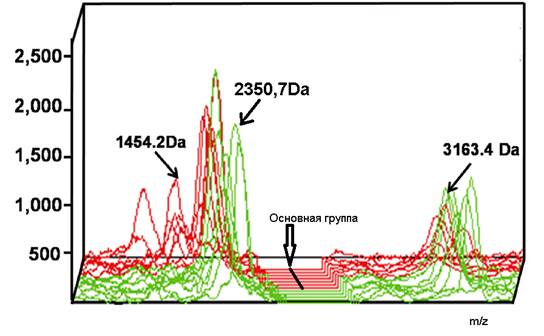
Рис. 1. Трехмерное изображение масс-спектров больных основной и контрольной групп с указанием пиков пептидов с наиболее отличительной интенсивностью. Спектры больных основной группы маркированы соединительной линией
В основной группе по сравнению с контрольной для пептидов 2212,978 Da, 2350,701 Da, 2621,386 Da, 3016,108 Da, 3154,378 Da, 3163,407 Da, 5378,508 Da, 5435,197 Da наблюдалось снижение пиков, а для белков с молекулярной массой 1062,104 Da, 1454,178 Da – повышение. Вид масс-спектра белков слюны больного из основной и контрольной группы представлены на рис.2.
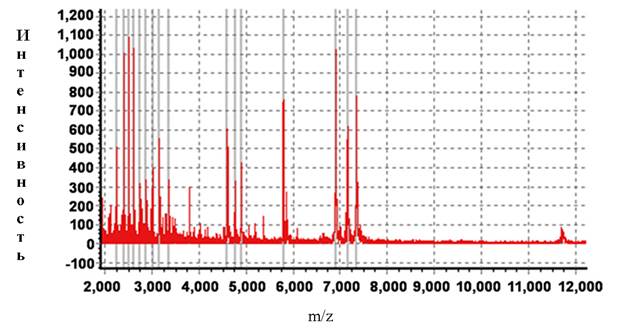 А
А
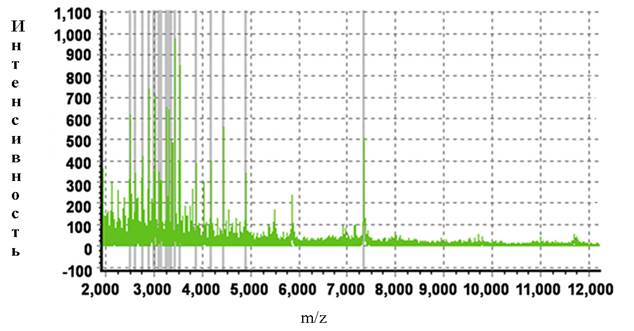 Б
Б
Рис.2. Масс-спектры белков слюны больных раком СОПР из основной (А) и контрольной (Б) группы
Идентификация пептидов слюны, которые имели наиболее отличительные по интенсивности масс-спектры, позволила установить, что белок с молекулярной массой 1454,178 Da был представлен белком SERPINA1, с массой 3163,407 Da - белком F2 Prothrombin precursor и с массой 2350,701 Da - Hypoxia Inductor Factors. Белок известный как SERPINE1 один из основных компонентов тромболитической плазминоген-плазминовой системы. Он ингибирует тканевый и урокиназный активаторы плазминогена. Если его активность повышена, что наблюдалось в основной группе, то тромболитическая система заторможена и риск тромбообразования возрастает [5].
Пептид с молекулярной массой 3163.4-Da был идентифицирован как F2 предшественника протромбина. Тромбин является "трипсиноподобной 'протеазой серина, кодируемый геном F2. Тромбин имеет потенциал по влиянию на воспаление [2]. Тромбин, образующийся в участке повреждения, координирует процессы репарации тканей, стимулируя клетки, участвующие в основных этапах заживления раны. Тромбин активирует адгезию и агрегацию тромбоцитов, вызывает активацию эндотелиальных клеток, освобождение клетками факторов роста, адгезию лейкоцитов и их рекрутмент (преимущественно моноцитов и T-лимфоцитов ) и пролиферацию клеток эндотелия, эпителия, фибробластов, нервных клеток и гладкомышечных, взаимодействует с тучными клетками. Тромбин рассматривают как медиатор воспаления, поскольку при действии достаточно высоких (более 10 нМ) его концентраций происходит быстрое, но кратковременное повышение проницаемости эндотелия [2].
Гипоксия индуцибельный фактор-1 (Hypoxia-inducible factor-1, HIF1) является ключевым регулятором клеточного ответа на гипоксию [8]. HIF1a функционирует как активатор транскрипции при гипоксии. Связываясь с промоутерами более 100 генов, задействованных в биологии опухолей, фактор HIF1a участвует в канцерогенезе [3]. HIF1a при развитии гипоксии в опухолевой ткани стимулирует ген синтеза фактора роста эндотелия сосудов (vascular endothelial growth factor, VEGF). Данное обстоятельство усиливает ангиогенез и адаптацию ткани к гипоксии. Рак СОПР зачастую сопровождается быстрым и неограниченным ростом, что ведет к формированию тканевой гипоксии [1,4]. HIF-1a альтернативно влияет на системное распространение опухолевых клеток и воспалительных факторов. Через стимуляцию транскрипционных процессов и ангиогенез HIF-1a способствует распространению опухолевого процесса. Иначе складывается ситуация с распространением инфекционных агентов. HIF-1a, наоборот, способствует местному ограничению воспалительного процесса [7]. HIF-1a регулирует синтез важных молекулярных эффекторов иммунной защиты, включая гранулированные протеазы, антимикробные пептиды, оксид азота и фактор некроза опухоли-a . Бактериальная инфекция активирует подкласс HIF-1a генов-мишеней, специфически связанных с уничтожением микробов, демонстрируя посредством этого, что HIF-1a обладает жизненно важной функцией во врожденном иммунитете, отличной от гипоксической реакции. Следовательно, HIF-1a способствует ограничению системного распространения инфекции из первоначального источника. Повышенная активность HIF-1a содействует синтезу защитных факторов и увеличивает бактерицидную активность, обеспечивает способы усиления врожденных иммунных реакций на микробную, в том числе бактериальную, инфекцию. Местное снижение секреции HIF-1a может запустить механизмы развития гнойно-септических осложнений у больных раком СОПР.
Итак, с развитием гнойно-септических осложнений после хирургического лечения рака СОПР ассоциировано c различием интенсивности масс-спектров для белков с молекулярной массой 1454,178 Da (белок SERPINA1), 2350,701 (F2 Prothrombin precursor) и 3163,407 Da (Hypoxia Inductor Factors). Причем, интенсивность масс-спектра белка слюны 1454,178 Da была повышенной, а 2350,701 Da и 3163,407 Da – сниженной.
Выводы
Снижение интенсивности масс-спектра слюны для белков 2350,701 Da и 3163,407 Da с повышением амплитуды спектра для пептида 1454,178 Da является белковым паттерном, ассоциированным с развитием гнойно-септических осложнений после хирургического лечения рака СОПР и имеет прогностическое значение
Рецензенты:
Харсеева Г.Г., д.м.н., профессор, заведующая кафедрой микробиологии и вирусологии №2 ГБОУ ВПО «Ростовский государственный медицинский университет» Минздрава России, г. Ростов-на-Дону;
Демидов Ю.Н., д.м.н., директор «Клиники имплантологии», г. Ростов-на-Дону.
Библиографическая ссылка
Омельченко В.П., Кононенко В.И., Максимов А.Ю., Демидова А.А. ВОЗМОЖНОСТИ МАСС-СПЕКТРОМЕТРИИ MALDI-TOF В ПРОГНОЗИРОВАНИИ ГНОЙНО-СЕПТИЧЕСКИХ ОСЛОЖНЕНИЙ ПОСЛЕ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ РАКА СЛИЗИСТОЙ ОБОЛОЧКИ ПОЛОСТИ РТА // Современные проблемы науки и образования. 2015. № 2-2. ;URL: https://science-education.ru/ru/article/view?id=21908 (дата обращения: 28.02.2026).



