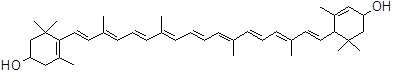
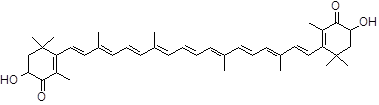
В настоящее время все кислородсодержащие производные каротиноидных углеводородов объединяют в подгруппу ксантофиллов. Наиболее распространенным из них является пигмент листьев – лютеин (рис. 1), который является дигидроксипроизводным α-каротина. Представителем бициклических кетокаротиноидов является астаксантин, который характерен для большинства гидробионтов и морских животных (рис. 1).
а) лютеин (β,ε-каротин,-3,3`-диол)
б) астаксантин (3,3`-дигидрокси-β,β-каротин-4,4`-дион)
Рис. 1. Структура лютеина (а) и астаксантина (б)
Следует отметить, что в природе каротиноиды могут находиться в различных состояниях: в свободном виде, в виде эфиров жирных кислот, а также в форме протеиновых комплексов. Млекопитающие не способны синтезировать каротиноиды, при этом эти соединения являются незаменимыми факторами питания человека.
Цель исследования – качественный анализ биологически активных добавок к пище (БАД) – капсул «Биоастин» и «Лютеин 100%» методом тонкослойной хроматографии.
Объекты и методы исследования
Объекты исследования
Капсулы «Биоастин» № 30, содержащие натуральный астаксантин от 4 до 5 мг/капс., серии 23.12.13 и 25.12.13, производитель – «CyanotechCorporation», США, фасовка – ООО «В-МИН», г. Сергиев Посад, Московская обл., РФ.
Капсулы «Лютеин 100%» № 60, серии 01.04.14 и 04.04.14, производитель – ЗАО «РеалКапс», пгт. Свердловский, Московская обл., РФ.
Методика ТСХ-анализа
Приготовление раствора стандартного образца (СО) астаксантина, лютеина, β-каротина. Около 0,01 г (точная навеска) или астаксантина, или лютеина, или β-каротина помещали в мерную колбу вместимостью 10 мл, растворяли в 5–6 мл гексана и доводили объем раствора до метки тем же растворителем (раствор А).
5 мл раствора А переносили в мерную колбу вместимостью 50 мл и доводили объем раствора до метки тем же растворителем (раствор Б).
Приготовление раствора испытуемого образца капсул «Биоастин». Содержимое одной капсулы количественно переносили в мерную колбу вместимостью 10 мл, растворяли в 5-6 мл гексана и доводили объем раствора до метки тем же растворителем.
Приготовление раствора испытуемого образца капсул «Лютеин 100%». Содержимое одной капсулы количественно переносили в мерную колбу вместимостью 10 мл, растворяли в 5–6 мл гексана и доводили объем раствора до метки тем же растворителем.
Методика проведения испытания
На линию старта хроматографической пластинки 10х15 см «Sorbfil» наносили по 5 мкл растворов испытуемых образцов капсул «Биоастин» и «Лютеин 100%» и растворов Б СО астаксантина, лютеина, β-каротина.
Образцы хроматографировали восходящим способом в соответствующей подвижной фазе.
Составы подвижных фаз: I – петролейный эфир — диэтиловый эфир — кислота
уксусная (85:15:1);
II – диэтиловый эфир — петролейный эфир (3:1);
III – петролейный эфир — бензол (10:1);
IV – гексан — ацетон (6:2).
После продвижения подвижной фазы до края пластинки пластинку вынимали и сушили.
Детекцию проводили визуально по окраске зон адсорбции. Далее опрыскивали пластинки 10%-ным раствором фосфорно-молибденовой кислоты с последующим нагреванием до 60°С в течение 2 мин. Зоны адсорбции всех каротиноидов окрашивались в ярко-синий цвет.
Идентификацию каротиноидов осуществляли по величинам коэффициентов подвижности, сравнивая их с опубликованными в периодической литературе [4-9] коэффициентами подвижности для использованных в эксперименте хроматографических условий и по СО астаксантина, лютеина и β-каротина.
Результат и их обсуждение
Для подтверждения наличия астаксантина в образцах капсул «Биоастин» был проведен хроматографический анализ образцом методом ТСХ в четырех системах растворителей. В ходе предварительных исследований было оптимизировано количество испытуемых и СО образцов, которое необходимо наносить на линию старта хроматографической пластинки.
В результате проведенного эксперимента были получены хроматограммы образцов капсул «Биоастин» серий 23.12.13 и 25.12.13, рассчитаны коэффициенты подвижности для всех зон адсорбции. Результаты ТСХ-анализа испытуемых образцов капсул «Биоастин» представлены в таблице 1.
Таблица 1
Результаты анализа капсул «Биоастин» методом ТСХ
|
Каротиноид |
Система растворителей/коэффициенты подвижности (Rf) |
|||||||
|
I |
II |
III |
IV |
I |
II |
III |
IV |
|
|
серия 23.12.13 |
серия 25.12.13 |
|||||||
|
лютеин |
0,015 |
0,125 |
–––– |
0,633 |
0,016 |
0,123 |
–––– |
0,633 |
|
не идентифицирован |
0,044 |
0,195 |
–––– |
–––– |
0,043 |
0,192 |
–––– |
–––– |
|
не идентифицирован |
0,059 |
0,281 |
–––– |
–––– |
0,060 |
0,280 |
–––– |
–––– |
|
астаксантин |
0,067 |
0,367 |
0,040 |
0,867 |
0,070 |
0,370 |
0,045 |
0,870 |
|
кантаксантин |
0,348 |
0,703 |
–––– |
–––– |
0,350 |
0,700 |
–––– |
–––– |
|
β-каротин |
0,470 |
0,820 |
0,056 |
0,933 |
0,468 |
0,818 |
0,058 |
0,935 |
По результатам анализа установлено, что качественный состав анализируемых серий капсул «Биоастин» идентичен. В ходе исследования с использованием СО астаксантина, лютеина, β-каротина и систем растворителей I, II были обнаружены шесть каротиноидов, среди них идентифицированы астаксантин, кантаксантин, лютеин и β-каротин. Все эти четыре каротиноида заявлены производителем как компоненты капсул «Биоастин». Кроме того, использование систем растворителей I и II позволило обнаружить дополнительно два неидентифицированных соединения. Эти вещества были отнесены к классу каротиноидов, так как их зоны адсорбции были окрашены в красный и оранжевый цвета, а после обработки 10%-ным раствором фосфорно-молибденовой кислоты окрасились в синий цвет.
Следует отметить, что зоны адсорбции на хроматограммах образцов капсул «Биоастин», соответствующие астаксантину, находились на одном уровне с зонами адсорбции СО астаксантина (табл. 2)
Таблица 2
Результаты идентификации астаксантина в капсулах «Биоастин»
|
Каротиноид |
Система растворителей/относительные коэффициенты подвижности (Rs) |
|||||||
|
I |
II |
III |
IV |
I |
II |
III |
IV |
|
|
серия 23.12.13 |
серия 25.12.13 |
|||||||
|
астаксантин |
0,98 |
1,01 |
1,00 |
0,98 |
1,00 |
1,01 |
0,98 |
0,99 |
Таким образом, в капсулах «Биоастин» методом ТСХ были идентифицированы четыре каротиноида, заявленные производителем, и обнаружены два неидентифицированных каротиноида.
С целью идентификации каротиноидов капсул «Лютеин 100%» был проведен ТСХ-анализ двух серий этой БАД. Данные результатов исследования образцов капсул «Лютеин 100%» методом ТСХ в четырех системах растворителей приведены в таблице 3.
Таблица 3
Результаты анализа капсул «Лютеин 100%» методом ТСХ
|
Каротиноид |
Система растворителей/ коэффициенты подвижности (Rf) |
|||||||
|
I |
II |
III |
IV |
I |
II |
III |
IV |
|
|
серия 01.04.14 |
серия 04.04.14 |
|||||||
|
не идентифицирован |
0,074 |
0,05 |
____ |
0,375 |
0,073 |
0,048 |
____ |
0,374 |
|
лютеин |
0,270 |
0,124 |
____ |
0,879 |
0,265 |
0,126 |
____ |
0,880 |
|
β-каротин |
0,484 |
0,818 |
0,033 |
0,960 |
0,489 |
0,821 |
0,035 |
0,958 |
Как показали результаты ТСХ-анализа с использованием СО лютеина и β-каротина и систем растворителей I, II и IV, в капсулах «Лютеин 100%» присутствуют эти каротиноиды. Кроме того, эти системы позволили установить наличие одного неидентифицированного каротиноида в капсулах. С помощью подвижной фазы III в сравнении с СО β-каротина был идентифицирован только β-каротин, остальные каротиноиды остались на линии старта.
Выводы:
1. Методом ТСХ в капсулах «Биоастин» идентифицированы четыре каротиноида, заявленные производителем: астаксантин, кантаксантин, лютеин и β-каротин. Подвижная фаза состава петролейный эфир — диэтиловый эфир — кислота уксусная (85:15:1) позволила обнаружить в образцах капсул «Биоастин» обеих серий два неидентифицированных соединения, которые были отнесены к классу каротиноидов.
2. ТСХ-анализ капсул «Лютеин 100%» показал наличие в них лютеина и β-каротина. Подвижные фазы I, II, IV позволили обнаружить один неидентифицированный каротиноид в капсулах «Лютеин 100%».
3. Подвижная фаза III, состоящая из петролейного эфира и бензола в соотношении 10:1, не дает возможности идентифицировать лютеин в капсулах «Биоастин» и «Лютеин 100%».
4. Все четыре подвижные фазы позволили идентифицировать β-каротин во всех проанализированных сериях капсул «Биоастин» и «Лютеин 100%».
Рецензенты:
Степанова Э.Ф., д.фарм.н., профессор, профессор кафедры технологии лекарств Пятигорского медико-фармацевтического института – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Кайшева Н.Ш. д.фарм.н., профессор кафедры фармацевтической и токсикологической химии Пятигорского медико-фармацевтического института – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Библиографическая ссылка
Курегян А.Г. АНАЛИЗ БАД, СОДЕРЖАЩИХ АСТАКСАНТИН И ЛЮТЕИН, МЕТОДОМ ТОНКОСЛОЙНОЙ ХРОМАТОГРАФИИ // Современные проблемы науки и образования. 2015. № 2-2. ;URL: https://science-education.ru/ru/article/view?id=21655 (дата обращения: 28.02.2026).



