Исследование совместной сорбции трехкомпонентных систем является важным шагом в анализе закономерностей сорбции ионов [2]. Фосфорнокислые катиониты занимают особое место среди известных в настоящее время ионитов. Они обладают всеми свойствами сильно- и слабокислотных катионитов. Для них характерны высокая обменная емкость, селективность к ряду металлов. Фосфорнокислые катиониты обладают комплексообразующими свойствами. Вследствие повышенной селективности ко многим ионам тяжелых и переходных металлов представляется перспективным их применение в различных отраслях народного хозяйства и научных исследованиях [3].
Целью настоящей работы является установление механизма и закономерности влияния концентрации ионов и соляной кислоты, формы катионита и рН растворов на совместную сорбцию иттрия, бария, меди.
Экспериментальная часть
Исследования проводили из 0,05 М растворов ![]() , содержащих
, содержащих ![]() в концентрациях от 0 до 1,0 моль/л фосфорнокислым катионитом КФП-12 с обменной емкостью 7,5 мг-экв/г. Как бифункциональный катионит диссоциирует по двум ступеням и характеризуется показателями кажущихся констант ионизации
в концентрациях от 0 до 1,0 моль/л фосфорнокислым катионитом КФП-12 с обменной емкостью 7,5 мг-экв/г. Как бифункциональный катионит диссоциирует по двум ступеням и характеризуется показателями кажущихся констант ионизации ![]() =3,5 и
=3,5 и ![]() =8,9, что указывает на высокую прочность связи протона с ионогенной группой. Сорбция проводилась из хлоридных растворов в статистических и динамических условиях на катионите КФП-12 в
=8,9, что указывает на высокую прочность связи протона с ионогенной группой. Сорбция проводилась из хлоридных растворов в статистических и динамических условиях на катионите КФП-12 в ![]() и
и ![]() — формах при комнатной температуре (18±20С). В статических условиях при постоянной навеске катионита 1 г с размером зерен 0,25–0,50 мм заливали 50
— формах при комнатной температуре (18±20С). В статических условиях при постоянной навеске катионита 1 г с размером зерен 0,25–0,50 мм заливали 50 ![]() растворами с одновременным присутствием солей
растворами с одновременным присутствием солей![]() ,
, ![]() и
и ![]() с различным содержанием ионов металлов и HCl. Раствор перемешивали до достижения равновесия (14 суток). Количество непрореагировавшего иона металла определяли тригонометрически.
с различным содержанием ионов металлов и HCl. Раствор перемешивали до достижения равновесия (14 суток). Количество непрореагировавшего иона металла определяли тригонометрически.
В динамических условиях использовали колонку из органического стекла сечением 1,4 ![]() . Загрузка катионита в колонку равнялась 3 г (в пересчете на абсолютно сухую смолу в
. Загрузка катионита в колонку равнялась 3 г (в пересчете на абсолютно сухую смолу в ![]() форме). Скорость фильтрации раствора через слой катионита поддерживалась равной 1
форме). Скорость фильтрации раствора через слой катионита поддерживалась равной 1 ![]() Фильтрация раствора через колонку с катионитом проводилась до уравнивания концентрации элемента в фильтрате и в исходном растворе.
Фильтрация раствора через колонку с катионитом проводилась до уравнивания концентрации элемента в фильтрате и в исходном растворе.
Для изучения механизма сорбции ионов металлов был использован метод ИК спектроскопии. Запись спектров смол в ![]() и
и ![]() -формах, а также содержащих ионы металлов проводили на двухлучевом спектрофотометре UR-20 в области 700–3800
-формах, а также содержащих ионы металлов проводили на двухлучевом спектрофотометре UR-20 в области 700–3800 ![]() с призмой из NaCl. Образцы для записи ИК спектров готовили в виде таблеток прессованием с
с призмой из NaCl. Образцы для записи ИК спектров готовили в виде таблеток прессованием с ![]() с концентрацией по исследуемому веществу 0,7% (вес.) или суспензий в вазелиновом масле.
с концентрацией по исследуемому веществу 0,7% (вес.) или суспензий в вазелиновом масле.
Обсуждение результатов
Сорбция ионов катионитом будет определяться значениями рН исходных растворов. Значительное влияние на механизм сорбции оказывают процессы комплексообразования в растворе. Исследование поведения ионов иттрия, бария и меди в хлоридных растворах показывает, что ионы существуют в виде положительных и отрицательно заряженных хлоридных и гидроксокомплексов, а также нейтральных молекул [5]. Это приводит к понижению величины сорбируемости с увеличением концентрации HCl. Величина сорбируемости существенно зависит от кислотности раствора и ионной формы катионита. На рисунке 1а показано влияние концентрацииHCl на сорбцию ионов исследованных ионов металлов катионитом КФП-12. Наблюдаемое резкое снижение сорбции ионов иттрия, бария и меди связано с увеличением доли нейтральных молекул и отрицательно заряженных комплексов.
Количество сорбированных ионов в значительной степени зависит от ионной формы катионита [6]. Величина сорбируемости для аммонийной формы катионита больше, чем для водородной формы. Это связано с тем, что при использовании катионита в ![]() -форме в процессе сорбции ионы аммония будут вытесняться катионом металла и водорода. Одинаковая закономерность сорбируемости для исследованных ионов металлов катионитом от содержания соляной кислоты объясняется тем, что в кислой среде подавляется диссоциация фосфорнокислых групп.
-форме в процессе сорбции ионы аммония будут вытесняться катионом металла и водорода. Одинаковая закономерность сорбируемости для исследованных ионов металлов катионитом от содержания соляной кислоты объясняется тем, что в кислой среде подавляется диссоциация фосфорнокислых групп.
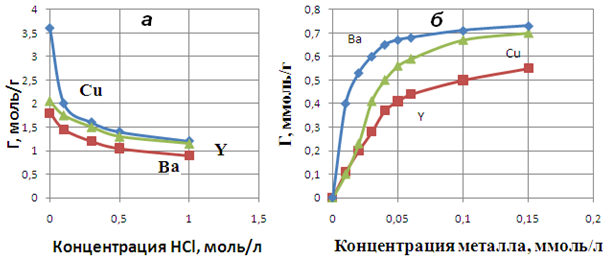
Рис. 1. Влияниеконцентрации HCl (а) (![]() моль/л) и концентрации металла (б) на совместную сорбцию Г (моль
моль/л) и концентрации металла (б) на совместную сорбцию Г (моль ![]() /г катионитом КФП-12 в
/г катионитом КФП-12 в ![]() -форме
-форме
На рисунке 1б представлены зависимости изменения сорбируемости меди, бария и иттрия от концентрации металла при их совместной сорбции. Ионное состояние металлов в растворе позволяет определить условия сорбции того или иного элемента катионитом, а также предположить состав комплексных ионов в фазе последнего.
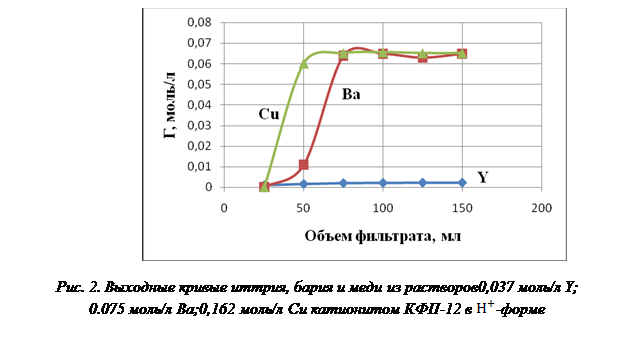
На рисунке 2 представлены выходные кривые совместной сорбции ионов иттрия, бария и меди на фосфорнокислом катионите КФП-12 в ![]() -форме.
-форме.
Выходные кривые совместной сорбции ионов имеют обычный вид. Насыщение катионита КФП-12 ионами бария и меди происходит практически сразу после начала сорбции. Насыщение ионами иттрия протекает постепенно с использованием обменной емкости катионита. Полная обменная емкость по иттрию составляет 4,96 моль/г, бария – 4,84 моль/г и меди — 4,87 моль/г.
При совместной сорбции наблюдается конкуренция ионов металлов в зависимости от размера гидратированного иона. Известно, что чем меньше радиус гидратированного иона, тем он легче проникает в функциональную группу катионита. По величине радиуса гидратированного иона сорбируемые ионы можно расположить в ряд:
![]() ,
,
что коррелирует со значениями величины сорбируемости.
Для установления механизма сорбции ионов иттрия, бария и меди использовался методы ИК спектроскопии. На рисунке 3 представлены ИК спектры фосфорнокислого катионита с сорбированными ионами иттрия, бария и меди.
На спектре катионита (рис. 3а, кривая 3), содержащего ионы меди, появляется полоса поглощения 1060 см-1, характеризующая колебания группы R–H(O)(OH)O-. Это подтверждает, что замещение ионов водорода при сорбции идет только по первой ступени:
![]() .
.
При рН<5,5 в соответствии со ступенчатыми константами диссоциации катионита КФП-12 (![]() =3,43;
=3,43; ![]() =8,88) полная диссоциация фосфоновых групп осуществляется только по первой ступени.
=8,88) полная диссоциация фосфоновых групп осуществляется только по первой ступени.
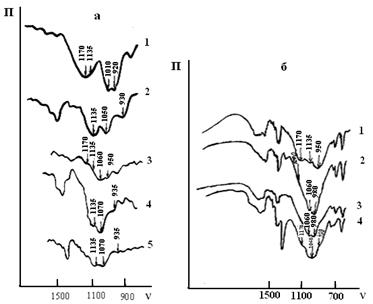
Рис. 3. Инфракрасные спектры катионита КФП-12 в Н+-(1а), NH4+-(2a) формах и после сорбции меди (3, 4а), бария (5а), иттрия (1-4б). П – пропускание (%), ν – частота (![]() )
)
Сорбция ионов меди сопровождается разрывом водородных связей, что проявляется в исчезновении плеча 1210 ![]() и падении интенсивности пика 1175
и падении интенсивности пика 1175 ![]() , характеризующего валентные колебания групп Р=О при наличии водородной связи и координации его с ионом металла. На спектре катионита в NH4+-форме (рис. 3а, кривая 4) наблюдаются резкое уменьшение интенсивности полосы симметричных колебаний групп Р–ОН и сдвиг максимума этого пика к 935
, характеризующего валентные колебания групп Р=О при наличии водородной связи и координации его с ионом металла. На спектре катионита в NH4+-форме (рис. 3а, кривая 4) наблюдаются резкое уменьшение интенсивности полосы симметричных колебаний групп Р–ОН и сдвиг максимума этого пика к 935 ![]() . Наличие полосы 935
. Наличие полосы 935 ![]() указывает на ионную связь сорбированного иона. Образование координационной связи отражается наличием полосы поглощения 1070
указывает на ионную связь сорбированного иона. Образование координационной связи отражается наличием полосы поглощения 1070 ![]() . В связи с этим можно предположить образование следующих структур:
. В связи с этим можно предположить образование следующих структур:
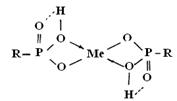
Координационное взаимодействие атома кислорода незамещенных гидроксилов с металлом проявляется в спектре как эффект связывания дополнительного числа гидроксильных групп. Это усиливает полярность связей О–Н в таких гидроксилах и повышает эффективность их водородной связи с группой Р=О, вследствие чего полоса поглощения фосфорильного кислорода смещается в спектрах на 10–15 ![]() в более длинноволновую область. Последнее можно объяснить образованием структур типа:
в более длинноволновую область. Последнее можно объяснить образованием структур типа:
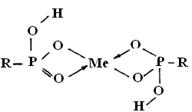
в которых координационное взаимодействие металла происходит с участием атома кислорода фосфорильной группы. Можно предположить, что реальные соединения с ионами металла в матрице катионита представляют собой резонансный гибрид этих двух структур. Ионы бария (рис. 3а, кривая 5) не образуют в изученных условиях координационные соединения с фосфорнокислыми группами катионита. Частоты колебаний ![]() -группы остаются без изменений.
-группы остаются без изменений.
ИК спектры катионита, содержащего ионы иттрия, представлены на рисунке 3б. При сорбции ионов иттрия происходит замещение протона обеих гидроксильных групп катионита. Это подтверждается появлением широкой полосы поглощения 1070 ![]() , характеризующей валентные колебания иона
, характеризующей валентные колебания иона ![]() , и исчезновением полос при 950, 1100 и 1175
, и исчезновением полос при 950, 1100 и 1175 ![]() .
.
Согласно работе [4] при сорбции ионов иттрия возможны следующие структурные формы:
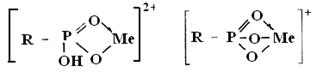
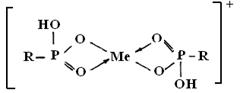
Реакции обмена для иттрия могут быть представлены в следующем виде:
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
По характеру изменения ИК спектров можно утверждать, что энергия координационной связи фосфорильный кислород – ион металла и соответственно селективность сорбции падает в ряду [1]:
Y>Cu>Ba.
Полученные результаты свидетельствуют о различном механизме сорбции ионов иттрия, бария, меди из хлоридных растворов и позволяют предположить, что при образовании полимерных комплексов принимают участие и ионы хлора. Полученные данные хорошо согласуются с литературными данными.
Рецензенты:
Андреев О.В., д.х.н., профессор, заведующий кафедрой неорганической и физической химии ФГБОУ ВПО «Тюменский государственный университет». г. Тюмень;
Морев А.В., д.ф.-м.н., профессор кафедры физики ФГБОУ ВПО «Тюменский государственный архитектурно-строительный университет», г. Тюмень.
Библиографическая ссылка
Пимнева Л.А., Пимнева Л.А. ОСОБЕННОСТИ СОВМЕСТНОЙ СОРБЦИИ ИОНОВ ИТТРИЯ, БАРИЯ И МЕДИ В ФАЗЕ ФОСФОРНОКИСЛОГО КАТИОНИТА // Современные проблемы науки и образования. 2015. № 2-2. ;URL: https://science-education.ru/ru/article/view?id=21611 (дата обращения: 28.02.2026).



