Введение. В настоящее время участие опиоидных пептидов в регуляции висцеральных функций подтверждено многочисленными исследованиями [6], что послужило основанием для использования их синтетических аналогов в клинической практике [1]. Основой физиологических и клинических их эффектов является взаимодействие данной группы пептидов с периферическими опиатными рецепторами, которые обнаружены в висцеральных органах и имеют высокую плотность в структурах ЖКТ [10]. Вероятно, с этим связано то, что первым синтетическим аналогом опиоидных веществ – энкефалинов – стал даларгин, обладающий противоязвенной активностью, реализующий эффекты преимущественно через периферические δ-рецепторы [1]. По химической структуре даларгин (Tyr-D-Ala-Gly-Phe-Leu-Arg) отличается от природного лейцин-энкефалина (Tyr-Gly-Gly-Phe-Leu). В крови даларгин расщепляется на несколько фрагментов, два из которых – N-терминальные пентапептид и тетрапептид – обладают опиоидноподобной активностью [1]. В современной гастроэнтерологии даларгин не является компонентом эрадикационной терапии, однако используется в лечении длительно незаживающих язв, в связи со способностью стимулировать регенерацию, убедительно доказанной в экспериментальных исследованиях [1, 6]. Применение даларгина в кардиологии обусловлено его кардиопротекторным и антиишемическим действием [7]. Кроме того, в последние годы интерес к даларгину возрастает в связи с его широким адаптивным действием и возможностью патогенетической терапии сочетанных заболеваний [2]. Однако механизмы модуляции внутри- и межсистемных взаимоотношений, а также их количественные характеристики остаются не вполне выясненными.
Цель работы: изучить влияние даларгина на электрическую активность гастродуоденального комплекса и сердца в условиях экспериментального язвообразования у крыс.
Методы исследования. Исследование проводили на беспородных белых крысах массой 250–300 г, содержащихся в стандартных условиях вивария медико-биологической клиники КГМУ. В двух группах животных воспроизводили ацетатную модель язвенного повреждения желудка, которая используется для изучения развития и заживления хронических язв [9]. Для этого животных наркотизировали с помощью хлоралгидрата (300 мг/кг в/б), затем после срединной лапаротомиив области антрального отдела желудка производили аппликацию ледяной уксусной кислоты [5, 9]. Затем подсушивали поверхность желудка и ушивали брюшную полость. Животным опытной группы (группа № 3) в течение 3 суток (4–6 сутки после аппликации кислоты) осуществляли внутрибрюшинное введение 0,1 мл раствора даларгина в дозе 0,4 мг/кг, рассчитанной с учётом метаболического коэффициента [8]. Животным контрольной группы (группа № 2) вводили физиологический раствор в том же объеме. Для оценки исходного состояния электрической активности служили ложнооперированные животные, которым производилась срединная лапаротомия без моделирования язвенного повреждения (группа № 1).
На 7-е сутки после моделирования хронического язвенного повреждения желудка животным всех исследуемых групп производили релапаротомию и имплантировали петельчатые серебряные электроды в мышечную оболочку тела желудка (ТЖ), пилорического отдела (ПО) и двенадцатиперстной кишки (ДК). Запись ЭА отделов желудка и двенадцатиперстной кишки проводили путём прямой многоканальной электрогастрографии с использованием многоканального регистратора «Биоскрипт» (BST-1). Анализировали частотные и амплитудные характеристики ЭА гладких мышц желудка и двенадцатиперстной кишки. Синхронно регистрировали ЭКГ с использованием трехканального электрокардиографа BiocareECG-300G в стандартных (I, II, III) и усиленных от конечностей (aVR, aVL и aVF) отведениях.
Полученные данные проверялись на нормальность распределения с использованием тестов Шапиро-Уилка и Колмогорова-Смирнова. Для количественной оценки тесноты связей рассчитывались коэффициенты корреляции Пирсона (в случае нормального распределения) или коэффициенты корреляции Спирмена. На основании данных корреляционного анализа составлялись корреляционные плеяды, позволяющие оценить в целом архитектонику связей в системе ГДК и кардиогастральные связи. Для оценки системной организации ГДК рассчитывались показатели многосторонней скоррелированности [3, 4]. В зависимости от формы распределения для оценки статистической значимости различий между выборками применяли критерии Стьюдента или Манна – Уитни.
Результаты исследования и их обсуждение
На седьмые сутки после воспроизведения ацетатной язвы средние значения частоты ЭА статистически значимо превышали исходные во всех исследуемых отделах гастродуоденального комплекса. Введение даларгина приводило к снижению частоты возникновения импульсов в ТЖ (на 10,5 %, р< 0,05) и ПО (на 13,2 %, р< 0,05). Частота сердечных сокращений (ЧСС) в группе животных с моделью язвенного повреждения значимо отличалась от значений ЧСС у интактных животных и крыс, получавших даларгин (табл. 1).
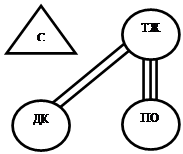
В группе животных с введением даларгина не обнаруживалось значимых коэффициентов корреляции, отражающих тесноту взаимосвязей между ЧХ ДК и отделами желудка. Полученные результаты близки к исходным значениям, где в сопоставлении ПО-ДК также отсутствовали линейные корреляционные связи между ЧХ ПО и ДК, а в сопоставлении ТЖ-ДК они были слабыми (r=0,154*+0,07). В группе животных, которым не вводили даларгин, на седьмые сутки после моделирования язвенного повреждения желудка корреляционные связи ПО желудка с другими исследуемыми отделами ГДК становились более тесными (средние значения r в сопоставлении ТЖ-ПО возрастали с 0,246 + 0,07 ** до 0,619+0,04** (р<0,01), а в сопоставлении ПО-ДК с 0,103+0,07до 0,277+0,06** (р< 0,01)). (рис. 1).
Таблица 1
Значения частоты электрической активности компонентов гастродуоденального комплекса и ЧСС крысы после моделирования ацетатной язвы
|
Частота ЭА компонентов ГДК |
Исходное состояние (группа №1, n = 30) |
После моделирования ацетатной язвы |
|
|
без введения даларгина (группа №2, n = 26 |
с введением даларгина(группа №3, n=27) |
||
|
ТЖ |
1,88 + 0,2 |
3,76+0,09** |
3,37+0,09* |
|
ПО |
2,3 + 0,2 |
4,46+0,10** |
3,87+0,10* |
|
ДК |
1,69 + 0,2 |
2,41+0,07** |
2,31+0,07 |
|
ЧСС |
295,5 (230,0; 333,0) |
267,0 (216,0; 465,0) * |
262,0 (217,0;352,0) * |
Примечания:
1. Для частоты ЭА компонентов ГДК указаны значения М+m.
2. Для ЧСС указаны медиана, 25 и 75 процентили: Ме (25; 75).
3. Статистически значимые различия обозначены:* – р< 0,05; * * – р < 0,01.
 А
А 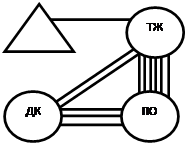 Б
Б 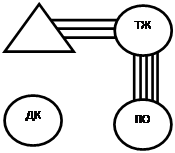 В
В
Рис. 1. Корреляция частотных характеристик электрической активности сердца, отделов желудка и двенадцатиперстной кишки крысы в исходном состоянии (А) и после моделирования язвенного повреждения желудка (Б – без введения даларгина, В – в условиях введения даларгина)
Корреляционный анализ позволил также установить, что при введении даларгина в условиях моделирования язвенного повреждения между ЧСС и ЧЭА ТЖ формировались корреляционные связи средней силы, у животных контрольной группы (с введением 0,9 % р-раNaCl) эти связи были слабыми, а у здоровых животных (в исходном состоянии) отсутствовали (рис.1).
Для оценки системной организации ГДК использовались также показатели многосторонней скоррелированности ЧХ ЭА, которые выявляют «системообразующий вклад» или степень причастности каждого компонента к изучаемой системе [9]. На 7-е сутки после моделирования язвенного повреждения желудка значения показателя многосторонней скоррелированности возрастали дляТЖ на 94, 3 % (р< 0,01), для ПО – на 264,2 % (р<0,01), для ДК – на 182,5 % (р<0,01). а интегральный коэффициент многосторонней скоррелированности ЧХ ЭА увеличивался на 163,5 % (р< 0,01), что указывает на усиление «жесткости» системной организации ГДК (табл. 2).
Таблица 2
Изменение показателей многосторонней скоррелированности (Σr) ЧХ ЭА компонентов ГДК крыс после моделирования ацетатных язв
|
Компоненты ГДК |
Исходное состояние контроль |
После моделирования ацетатной язвы |
|||
|
без введения даларгина |
Сдвиг в% |
с введением даларгина |
Сдвиг в % |
||
|
ТЖ |
0,400+0,07 |
0,777+0,04 |
+94,3** |
0,534+0,05 |
-31,3* |
|
ПО |
0,246+0,07 |
0,896+0,03 |
+264,2 ** |
0,534+0,05 |
-40,4** |
|
ДК |
0,154+0,07 |
0,435+0,04 |
+182,5 ** |
- |
- |
|
Σrинтегр. |
0,800+0,21 |
2,108+0,11 |
+163,5 ** |
1,068+0,10 |
-49,3** |
Примечания:
1. Значения Σr рассчитывались с учетом статистически значимых коэффициентов корреляции.
2. Статистически значимые различия обозначены:* – р< 0,05; * * – р < 0,01.
В группе животных, получавших даларгин, многосторонняя скоррелированность была выше по сравнению со здоровыми животными лишь в ПО желудка (на 117,1 %, р< 0,01), в ТЖ она не отличалась от значений контрольной группы, а в ДК уменьшалась вплоть до отсутствия значимых показателей многосторонней скоррелированности. Следует обратить внимание на то, что интегральные коэффициенты многосторонней скоррелированности ЧХ ЭА группы животных, получавших даларгин (0,800+0,21), и здоровых животных (1,068+0,10) не обнаруживали статистически значимых различий (табл. 2).
Средние значения амплитуды ЭА всех исследуемых отделов ГДК у животных с моделью язвообразования (группа № 2) превышали исходные: в ТЖ на 28,3 % (р< 0,05), в ПО – на 43,6 % (р< 0,05), в ДК – на 29,8 % (р< 0,05). Введение даларгина приводило к значимому возрастанию амплитудных значений ЭА в ПО желудка на 23,7 % (р< 0,01) и тенденции к их снижению в ДК у крыс группы № 3 (рис. 2). Обнаруженные факты могут быть связаны с распределением опиатных рецепторов в оболочках и интрамуральных сплетениях желудка и двенадцатиперстной кишки крысы [10].
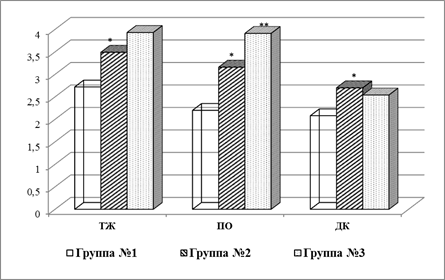
Рис. 2. Изменение амплитуды электрической активности компонентов гастродуоденального комплекса крыс после моделирования ацетатной язвы
Примечание: статистически значимые различия обозначены: * – р< 0,05; ** – р < 0,01.
Корреляционный анализ амплитудных значений ЭА также подтверждает возрастание их скоррелированности по сравнению с исходными данными на седьмые сутки после моделирования язвенного повреждения между ТЖ и ПО (средние значения r возрастали на 134,6 % (р<0,05), а также между ТЖ и ДК (значения r становились значимыми 0,171*+0,06) (рис. 3).
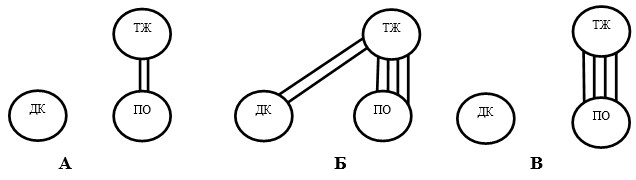
Рис. 3. Корреляция амплитудных характеристик электрической активности отделов желудка и двенадцатиперстной кишки крысы в исходном состоянии (А) и после моделирования язвенного повреждения желудка (Б – без введения даларгина, В – в условиях введения даларгина)
В группе животных, которым вводили даларгин, сохранялись лишь корреляционные связи средней силы между отделами желудка (r=0,401**+0,05) (рис. 3).
При анализе показателей многосторонней скоррелированности амплитудных значений ЭА между компонентами ГДК наиболее высокая суммарная скоррелированность была обнаружена в группе животных с моделью язвенного повреждения, не получавших даларгин
(табл. 3).
Таблица 3
Изменение показателей многосторонней скоррелированности (Σr) АХ ЭА компонентов ГДК крыс после моделирования ацетатных язв
|
Компоненты ГДК |
Исходное состояние
|
После моделирования ацетатной язвы |
|||
|
без введения даларгина |
Сдвиг в% |
с введением даларгина |
Сдвиг в% |
||
|
ТЖ |
0,171+0,07 |
0,543+0,05 |
+217,5** |
0,401+0,05 |
-26,2 |
|
ПО |
- |
0,372+0,05 |
- |
- |
- |
|
ДК |
- |
- |
- |
- |
- |
|
Σrинтегр. |
0,171+0,07 |
0,915+0,02 |
+435,1** |
0,401+0,05 |
-56,2** |
Примечания: см. табл. 2.
Введение даларгина приводило к её снижению, что подтверждает уменьшение жесткости системы за счет снижения скоррелированности между ее компонентами.
Заключение. В данном экспериментальном исследовании выявлено, что у животных в условиях моделирования язвенного повреждения желудка на седьмые сутки ЭА гладких мышц желудка и двенадцатиперстной кишки выше по сравнению с интактными животными. Это проявляется в увеличении средних значений амплитуды и частоты ЭА во всех исследуемых отделах гастродуоденального комплекса. Введение даларгина приводило к снижению частоты ЭА в ТЖ и ПО и возрастанию амплитуды ЭА в ПО желудка. Полученные результаты согласуются с известными данными о распределении опиатных рецепторов в желудочно-кишечном тракте крысы [10] и могут служить подтверждением активации центров связывания δ- лигандов, локализованных в слое циркулярных мышц.
Однако более информативными для данного исследования явились данные корреляционного анализа, которые позволили установить, что введение даларгина приводило к уменьшению скоррелированности ЧХ между отделами желудка и утрате корреляционных связей между исследуемыми отделами желудка и двенадцатиперстной кишкой. В то же время увеличивались средние значения коэффициентов корреляции между показателями ЧСС и частотой ЭА фундального отдела желудка.
Полученные результаты свидетельствуют об участии опиоидных структур в интегративных механизмах регуляции кардиогастральных взаимоотношений и механизмах адаптации гастродуоденального комплекса к повреждающим воздействиям.
Рецензенты:
Бобынцев И.И., д.м.н., профессор кафедры патологической физиологии Курского государственного медицинского университета, г. Курск;
Дронова Т.А., д.м.н., профессор кафедры пропедевтики внутренних болезней Курского государственного медицинского университета, г. Курск.
Библиографическая ссылка
Привалова И.Л., Камал Э.Т., Брусенцев И.А., Егельская Л.А. МОДУЛИРУЮЩЕЕ ВЛИЯНИЕ ДАЛАРГИНА НА ЭЛЕКТРИЧЕСКУЮ АКТИВНОСТЬ ГАСТРОДУОДЕНАЛЬНОГО КОМПЛЕКСА И СЕРДЦА В УСЛОВИЯХ ЭКСПЕРИМЕНТАЛЬНОГО ЯЗВООБРАЗОВАНИЯ У КРЫС // Современные проблемы науки и образования. 2015. № 2-1. ;URL: https://science-education.ru/ru/article/view?id=17494 (дата обращения: 05.01.2026).



