В настоящее время одну из важных ролей в регрессии опухолей отводят активным формам кислорода и азота. Оксид азота и его метаболиты являются сильным цитотоксическим оружием иммунной системы, оказывающим как прямое повреждающее действие на клетки, так и косвенное, путем регуляции клеточного цикла и процессов клеточной гибели.
Оксид азота (NO) является важным регуляторным фактором, участвующим в индукции апоптоза [4], пролиферации клеток [2] и тонуса сосудов [3]. В то же время активные метаболиты азота наряду с активными формами кислорода способны повреждать различные клеточные структуры, изменяя их функциональную активность. Так, процесс нитрозилирования белков под действием активных форм азота является одним из механизмов регуляции активности некоторых ферментных систем [7]. Следует отметить, что некоторые метаболиты NO, такие как S-нитрозотиолы и сам NO, при определённых условиях могут проявлять антиоксидантную активность [5]. Например, оксид азота может связываться с ионами железа, которые катализируют реакции свободно-радикального окисления.
Различные исследования показали роль NO в индукции генотоксического повреждения, а также его участие в продвижении опухоли и прогрессии от посреднических важных процессов, в том числе ангиогенеза, роста опухолевых клеток, и инвазии [6]. При этом оксид азота является важным компонентом иммунной реакции при росте некоторых типов опухолей, например, защищает от рака толстой кишки у мышей [10]. Высокие уровни NO обладают сильной генотоксичностью через образование канцерогенных нитрозаминов или путём повреждения систем репарации ДНК [8]. Однако NO также способен и уменьшать воздействие активных форм кислорода на ДНК [9].
Асцитная гепатома Зайдела является перевиваемой культурой и при её трансплантации в брюшную полость развивается асцитная форма опухоли, которая представляет собой клеточные комплексы и отдельные клетки, растущие в сильно геморрагической асцитической жидкости. Эта культура является удобной моделью исследования действия противоопухолевых препаратов на рост опухоли в организме. Однако доля исследований, посвященных изучению изолированных клеток данной опухоли in vitro в настоящее время незначительна. В данной работе было исследовано действие различных концентраций экзогенного донора оксида азота SNP на выживаемость клеток асцитной гепатомы Зайдела, культивируемых в питательной среде.
Материалы и методы исследования.
Для формирования опухоли использовали клетки асцитной гепатомы Зайдела, хранящиеся в криобанке. Клетки трансплантировали в брюшную полость крысы путем введения 0,8 мл клеток в количестве 1•107 кл/мл. Образовавшеюся асцитную жидкость отбирали на 5 сутки после трансплантации, центрифугировали при 400g в течение 10 мин., затем отмывали 2 раза в растворе NaCl (0,9%). Отмытые клетки наслаивали на градиент Percoll – NaCl c плотностями 1,04, 1056 и 1,078 г./мл. и центрифугировали 40 мин при 4000g. Далее отбирали шприцом слой опухолевых клеток на границе плотности 1,056 г./мл., Фракцию клеток промывали 2 раза средой DMEM. Эксперименты проводили в культуральных планшетах в среде DMEM c 10% эмбриональной телячьей сывороткой при 37°C, концентрация CO2 - 5%. Объем среды культивирования 0,7 мл, начальная концентрация клеток 106 кл./мл. Подсчет клеток проводили в камере Горяева. Определение жизнеспособности клеток осуществляли по окраске трипановым синим. Клеточный цикл регистрировали с помощью проточной цитометрии с окрашиванием пропидиумиодитом (PI). Для этого клетки гепатомы Зайдела фиксировались 70% С2Н5OH. Пробы центрифугировали 10 минут при 400g, удаляли спиртовую фракцию и добавляли 500мкл 0,0035% раствора (Pl) и 500 мкл 0,0035% раствора РНКазы в фосфатном буфере. Пробы инкубировали в термостате 30 минут при температуре 37°C. Затем проводили исследование на проточном цитофлюориметре (Partec PAS III, Германия)
Результаты исследования и их обсуждение
Для проведения исследования опухолевые клетки отбирались из асцитной жидкости экспериментального животного на II фазе развития экспериментальной опухоли. В этот период наблюдается интенсивный рост популяции клеток гепатомы Зайдела, а патологический процесс в организме не перешёл в необратимую фазу и, следовательно, ещё актуально проведение противоопухолевой терапии [1]. Выделенные клетки являются переживающей культурой и длительное их культивирование in vitro невозможно. В связи с этим эксперимент ограничен 24ч.
На рис. 1 представлены кривые роста асцитной гепатомы Зайделя в присутствие различных концентраций донора оксида азота SNP. Как видно из рисунка в процессе культивирования контрольных клеток гепатомы (в отсутствие SNP) в течение первых 12ч. наблюдается рост концентрации опухолевых, сменяемый устойчивой гибелью клеток при дальнейшем культивировании. При внесении в среду культивирования источника оксида азота (нитропрусида натрия - SNP) был отмечен нелинейный эффект действия различных концентраций данного соединения. Так при концентрации SNP ~0,02 мМ через 12 часов культивирования наблюдается достоверное увеличение количества клеток гепатомы по сравнению с контрольным образцом. По-видимому, данный эффект обусловлен активирующим воздействием данной концентрации SNP на пролиферативную активность клеток. При дальнейшем культивировании клеток эффект SNP несколько снижается и к 24 часам концентрация клеток практически не отличалась от контрольных значений. При дальнейшем ступенчатом увеличении концентрации донора NO до 0,2мМ, 1мМ и 2мМ количество опухолевых клеток в единице объема дозозависимо снижалось, что свидетельствует о цитотоксическом эффекте (рис 1, кривые 3,4 и 5).
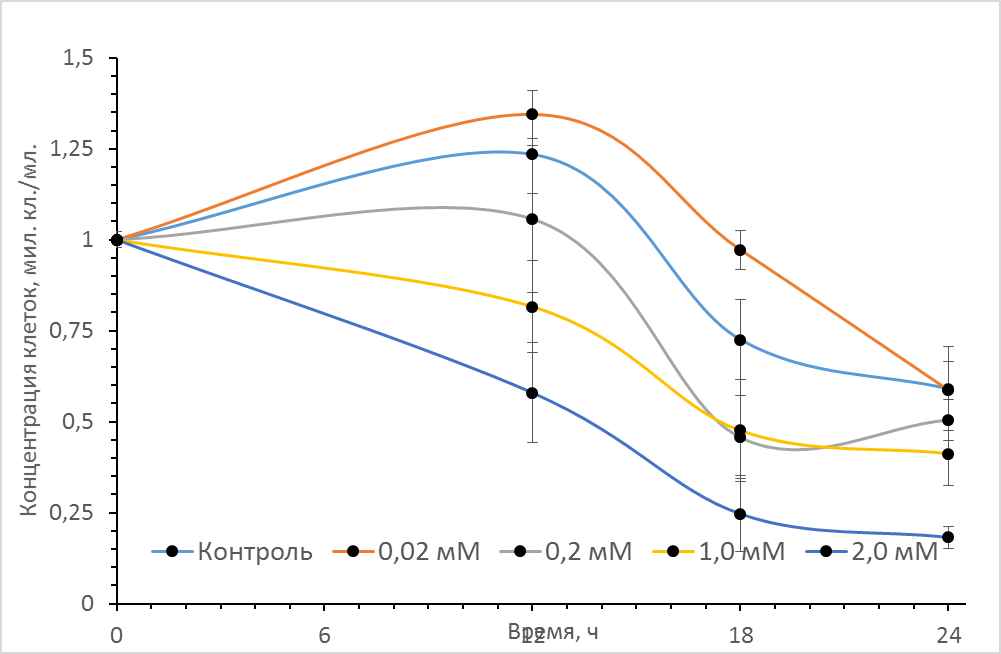
Рис. 1 Влияние различных концентраций донора оксида азота (SNP) на рост клеток асцитной гепатомы Зайдела. Культивирование проводилось в культуральных планшетах в среде DMEM c 10% эмбриональной телячьей сывороткой при 37°C, концентрация CO2 - 5%. Объем среды культивирования 0,7 мл, начальная концентрация клеток 106 кл./мл. Аналогичные результаты были получены в пяти независимых экспериментах.
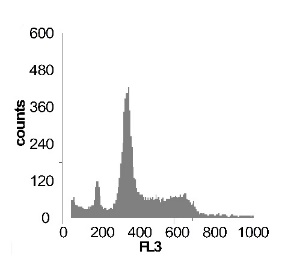
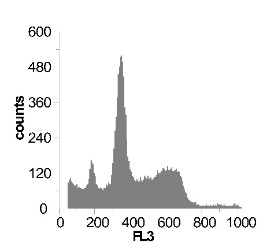
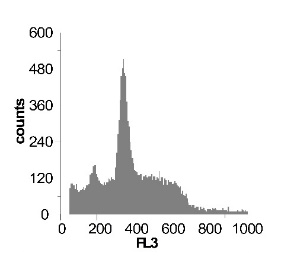
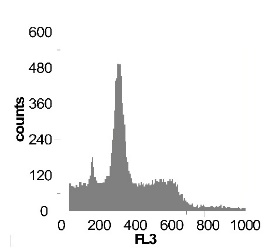
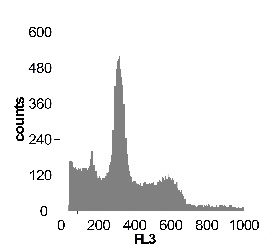
Используя метод проточной цитофлуориметрии, было исследовано состояние клеточного цикла опухолевых клеток по истечению 12 ч культивирования. Обнаружено, что с ростом концентрации SNP в среде культивирования увеличивается sub-G1 область на гистограмме клеточного цикла (рис 2), что говорит об увеличение фрагментации ДНК, и как следствие, гибели клеток. Это свидетельствует о цитотоксической активности SNP по отношению к клеткам гепатомы, обусловленной способностью оксида азота индуцировать апоптоз.
Наряду с цитотоксическим воздействием SNP на клетки гепатомы обнаружено, что при концентрации SNP ~ 0,02 мМ увеличивается доля клеток, находящихся в S и G2/M фазах клеточного цикла, что говорит об активации клеточного деления. Это увеличение пролиферативной активности не только компенсирует цитотоксический эффект SNP, но и позволяет увеличить популяцию клеток гепатомы в течении первых 12-18 ч культивирования. Дальнейшее увеличение концентрации донора оксида азота до 0,2мМ приводит к увеличению доли клеток в предмитотической фазе S и снижению в G2/M. В результате этого цитотоксический эффект уже не полностью компенсируется, что подтверждается снижением выживаемости клеток гепатомы Зайдела при культивировании (рис. 2) Дальнейшее увеличение концентрации SNP приводит к увеличению гибели клеток, причем, в основном, за счет находящихся в S и G2/M фазах клеточного цикла.
|
Контроль |
SNP |
|||
|
|
|
|
|
|
|
- |
0,02мМ |
0,2мМ |
1,0мМ |
2,0мМ |
|
|
|
|
|
|
|
|
контроль |
SNP 0,02 мМ |
SNP 0,20 мМ |
SNP 1,00 мМ |
SNP 2,00 мМ |
|
Sub-G1 |
16,7% |
19,7% |
22,6% |
23,3% |
28,9% |
|
G1 |
51,7% |
44,7% |
45,3% |
48,0% |
45,6% |
|
S |
13,0% |
13,6% |
16,0% |
13,0% |
11,1% |
|
G2/M |
18,6% |
22,0% |
16,1% |
15,7% |
14,4% |
Рис. 2 Анализ клеточного цикла клеток асцитной гепатомы Зайдела, инкубированных в присутствии SNP с концентрациями 0,02 мМ ; 0,2 мМ ; 1,0 мМ ; 2,0 мМ. Клетки окрашивали PI после 12 часов культивирования. Клеточный цикл представлен как процент клеточной популяции в различных фазах (sub-G 1; G1; S; G2/M) За мертвые клетки принимали sub-G1 область гистограммы. Аналогичные результаты были получены в пяти независимых экспериментах.
На основании полученных данных можно сделать вывод, что концентрация донора оксида азота SNP больше 0,2мM оказывает цитотоксический эффект по отношению к клеткам гепатомы Зайдела в условиях in vitro. При этом в значительной мере снижется доля делящихся клеток. Подобный эффект является поводом для использования доноров оксида азота как противоопухолевого агента в комплексной терапии онкологических заболеваний. Однако надо учитывать, что концентрации SNP ниже 0,2 мМ, напротив, увеличивают пролиферации клеток и, следовательно, способствуют расту опухоли.
Рецензенты:
Новоселова Е.Г., д.б.н., профессор, ведущий научный сотрудник лаборатории механизмов рецепции ФГБУН Института биофизики клетки РАН, г. Пущино;
Асланиди К.Б., д.ф.-м.н., ведущий научный сотрудник лаборатории биофизики внутриклеточной регуляции ФГБУН Института теоретической и экспериментальной биофизики РАН, г. Пущино.
Библиографическая ссылка
Куприянова Е.С., Наумов А.А., Поцелуева М.М., Куприянова Е.С., Наумов А.А., Серебрякова Л.Т., Поцелуева М.М. ВЛИЯНИЯ РАЗЛИЧНЫХ КОНЦЕНТРАЦИЙ ДОНОРА ОКСИДА АЗОТА SNP НА ВЫЖИВАЕМОСТЬ КЛЕТОК АСЦИТНОЙ ГЕПАТОМЫ ЗАЙДЕЛА IN VITRO // Современные проблемы науки и образования. 2014. № 6. ;URL: https://science-education.ru/ru/article/view?id=16119 (дата обращения: 19.02.2026).