Введение
В системе стресс-лимитирующих механизмов определенное место занимают антиоксидантные факторы неспецифической защиты [1, 4].
В целях выяснения характера неспецифического действия на систему крови относительно низких концентраций химических веществ нами изучался широко распространенный в практике антиокислитель– 2,6-ди-трет-бутил-п-крезол, бутилированный окситолуол, алкофен БП, бибунол (ионол) [3]. В связи с тем, что многие патологические процессы и стрессовые состояния в организме сопровождаются кислородным голоданием тканей, параллельно нами было исследовано действие ионала в норме и в условиях гипоксии [2].
Материал и методы исследования
В качестве гипоксии использовалась экспериментальная модель – постгеморрагическая анемия, которая вызывалась путем одномоментной некомпенсированной кровопотерей. Кровопускание производилось из краевой ушной вены кроликов породы «Шиншилла» способом надреза из расчета 20% от массы крови. Общее количество крови в организме кролика определялось исходя из массы тела (5,4%). Экспериментальные животные получали небольшие дозы препарата внутримышечно в течение 10 дней ежедневно. В совокупности были составлены следующие группы:
I -группа: 150 мг/кг ионола ( п-10).
II -группа: 100 мг/кг ионола ( п-10).
III -группа: 60 мг/кг ионола ( п-10).
IV -группа: животные после кровопотери (контроль) ( п-10).
Используемый диапазон концентрации ионола был ориентирован на установление негативной, интактной и лечебной для организма доз препарата. Исследование крови производилось в исходном состоянии и через 1, 3, 5, 7, 9, 10 суток при инъекции изучаемого вещества, а в опытах с кровопотерей – в исходном состоянии и через 1, 3, 5, 7, 9, 11, 13, 15 суток с начала введения препарата.
Определение достоверности различий количественных показателей проводилось по t– критерию Стьюдента [5].
Результаты исследования
Дозы ионола, соответствующие 60, 100 мг/кг, достоверных сдвигов в показателях периферической крови не вызывали (Р>0,05), (Р<0,05). При введении ионола в концентрации 150 мг/кг были отмечены достоверные изменения со стороны форменных элементов циркулирующей крови (табл. 1). Уже на 2-3 сутки опыта количество эритроцитов начинало уменьшаться и на 10 сутки принимало минимальное выражение. Дефицит эритрона в этот срок в среднем равнялся 1,0х1012/л (22,2%) (Р<0,05) и одновременно сопровождался ретикулоцитозом (Р<0,05). Количество ретикулоцитов на 10 сутки увеличилось и составило 36,3%. Содержание гемоглобина в крови у подопытных животных имело тенденцию к уменьшению. Как и у других показателей красной крови, количество гемоглобина наиболее заметно снижалось на 10 сутки. Дефицит содержания гемоглобина в этот срок в среднем составлял 2,0% (Р<0,05). Общий объем эритроцитов (по гематокриту) постепенно уменьшался и на 10 сутки принимал минимальную величину (в среднем 25,4 ед. Р<0,05)). Средний диаметр эритроцитов подопытных кроликов имел тенденцию к уменьшению, и на 10 сутки опыта в среднем равнялся 6,1 мк (Р<0,05). При этом нормоциты составляли 46,1% (6,0 – 7,0 мк), макроциты – 24,3% (7,1 – 8,5), микроциты – 29,6% (5,9 – 4,8 мк) (Р<0,05). Итак, по сравнению с исходным состоянием увеличивался уровень анизоцитоза, больше стало макроцитов и микроцитов при соответствующим снижении относительного числа нормоцитов (табл. 1).
Следовательно, концентрация ионола в дозе 150 мг/кг обусловливала эритроцитопению, ретикулоцитоз, микроцитоз, анизоцитоз и снижение содержания гемоглобина в крови, особенно в 1 эритроците.
Параллельное изучение лейкоцитов крови кроликов при введении ионола 150 мг/кг показало определенные изменения как количественного, так и качественного характера. Они носили обратно пропорциональный характер количественным изменениям красной крови. Наибольшему дефициту эритрона соответствовало максимальное повышение количества лейкоцитов. На 10 сутки опыта число лейкоцитов по сравнению с исходным уровнем повышалось в среднем на 2,4 х 109/л. (Р<0,05).
Таблица 1
Показатели крови кроликов при введении ионола-150 мг / кг
(М ± m; п-10; *- Р < 0,05 в сравнении с исходным уровнем )
|
Показатели крови |
Исходный уровень |
1 сут |
3 сут. |
5 сут. |
7 сут. |
9 сут. |
10 сут. |
|
Эритроциты (х1012 /л) |
4,7±0,08 |
4,4±0,07* |
4,2±0,06* |
4,1±0,06* |
3,9±0,05* |
3,7±0,07* |
3,7±0,6* |
|
Гемоглобин крови (г%) |
10,8±0,21 |
10,1±0,22 |
9,6±0,19* |
9,5±0.18* |
9,3±0,22* |
8,7±0,19* |
8,8±0,18* |
|
Средн.конц.гемогл. в 1 эр-те (г/л) |
22,9±0,5 |
22,9±0,6 |
22,8±0,4 |
23,2±0,6 |
23,8±0,7 |
23,5±0,6 |
23,8±0,7 |
|
Средн.содерж.гемогл.в 1 эр-те(рг) |
270,2±5,9 |
261,1±5,8 |
249,8±5,4 |
241,5±5,5 |
236,7±5,6 |
231,3±5,4 |
228,6±5,5 |
|
Ретикулоциты (%о) |
30,5±0,61 |
28.4±0,57* |
29,5±0,58 |
33,8±0,63* |
35,1±0,65* |
36,2±0,62* |
36,3±0,66* |
|
Лейкоциты х109/л) |
6,4 ±0,11 |
6,9±0,13* |
7,1±0,15* |
7,4±0,16* |
7,9±0,14* |
8,1±0,12* |
8,8±0,16 |
|
Гематокрит ус.ед.) |
29,1±0,58 |
28,2±0,55 |
27,8±0,59* |
26,1±0,54* |
25,9±0,55* |
25,7±0,58* |
25,4±0,53* |
|
Ср.диам.эритр.(мкм) |
6.6±0,12 |
6,2±0,13* |
7,1±0,15* |
6,5±,11 |
6,2±0,13* |
6,1±0,14* |
6,1±0,11* |
|
Нормоциты (%) |
69,2±1,2 |
66,3±1,1* |
58,6±0,9* |
62,4±1,3* |
55,4±1,1* |
47,3±1,3* |
46,1±0,8* |
|
Макроциты (%) |
13,3±0,26 |
18,±,29* |
23,3±0,31* |
19,±,28* |
19,5±0,27* |
28,±,29* |
24,3±0,32* |
|
Микроциты (%) |
17,5±0,35 |
15,2±0,31* |
18,1±0,37 |
17,7±0,34* |
25,1±0,29* |
26,3±0,32* |
29,6±0,39* |
|
СГК гликогена (пседоэозинофилы) |
2,29±0,04 |
2,28±0,03 |
2,15±0,02* |
2,11±0,03* |
2,14±0,03* |
1,96±0,04* |
1,93±0,03* |
|
СГК миелоперокс. (псевдоэозиноф.) |
2,9±0,06 |
2,9±0,05 |
3,1±0,07* |
3,1±0,08* |
3,2±0,07* |
3,2±0,05* |
3,3±0,07* |
|
СГК шелочной фосфатазы (псевдоэозиноф.) |
0,38±0,008 |
0,39±0,007 |
0,41±0,009* |
0,41±0,007* |
0,42±0,006* |
0,43±0,007* |
0,43±0,007* |
Таблица 2
Лейкоцитограмма при действии ионола-150 мг/кг
(М ±m; n-10; *-Р < 0,05 в сравнении с исходным уровнем)
|
Виды лейкоцитов (%) |
Исходный уровень |
3 сут. |
7 сут. |
10 сут. |
|
Базофилы |
2,5±0,048 |
2,2±0,042* |
2,1±0,041* |
1,1±0,038* |
|
Эозинофилы |
0.4±0,007 |
0,2±0,005* |
0,2±0,004* |
0,5±0,008* |
|
Псевдоэозинофилы юные |
- |
- |
0.2±0,003 |
0,7±0,009 |
|
Псевд.палочкоядерные |
0,9±0,018 |
2,3±0,032* |
2,3±0,036* |
2,8±0,039* |
|
Псевд.сегментоядерные |
31,2±0,63 |
31,9±0,67 |
31,3±0,61 |
30,8±0,59 |
|
Лимфобласты |
0,3±0,006 |
0,7±0,014* |
1,3±0,028* |
1,6±0,031* |
|
Пролимфоциты |
9,1±0,17 |
9,7±0,19* |
10,1±0,21* |
11,9±0,25* |
|
Лимфоциты |
49,7±0,91 |
46,2±0,98* |
43,8±0,83* |
42,3±0,87* |
|
Моноциты |
5,1±0,11 |
5,1±0,12 |
6,±,14* |
7,2±0,16* |
|
Деструкт.лейкоциты |
0,8±0,016 |
1,6±0,021* |
1,8±0,029* |
2,2±0,031* |
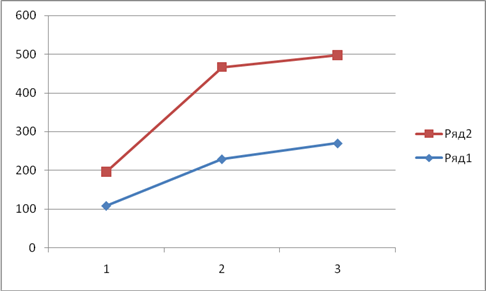
Рис.1. Показатели гемоглобина при введении ионола – 150мг/кг.
Ряд 1 – через 10 суток. Ряд 2 – исходный уровень.
1 – гемоглобин крови (г/л).
2 – средняя концентрация гемоглобина в 1 эритроците (г/л).
3 – среднее содержание гемоглобина в 1 эритроците (рг)
Цитохимические исследования при введения ионола (150, мг/кг) показали снижение содержания гликогена и некоторое повышение активности ферментов пероксидазы и щелочной фосфатазы в псевдоэозинофилах, что отражает усиление внутриклеточного обмена (Р<0,05) (табл. 1). В лейкоцитограмме наблюдалось увеличение относительного числа псевдоэозинофилов, моноцитов, деструктивных лейкоцитов (Р<0,05) при соответствующем понижении содержания лимфоцитов (Р<0,05). Одновременно происходил сдвиг «влево» в нейтрофилограмме и лимфоцитограмме (Р<0,05) (табл.2).
Процентное содержание деструктивных лейкоцитов в периферической крови здоровых кроликов составляло в среднем 0,8%. В условиях введения ионола относительное число их повышалось. На 10 сутки оно приобретало максимальное значение в среднем 2,3% (Р<0,05). Это происходило в состоянии наибольшего дефицита эритрона. Повышенное содержание деструктивных лейкоцитов периферической крови в условиях гипоксии, обусловленной введением ионола, отражало более высокий уровень обновления белой крови вследствие более быстрого изнашивания и альтерации в связи с функциональным напряжением. Таким образом, в периферической крови кроликов, как в норме, так и в эксперименте, циркулировало некоторое количество деструктивных лейкоцитов, которые отражали резорбтивную фазу физиологической, а также репаративной регенерации белой крови. Разные формы деструктивных лейкоцитов обуславливались, во-первых, преобладанием одного из стереотипных процессов клеточной альтерации – коагуляции и колликвации, а во-вторых, неравномерным распадом ядра и цитоплазмы. Существовала прямо пропорциональная зависимость между числом деструктивных лейкоцитов в циркулирующей крови и лейкоцитарной реакцией. Усиление регенерации белой крови сопровождалось повышением числа деструктивных лейкоцитов. Некробиозу лейкоцитов предшествовали дистрофические изменения внутриклеточных структур. Наиболее ранние деструктивные изменения возникали в митохондриях и эндоплазматическом ретикулуме. Однако определенные дистрофические изменения в лейкоцитах могли быть проявлением репарации структурных элементов клетки и носить обратимый характер.
Следовательно, применение антиокислителей небезразлично для организма. В физиологических концентрациях биоантиоксиданты необходимы для осуществления ферментативного окисления клеточного дыхания и, как правило, или стимулирует, или нормализует его. Однако при длительном действии относительно высоких концентраций антиокислителей может наступить снижение синтеза в организме собственных антиоксидантов, что повлечет усиление свободнорадикального окисления. Но и чрезмерное преобладание биологического окисления при резком угнетении свободнорадикального окисления может привести к нарушению постоянства уровня суммарной антиокислительной активности тканей, что служит одним из основных условий физиологического гомеостаза. Кроме того, некоторые продукты переокисления, в частности, перекиси липидов, являются промежуточными продуктами гормонов, простогландина Е и прогестерона. Они также участвуют в гидроксилировании астероидного ядра холестерина. Перекиси, образовавшиеся в результате неферментативного окисления, могут выступать в роли неспецифических участков обмена, например, в фаго- и пиноцитозе, регулируя проницаемость мембран лизосом. Таким образом, значительное и длительное изменение антиокислительного эффекта определяется не количеством антиокислителя, а тем, насколько фактически удается усилить систему естественных тканевых биоантиокислителей.
Многие патологические процессы в организме сопровождаются кислородным голоданием тканей. При этом часто изменяется соотношение биологического ферментационного и свободнорадикального окисления. В связи с этим нами было предпринято исследование действия ионола в условиях гипоксии. Для этого была создана экспериментальная модель циркуляторно гипоксии – постгеморрагическая анемия. Анемизированным животным вводились небольшие дозы – 30 мг/кг, которые в целом оказывали благоприятное действие на течение анемии и восстановление крови.
Изучение состояния красной крови показало, что через 3 суток после кровопускания среднее количество эритроцитов составляла 2,8х1012/л, тогда как при введении 30 мг/кг ионола оно соответствовало 3,5х1012/л, (Р<0,05), что указывает на значительное снижение уровня дефицита эритрона. В последующие сутки опыта темпы восстановления количества эритроцитов у животных, получавших ионол, заметно ускорились по сравнению с контрольной группой. Так, через 15 суток после кровопускания число эритроцитов в крови у контрольной группы в среднем равнялась 3,9х1012/л, тогда как при введении ионола в дозе 30 мг/кг этот показатель соответствовал 4,4х1012/л. (Р<0,05).
Таблица 3
Показатели крови кроликов при введении ионола-30 мг/кг после кровопотери
(М±m ; n-10; *- р<0,05 в сравнении с исходным уровнем)
|
Показатели крови |
Исходн. уровень |
1 сут. |
5 сут. |
7 сут. |
9 сут. |
11 сут |
15 сут. |
|
Эритроциты (х1012 /л) |
4,7±0,11 |
3,4±0,08* |
3,3±0,1* |
3,6±0,09* |
3,7±0,07* |
3,7±0.08* |
3,9±0,09* |
|
Эритроциты (х1012 /л)-ионол |
4,6±0,09 |
3,6±0,07* |
3,7±0,08* |
4,1±0,08* |
4,4±0,11* |
4,4±0,12* |
4.4±0,11* |
|
Гемоглобин (г%) |
11,7±0,21 |
2,6±0,18* |
7,7±0,15* |
8,1±0,16* |
8,6±0,19* |
8.7±0,08* |
10,1±0,19* |
|
Гемоглобин (г%)-ионол |
11,6±0,19 |
8,2±0,15* |
88,2±0,17* |
8,8±0,18* |
9,3±0,18* |
9,8±0,17* |
10,9±0,18* |
|
Гематокрит (ус.ед.) |
29,3±0,61 |
22,1±0,55* |
17,9±0,51* |
18,8±0,52* |
20,1±0,51* |
23,8±0,53* |
26,9±0,58* |
|
Гематокрит (ус.ед.)-ионол |
29,5±0,59 |
25,9±0,61* |
27,5±0,57* |
27,3±0,62* |
27,8±059* |
28,1±0,56* |
28,9±0,6* |
|
Ретикулоциты (%о) |
29,9±0,68 |
25,6±0,53 |
41,1±0,72* |
34,2±0,73* |
31,1±0,71* |
30,8±0,61* |
30,1±0.66* |
|
Ретикулоциты (%о)-ионол |
30,2±0,66 |
29,1±0,59 |
44,.5±0,72 |
47,1±0,64* |
45,2±0,69* |
41,8±0,58* |
41,2±0,61* |
Таблица 4
Коэффициенты парной корреляции по шкале отношений (r-факт.) после кровопускания и введения ионола 30 мг/кг
|
Сроки исследования |
Эритроциты-лейкоциты |
Эритроциты-гемоглобин |
Эритроциты-ретикулоциты |
Критич.коэфф.корреляции 5% значимости (r крит) (К=10-2) [4]. |
|
Исходное состояние |
< 0,813 |
< 0, 904 |
< 0,731 |
0,63 |
|
Через 5 суток |
< 0,905 |
< 0,776 |
< 0,739 |
0,63 |
|
Через 10 суток |
< 0,794 |
< 0,862 |
< 0, 804 |
0,63 |
|
Через 15 суток |
< 0,729 |
< 0,791 |
< 0, 842 |
0,63 |
Примечание. Коэффициенты парной корреляции полученных данных больше, чем величина критического коэффициента при Р – 0,05, что подтверждает достоверность тесноты связей.
Содержание гемоглобина в крови после кровопускания (контроль) и при введении ионола анемизированным животным было неодинаково. Различия содержания гемоглобина в известной степени повторяли сдвиги со стороны количества эритроцитов. Через 3 суток после кровопускания содержание гемоглобина в крови контрольных животных в среднем равнялось 6,1 г%, а при введении ионола – 7,6 г% (Р<0,05). Через 15 суток опыта описываемый показатель у контрольной группы составлял 10,1 г%, а при введении ионола –
10,9 г% (Р<0,05).
Общий объем эритроцитов (по гематокриту) в различных условиях опыта, как и содержание гемоглобина, претерпевал изменения, аналогичные сдвигам эритроцитов. Через 3 суток после кровопускания общий объем эритроцитов у контрольных животных составлял в среднем 17,3 ед., а при введении ионола – 27,6 ед. (Р<0,05). Через 15 суток этот показатель у контрольной группы равнялся 26,9 ед., а при введении ионола – 28,9 ед. (Р<0,05). Количество ретикулоцитов в крови у всех групп имела тенденцию к повышению. Однако наблюдаемый ретикулоцитоз при введении ионола имел некоторые особенности. У контрольной группы повышение содержания ретикулоцитов наблюдалось в первые 10-11 суток после кровопускания, а при введении ионола состояние ретикулоцитоза отмечалось в продолжение 15-17 суток. Так, у контрольных животных концентрация зернистых эритроцитов через 15 суток опыта составляла в среднем 30,1%, а при введении ионола – 41,2% (Р<0,05). Таким образом, введение ионола животным после кровопотери обусловливало снижение уровня анемии в первые сутки опыта и ускоряло темпы восстановления красной крови (табл. 3).
Выводы
1. Концентрация ионола в дозе 150 мг/кг обуславливала эритроцитопению, ретикулоцитоз, небольшой микроцитоз, анизоцитоз и некоторое снижение содержания гемоглобина в крови в целом и особенно в 1 эритроците.
2. При концентрации ионола 150мг/кг наибольшему дефициту эритрона соответствовало максимальное повышение количества лейкоцитов.
3.Цитохимические исследования при введении ионола (150, мг/кг) показали снижение содержания гликогена и некоторое повышение активности ферментов пероксидазы и щелочной фосфатазы в псевдоэозинофилах, что отражает усиление внутриклеточного обмена.
4. Введение ионола (30 мг/кг) животным после кровопотери обусловливало снижение уровня анемии в первые сутки опыта и ускоряло темпы восстановления красной крови.
Рецензенты:
Фролов Б.А., д.м.н., профессор, заведующий кафедрой патофизиологии Оренбургской государственной медицинской академии, г. Оренбург.
Миннебаев М.М., д.м.н., профессор кафедры патофизиологии Казанского государственного медицинского университета, г. Казань.
Библиографическая ссылка
Еникеев Д.А., Хисамов Э.Н., Еникеева С.А., Идрисова Л.Т., Мочалов К.С. КОРРЕКЦИЯ ГЕМАТОЛОГИЧЕСКИХ СДВИГОВ У КРОЛИКОВ ПОД ДЕЙСТВИЕМ ИОНОЛА // Современные проблемы науки и образования. 2013. № 6. ;URL: https://science-education.ru/ru/article/view?id=11551 (дата обращения: 03.03.2026).



