Введение
Настоящая работа связана с проблемой качественного питьевого водоснабжения северных регионов Западной Сибири. Особенно это касается удаленных поселков, не имеющих централизованного водоснабжения, и предприятий нефте- и газодобывающего комплекса. Подземные воды этих регионов характеризуются повышенным содержанием железа. На территории Томского района, Новосибирской и Кемеровской областей железо находится преимущественно в виде гидрокарбоната железа и легко удаляется по классической технологии, которая включает аэрацию, седиментацию и фильтрацию. При обработке по классической технологии подземных вод северных районов Томской области, Ханты-Мансийского автономного округа наблюдается образование коллоидных соединений железа, что представляет сложность в процессе водоподготовки и значительно снижает производительность используемых установок [2; 5].
Целью работы является изучение механизма образования коллоидных соединений железа в процессе водоподготовки.
Методика эксперимента
Для изучения последовательности взаимодействия компонентов водного раствора и получения количественных характеристик наиболее целесообразно проводить исследования на модельных растворах. Прямое определение этих характеристик в природных водах не всегда возможно и продуктивно вследствие сложности состава, что не позволяет однозначно связать их со свойствами системы. В этом плане более удачным представляется экспериментальное моделирование изучаемых систем и их сравнение с природными.
Для синтеза модельного раствора и аналитических исследований в работе использовали реактивы FeSO4·7H2O, Na2SiO3·9H2O марки «ч.д.а.» и дистиллированную воду. В работе использовали органические вещества, выделенные из торфяных болот Томской области, предоставленные ГНУ «Сибирский НИИ сельского хозяйства и торфа СО Россельхозакадемии» (г. Томск), концентрацию которых оценивали хроматографическим методом по содержанию растворенного органического углерода - DОС (Dissolved Organic Carbon) и варьировали разбавлением исходных растворов в интервале – 0,05...4,0 мг/л. Молярная масса органических веществ определена с помощью метода гель-хроматографии [4]. Использованные нами образцы содержали фракции от 200 до 20000 Да.
Содержание железа и кремния в растворе определяли с использованием плазменного оптического эмиссионного спектрометра ICP-OES фирмы Varian. Водородный показатель измеряли с использованием многофункционального аппарата WTW Miltiline P4. Распределение частиц по размерам и значения z-потенциала в исследуемых модельных растворах исследовали на анализаторе Zetasizer Nano ZS (Malvern Instruments), который позволяет проводить измерение размеров частиц в диапазоне 0,6…6000 нм. Размер частиц при использовании этого метода определяется по динамическому рассеянию света (угол рассеяния 173°).
Результаты и их обсуждение
Экспериментально установлено, что образование коллоидных соединений железа происходит в процессе окисления при водоподготовке. Поэтому большую роль в образовании коллоидных соединений железа играет свободный кислород, способствующий протеканию гидролиза и образованию коллоидных частиц по реакции:
4 Fe(HCO3)2 + O2+ 2H2O = 4Fe(OH)3↓+8CO2 (1)
Образующийся коллоид гидрооксида железа (III) является неустойчивым и выпадает в осадок в течение нескольких часов. Для подземных вод, обогащенных разнообразными примесями, коллоид гидрооксида железа (III) устойчив в течение длительного времени и, как было показано в работе [2], этому способствует повышенная концентрация ионов кремния и органических веществ гумусового происхождения.
В исследуемых подземных водах концентрации ионов железа, кремния и органических веществ варьируются в широких пределах [3]. Для исследования устойчивости коллоида гидроксида железа (III) была рассмотрена такая характеристика, как критическая концентрация мицеллообразования (ККМ). Методы определения ККМ, используемые в настоящее время, основаны на изменении физико-химических свойств коллоидных систем в области ККМ [6]. Количественной характеристикой определения ККМ может служить электрохимический потенциал – дзета-потенциал. Для исследуемой системы, содержащей 0,56 мг/л ионов железа (III), наблюдали за изменением электрокинетического потенциала при увеличении концентрации гумата натрия от 0,001 до 2 мг/л. Нижний предел концентрации гумата натрия определяется чувствительностью анализатора общего органического углерода «Sievers 820». На рисунке 1 представлены результаты исследований.
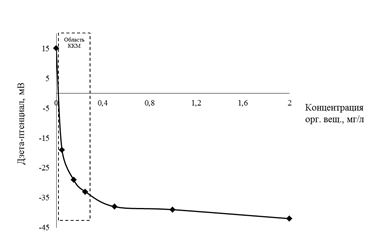
Рис. 1. Изменение дзета-потенциала в зависимости от концентрации органических веществ в виде гумата натрия в растворе, содержащем 0,56 мг/л ионов железа
Из рисунка 1 видно, что резкое изменение дзета-потенциала наблюдается при концентрации гумата натрия от 0,02 до 0,5 мг/л. Этот интервал является областью ККМ и определяет содержание органических веществ, влияющих на устойчивость коллоида гидроксида железа (III). При концентрации гумата натрия ниже ККМ наблюдается коагуляция частиц Fe(OH)3, а при концентрации выше ККМ образуется устойчивая коллоидная система, состоящая из соединений железа, стабилизированных гуматом натрия. Аналогично, по изменению дзета-потенциала, была определена и ККМ для ионов кремния в растворе железа той же концентрации, что и в случае гумата натрия. В этом случае область ККМ составляет от 1 до 3 мг/л ионов кремния.
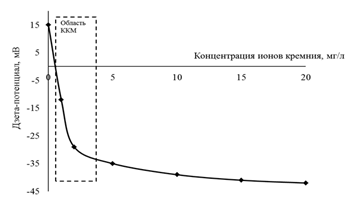
Рис. 2. Изменение дзета-потенциала в зависимости от концентрации кремния в растворе, содержащем 0,56 мг/л ионов железа
Экспериментально полученные значения ККМ позволили определить соотношение концентраций ионов железа, кремния и гумата натрия в модельном растворе, которые составили 0,56 : 1,96 : 0,25 мг/л соответственно, что выражается мольным соотношением 1 : 7 : 2. Полученное мольное соотношение позволяет в железосодержащих природных водах любого химического состава прогнозировать образование устойчивого коллоида гидроксида железа (III).
В процессе приготовления модельного раствора было установлено, что на его устойчивость влияет последовательность введения компонентов. Результаты представлены на рисунке 3. Концентрации ионов железа, кремния и органических веществ составляли 5,6 – 20 – 2,2 мг/л соответственно, рН раствора поддерживали равной 7,5.
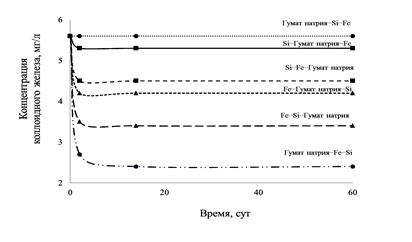
Рис. 3. Влияние последовательности введения компонентов на устойчивость модельного коллоидного раствора
Из рисунка 3 видно, что при последовательном введении в раствор гумата натрия, ионов Si, а затем ионов Fe либо ионов Si, гумата натрия и ионов Fe все ионы железа переходят в коллоидное состояние и раствор устойчив в течение 60 дней. Растворы, приготовленные при иной последовательности введения реагентов, теряют устойчивость в течение 5 суток.
Закономерность изменения свойств коллоидного раствора в зависимости от различной последовательности введения компонентов объясняется физико-химическими процессами, протекающими при растворении каждого компонента.
Согласно литературным данным [6], раствор гумата натрия является молекулярным коллоидом, который условно можно обозначить в виде ![]() , где R− − органическая составляющая. Формула мицеллы гумата натрия представлена следующей схемой:
, где R− − органическая составляющая. Формула мицеллы гумата натрия представлена следующей схемой:
{[mNaR]nR-, (n-x) Na+}x-xNa+ (2)
Измеренное значение дзета-потенциала составляет -45 мВ, а значение рН раствора − 5,5. При добавлении в полученный раствор метасиликата натрия – Na2SiO3∙9H2O – происходит смещение рН до 10, что свидетельствует о протекании реакции гидролиза по уравнению:
Na2SiO3 + 3H2O = H4SiO4↓ + 2NaOH (3)
Согласно литературным данным [6], щелочные метасиликаты при гидролизе образуют устойчивые золи кремниевой кислоты, которые в щелочных растворах имеют отрицательный заряд:
{[mH2SiO3]nSiO32−, 2 (n−x) Na+}2x−2xNa+ (4)
Далее, согласно работе [4], происходит взаимодействие гумата натрия с соединениями кремния с образованием кремнийорганических комплексов по реакции:
NaR–CH3+Na2SiO3=NaR–CH2–O–SiO2Na2+H+ (5)
Образование кремнийорганических комплексов происходит на первой стадии взаимодействия гумата натрия с раствором соли Na2SiO3∙9H2O, что подтверждено термодинамическими расчетами [4]. Значение энергии Гиббса (∆rG0) для реакции (5) составляет (− 95,9) кДж/моль.
При добавлении в этот раствор сульфата железа (II) происходит постепенное его окисление по реакции (6):
4FеSО4 +О2 +10Н2О =4Fе(ОН)3↓ +4H2SО4 (6)
с образованием Fe(OH)3, значение произведения растворимости которого свидетельствует о необратимости реакции. Значение энергии Гиббса (∆rG0) для реакции (6) составляет (− 88,27) кДж/моль.
Формирование золя на основе Fe(OH)3 можно представить формулой:
{[mFe(OH)3]nFeOH2+, 2(n−x)OH−}2x+∙2xOH−, (7)
где ядром мицеллы является Fe(OH)3.
Полученное количественное соотношение компонентов раствора и последовательность их введения, значения ККМ и заряд частиц позволили представить последовательность стадий образования устойчивых коллоидных соединений железа в модельном растворе в виде блок-схемы (рис. 4).
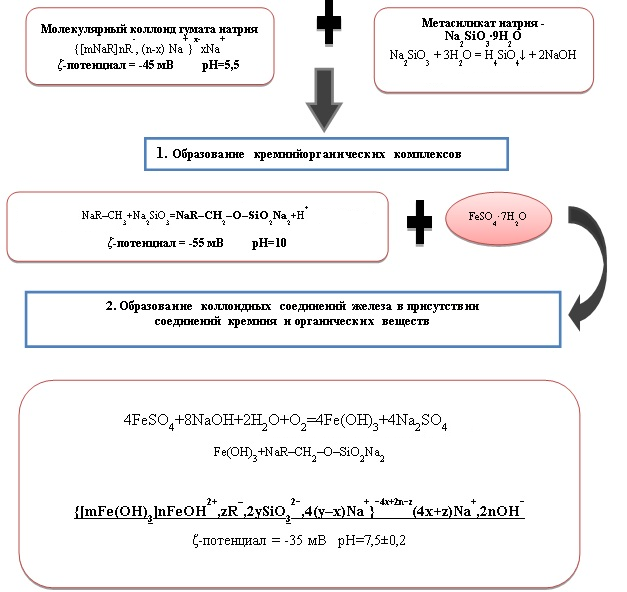
Рис. 4. Блок-схема последовательности стадий образования коллоидных соединений железа в модельном растворе в присутствии соединений кремния и органических веществ
Установленная последовательность элементарных стадий формирования устойчивых коллоидных соединений железа реализуется в процессах водоподготовки, и это необходимо учитывать при выборе технологии обработки железосодержащих природных вод.
Выводы
1. Показано, что устойчивость наночастиц гидроксида железа обусловлена присутствием ионов кремния и гуминовых веществ.
2. На основании полученных значений ККМ установлено мольное соотношение железо-кремний-органические вещества, равное 1-7-2, при котором образуются устойчивые наночастицы гидроксида железа (III).
3. Предложен механизм формирования коллоидных соединений железа в водной среде, заключающийся в последовательном протекании стадий образования кремнийорганических комплексов (∆rG0 = −95,9 кДж/моль), окисления железа с образованием Fe(OH)3 (∆rG0 = −88,27 кДж/моль) и их электростатического взаимодействия с образованием устойчивой коллоидной системы.
Работа выполнена при поддержке Министерства образования и науки РФ, проект № 14.В37.21.1200, и Государственного задания «Наука» 12.14.2012.
Рецензенты:
Сечин А.И., д.т.н., профессор, Федеральное агентство по образованию, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск.
Хан В.А., д.т.н., старший научный сотрудник лаборатории оптической локации, Институт оптики атмосферы СО РАН, г. Томск.



