В течение длительного времени на почву смотрели только с позиций агронома, рассматривая лишь одну из ее функций – плодородие. Лишь недавно, в связи с осознанием биосферной роли почвы в поддержании устойчивости экосистем и жизни на Земле, почву стали оценивать как экологическую нишу организмов суши, обеспечивающих глобальные функции почв [6].
Особенно значима роль, которую выполняет почвенный покров в качестве мембраны, обеспечивающей обмен веществом и энергией между литосферой, гидросферой, атмосферой и всеми обитающими на Земле организмами [5]). Эта глобальная функция почвы осуществляется в основном благодаря почвенным бактериям. В настоящее время, несмотря на возрастающий интерес ко всем группам почвенных микроорганизмов [1; 2], одной из центральных проблем микробиологии остается оценка бактериального разнообразия почв.
Основными методами и подходами к оценке микробного разнообразия почв являются: традиционный чашечный метод посева почвеных суспензий на питательные среды, метод мультисубстратного тестирования, анализ профилей метиловых жирных кислот, разные модификации молекулярно-биологических методов.
Общая численность бактерий на богатой питательной среде (содержащей глюкозу, пептон, дрожжевой экстракт), выраженная в КОЕ/г субстрата, представляет один из наиболее консервативных показателей. Фактором, оказывающим влияние на численность бактерий, является тип субстрата, его положение в ярусной структуре биогеоценоза.
Однако некоторые исследователи делают выводы, что на одной среде с одного местообитания вырастает лишь 1% от тех форм бактерий, которые в принципе возможно выделить из почвы. Только 1% почвенных бактерий относится к культивируемым формам, все остальные – к некультивируемым [4; 9].
Молекулярно-биологические методы обладают более широкими возможностями и выглядят более привлекательными при оценке бактериального разнообразия почв. Сущность этих подходов основана на анализе разнообразия консервативных элементов генома микроорганизмов.
Целью работы было оценить и сравнить картины бактериального разнообразия почв, полученных молекулярно-генетическими и культуральными методами.
Методы исследования
Микробные ценозы почв северных территорий Сибири обладают небольшим биоразнообразием и ограниченным деструкционным потенциалом, но являются важным функциональным звеном в биогеоценозах. В качестве объекта исследований были выбраны образцы почвенных срезов на территории деятельности ОАО «Газпромнефть-Ноябрьскнефтегаз», Пуровский район, ЯНАО. Образцы почв любезно предоставлены ЗАО «Биоойл» (г. Новосибирск). Материал отбирали по срезу почвы с интервалом 10 см. Образец А1 (63.00729 с.ш., 76.89418 в.д.) отобран с территории сосново-березового леса, подвергшегося нефтяному загрязнению не менее 2 лет назад (рис. 1). Поверхность почвы загрязнена битумной коркой. Образец А17 (62.90726 с.ш., 75.10995 в.д.) отобран с территории кустовой площадки, периодически загрязняемой случайными выбросами сырой нефти и подтоварной воды.

Рисунок 1. Территория отбора и вид почвенного среза образца А1.
Экстракцию тотальной ДНК из образцов почв проводили методом замораживания – оттаивания [7]. Лизис клеток достигался за счет температурного шока и действия 2% SDS. Для инактивации нуклеаз в буфер добавляли протеиназу К. Для очистки ДНК от белков и гуминовых кислот введены стадии с добавлением хлористого цезия и последующим дополнительным осаждением ДНК изопропанолом [8].
Очищенную ДНК использовали в качестве матрицы для 30 циклов ПЦР с использованием ДНК-полимеразы Thermus aquaticus (Taq-полимераза). В качестве праймеров использовали универсальные бактериальные праймеры, комплементарные консервативному фрагменту гена 16S-рибосомальной РНК эубактерий: 341F с последовательностью 5′-CCTACGGGAGGCAGCAG-3′ и 907R с последовательностью 5′-CCGTCAATTCCTTTGAGTTT-3′ (позиции E. coli). К 5′-концу праймера 341F прикреплен GC богатый GC-кламп – 5′-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGC-3′ – для того чтобы повысить устойчивость продукта ПЦР, чтобы впоследствии при проведении денатурирующего градиентного гель-электрофореза (ДГГЭ) избежать полной денатурации.
После окончания реакции для проверки выхода продуктов ПЦР проводили электрофорез в 1,5%-ном агарозном геле. Гель окрашивали бромистым этидием и визуализировали при облучении ультрафиолетом на приборе Bio-Rad GelDoc XR. Размер продукта был около 550 пар нуклеотидов. Количество продукта определяли сравнением оптической плотности полос образцов и ДНК-маркера (BioRad) с известной концентрацией с помощью программного продукта Quantity One.
Полученную в результате ПЦР смесь фрагментов ДНК (ампликонов) разделяли электрофорезом в 6%-ном полиакриламидном геле с градиентом денатурантов от 45 до 75% (за 100% денатурантов принимали 7 М раствор мочевины и 40%-ный раствор деионизированного формамида). Электрофорез проводили в камере Bio-Rad DCode System при постоянной температуре 60 °С и напряжении 75 В в течение 16 ч. После этого гель окрашивали в течение 30 мин в трис-ЕДТА-ацетатном буфере, содержащем 5 мг / литр бромида этидия. После окраски гель промывали деионизованной водой, фотографировали при ультрафиолетовом облучении на системе GelDoc XR и далее анализировали полученное изображение с помощью программного обеспечения Quantity One.
Определение количества бактерий проводили с использованием классического чашечного метода посева суспензии образца почвы на питательной среде МПА (мясо-пептонный агар). Проводилось выделение и анализ только бактерий – аэробов. Определение количества видов бактерий определялось визуально оценкой внешнего вида колоний, типом и внешним видом бактерий после окраски по Грамму.
Результаты и их обсуждение
После проведения этапов ПЦР получены данные в ДГГЭ из выбранных образцов почвы. В образце А1 (рис. 2) прослеживается существенное различие между структурой сообществ на разной глубине. Наибольшее разнообразие показано на глубоких срезах, оно выражено как в количестве видов, так в количестве доминант. Полос, повторяющихся во всех срезах одновременно, нет.
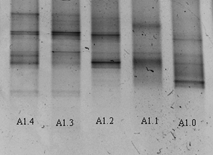
Рисунок 2. Вид геля после ДГГЭ амплификата из проб образца А1: А1.0 – глубина отбора 0-2 см от поверхности, А1.1 - глубина отбора 10-12 см от поверхности, А1.2 – глубина отбора 20-22 см от поверхности, А1.3 - глубина отбора 30-32 см от поверхности, А1.4 – глубина отбора 40-42 см от поверхности.
В образце почвы А17 (рис. 3) количество видов в зависимости от глубины среза меняется, но недостоверно. На всех срезах встречается один вид, который является доминантным для сообщества и, по-видимому, представляет собой характерный для данного ценоза организм. Структура сообществ на срезах (30-32) см и (40-42) см совпадает на 90%.
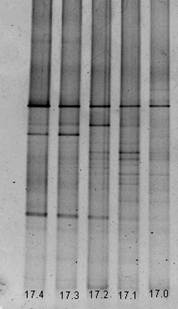
Рисунок 3. Вид геля после ДГГЭ амплификата из проб образца А17: 17.0 – глубина отбора 0-2 см от поверхности, 17.1 - глубина отбора 10-12 см от поверхности, 17.2 – глубина отбора 20-22 см от поверхности, 17.3 - глубина отбора 30-32 см от поверхности, 17.4 – глубина отбора 40-42 см от поверхности.
Одновременно с молекулярной оценкой микробного сообщества была проведена оценка количественного и качественного состава бактерий с помощью классических методов микробиологии. Полученные данные говорят о достаточно бедном количестве бактерий в отобранных почвах (от полумиллиона до 37 миллионов КОЕ/г почвы) (табл. 1, 2).
Таблица 1.
Структура бактериального сообщества образца А1
|
Глубина среза от поверхности, см |
ПЦР с последующим ДГГЭ |
Посев на МПА |
||
|
Количество видов микроорганизмов (по количеству полос в геле) |
Количество доминант |
Количество КОЕ/г почвы |
Количество выделенных видов микроорганизмов |
|
|
0-2 |
12 |
2 |
8,53*106 |
12 |
|
10-12 |
8 |
2 |
5,35*105 |
8 |
|
20-22 |
13 |
3 |
2,19*106 |
10 |
|
30-32 |
15 |
3 |
2,20*107 |
4 |
|
40-42 |
13 |
5 |
1,17*107 |
5 |
Таблица 2.
Структура бактериального сообщества образца А17
|
Глубина среза от поверхности, см |
ПЦР с последующим ДГГЭ |
Посев на МПА |
||
|
Количество видов микроорганизмов (по количеству полос в геле) |
Количество доминант |
Количество КОЕ/г почвы |
Количество выделенных видов микроорганизмов |
|
|
0-2 |
13 |
1 |
2,32*106 |
11 |
|
10-12 |
15 |
3 |
2,78*107 |
11 |
|
20-22 |
14 |
3 |
3,7*107 |
10 |
|
30-32 |
13 |
3 |
3,53*107 |
8 |
|
40-42 |
13 |
3 |
3,7*107 |
5 |
Сравнивая данные по количеству репрезентативных видов бактерий, полученные с помощью разных методов, можно отметить высокую сходимость результатов (73-100%) в близких к поверхности образцах почвы (0-2 и 10-12 см от поверхности). По мере углубления (от 20 до 42 см) сходимость результатов по определению количества видов бактерий с помощью разных методов резко снижается и достигает 38-27%.
Получая данные с помощью классических методов микробиологии, мы получаем заниженные данные, особенно на глубоких (более 20 см) срезах почвы сибирского Севера. Вместе с тем считается, что с помощью классических методов микробиологии можно выделить всего около 1% от всех присутствующих в почве видов. Нами выделено от 100 до 27% (в сравнении с молекулярными методами) видов бактерий в зависимости от глубины отбора исследуемой пробы. По-видимому, это можно объяснить особенностями почв сибирского Севера, микроорганизмы которого вынуждены активно существовать в течение ограниченного времени в году в условиях крайне низкого содержания микроэлементов и основных компонентов питания. Помещая бактерии на богатую элементами питания среду, мы выделили до 100% находившихся в почве видов. Несоответствие количества видов на глубине может быть объяснено наличием бактерий-анаэробов, а также некультивируемых форм.
Вместе с тем молекулярно-генетические методы не являются панацеей от всех трудностей, возникающих при анализе почвенных сообществ. Наиболее рациональным представляется полифазных подход, при котором необходимо использование самых разных методов, в том числе и традиционного метода изолирования культур на питательные среды.
Разнообразие последовательностей генов 16s pРНК, выделяемых из микробной биомассы почв, будет всегда выше разнообразия соответствующих последовательностей культур, выделенных из той же почвы. Причины могут быть следующими: более высокая генетическая неоднородность природных популяций по сравнению с популяциями коллекционных культур [10]; задержка времени реассоциации в связи с недостаточной очисткой препарата ДНК из почвы от гумусовых веществ [10]; наличие в почве значительного пула внеклеточных, частично трансформированных нуклеиновых кислот [3]; присутствие в почве значительной доли некультивируемых форм, неспособных к росту на лабораторных средах, но вносящих свой вклад в разнообразие ДНК сообщества [4], и некоторые другие.
Таким образом, традиционный метод посева и выделения чистых культур не только следует сохранить, несмотря на появление современных молекулярно-биологических методов, но и расширить его возможности, используя для количественной характеристики микробных сообществ.
Заключение
Проведено сравнение методов оценки разнообразия бактериальных сообществ почв сибирского Севера. Показано, что с помощью классического метода чашечного посева материала на питательные среды при анализе отобранных близко к поверхности проб количество выделенных видов бактерий сопоставимо на 70-100% с данными, полученными с помощью молекулярного анализа (ПЦР с последующим ДГГЭ). Такие данные, по-видимому, объясняются биологическими особенностями почв сибирского Севера.
Работа проводилась при финансовой поддержке ЗАО «Биоойл», (г. Новосибирск) и Министерства образования и науки Российской Федерации (ГК 14.515.11.0025).
Рецензенты:
Шевченко Н.Г., д.б.н., главный научный сотрудник ООО «УСК», г. Сургут.
Беклемишев А.Б., д.б.н., профессор, заведующий лабораторией генной инженерии, НИИ биохимии СО РАМН, г. Новосибирск.



