Введение. Нарушения в системе дофаминергической трансмиссии – важное звено патогенетических механизмов многих психоневрологических заболеваний, таких как эпилепсия, паркинсонизм, шизофрения и наркомания. Ведущую роль в формировании дисфункций указанной нейромедиаторной системы мозга играют изменения в структуре дофаминового рецептора второго типа (DRD2). В ранее проведенных нами экспериментальных исследованиях выявлена роль генотипа А1/А1 по локусу Taq 1A DRD2 в ускорении темпов развития толерантности к алкоголю и формирования психической зависимости [1]. Исследованиями по молекулярной генетике показано, что аллель А1 этого локуса находится в неравновесии по сцеплению (D’=0,855) с минорными аллелями (Т) двух фланкирующих 6 экзон интронных локусов (rs 2283265 и rs 1076560) этого гена, снижающими экспрессию короткой изоформы [9]. Так как DRD2 у крысы на 95% гомологичен с этим геном человека, можно полагать, что выявленная закономерность имеет место и у крыс. Известно, что снижение экспрессии короткой изоформы DRD2 и изменение в силу этого соотношения длинной и короткой изоформ приводит к повышению содержания внеклеточного дофамина [7].
Целью данного сообщения является структурно-количественная характеристика миндалевидного комплекса (МК) и первичной соматосенсорной коры (ПСК) предпочитающих и не предпочитающих алкоголь крыс.
Материал и методы. Морфометрические исследования проведены на 20 половозрелых крысах (по 10 крыс в каждой группе, самцы + самки). Использованные в работе предпочитающие (ПА) и не предпочитающие алкоголь (НА) крысы получены из популяции крыс линии WAG/Rij после генотипирования локуса Taq 1A DRD2, скрещивания гомозиготных животных и выявления в последующем предпочтения алкоголя в тесте двух поилок. Среди крыс, имевших генотип А1/А1, для получения потомства были отобраны особи (самки и самцы), имевшие высокие темпы нарастания количеств потребляемого спирта при принудительной алкоголизации в течение двух недель и с установкой двух поилок (10%-ный этанол и вода) на третьей неделе эксперимента предпочитавшие пить спирт. В настоящем исследовании использовано четвертое поколение этих крыс. Эти крысы обозначены как крысы, предпочитающие алкоголь (ПА). Среди крыс с генотипом А2/А2 для получения потомства использованы особи, которые после принудительной алкоголизации при установке двух поилок предпочитали пить воду. Эта группа крыс обозначена как не предпочитающие алкоголь (НА). Всех использованных в работе крыс содержали в стандартных условиях вивария с соблюдением международных этических норм гуманного обращения с экспериментальными животными.
Для измерения площади изучаемых структур МК на территории заднего отдела и ПСК использовали фронтальные срезы, окрашенные крезилом фиолетовым по Нисслю и программу JmageJ 1.38 (USA). Вычисляли абсолютные и удельные площади изучаемых структур. Удельную площадь МТ определяли по отношению к площади всего соответствующего полушария, удельные площади кортико-медиальной и базолатеральной группировок - по отношению к площади МК. В соматосенсорной коре вычисляли удельную площадь пятого и шестого слоев по отношению к общей площади периорального поля в правом полушарии.
Методика, характеризующая генотипирование локуса Taq 1 A DRD2, приведена в ранее опубликованной работе [1]. Количественные характеристики обрабатывали с помощью программы Statistica 5.5.
Результаты исследования и их обсуждение. В состав кортико-медиальной группировки структур на территории заднего отдела МК входят ряд образований, совокупность которых формирует палеоамигдалу [2]. Дорсомедиальное ядро занимает самую дорсальную по сравнению с задним медиальным и задним кортикальным ядром позицию (рис. 1). Заднее кортикальное ядро самое большое по площади, выходит на базальную поверхность мозга, где под мягкой оболочкой находится его поверхностная зона. Базо-латеральная группировка включает в себя базолатеральное (BL) и латеральное (L) ядра. Скопление этих ядер легко дифференцируется от остальных структур МК, т.к. отграничено наружной капсулой и продольной ассоциативной связкой.
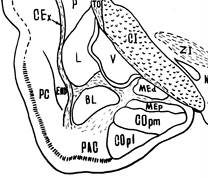
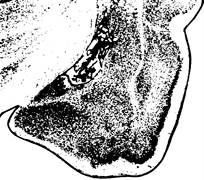
Рис. 1. Структурная организация миндалевидного комплекса крыс. Обозначения: А - схема цитоархитектоники МТ, Б – цитоархитектоника МТ; крезил-фиолетовый, ув. 35, MEd – дорсомедиальное ядро, MEp – заднее медиальное ядро, COpm – медиальная часть заднего кортикального ядра, Copl – латеральная часть заднего кортикального ядра, L – латеральное ядро, BL – базолатеральное ядро.
Первичная соматосенсорная кора (рис. 2) располагается на дорсолатеральной поверхности полушарий и включает в себя ряд областей. Наши исследования проведены на периоральном поле этой области, которая локализуется около обонятельной вырезки, граничит вентрально с первичной поясной корой и первичным моторным полем соматосенсорной коры дорсально.
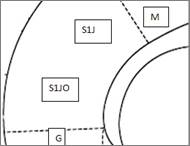

Рис. 2. Структурная организация соматосенсорной коры крыс. Обозначения: А – схема цитоархитектоники соматосенсорной коры (по Paxinos G., Watson C., 1998), Б – цитоархитектоника соматосенсорной коры, крезио-фиолетовый, ув. 50, М – моторная кора, S1J – первичная соматосенсорная кора, S1IO – периоральное поле первичной соматосенсорной коры; G - инсулярная кора, I-VI – слои коры.
Проведенный анализ показывает, что по суммарной удельной площади размеры МК у ПА- и НА-крыс не различаются (таблица 1).
Таблица 1. Количественные характеристики удельных площадей миндалевидного комплекса и соматосенсорной коры предпочитающих (ПА) и не предпочитающих (НА) алкоголь крыс (M+m).
|
Миндалевидный комплекс |
||||
|
Крысы |
ПА |
НА |
||
|
Суммарная уд. площадь (%) |
20,17+0,53 |
19,39+0,36 |
||
|
Полушария |
левое |
правое |
левое |
правое |
|
Уд. площадь (%) |
20,56+0,87 |
19,70+0,47 |
20,13+0,55 |
18,66+0,42* |
|
Группировки |
Кортико-медиальная |
Базо-латеральная |
Кортико-медиальная |
Базо-латеральная |
|
16,58+1,43 |
19,19+0,49 |
16,48+1,39 |
21,71+0,33*** |
|
|
Соматосенсорная кора |
||||
|
Крысы |
ПА |
НА |
||
|
Уд. площадь (%) |
29,8±0,42 |
32,3±0,44* |
||
Обозначения: * p<0,05, *** p<0,001
Также нет различий между группами крыс по удельной площади МК в левом и правом полушарии. Но сравнение удельной площади в левом и правом полушарии у НА-крыс показывает, что существует асимметрия, при этом площадь МК больше у этих крыс в правом полушарии. Выяснение вопроса, за счет какой группировки (кортико-медиальной или базолатеральной) эта асимметрия формируется, показывает, что она предопределена базолатеральной группировкой, площадь которой достоверно выше у НА-крыс в правом полушарии. У НА-крыс также значимо больше суммарная площадь пятого-шестого слоев первичной соматосенсорной коры правого полушария мозга.
Большую роль в разработке ранних диагностических методов для выявления групп риска играют нейровизуализационные методы. Они позволяют обнаружить обусловленные психоневрологическими отклонениями изменения в волюметрических и функциональных показателях структур мозга. Эти исследования проводятся как на людях, так и на животных моделях. В литературе накопилось немало сведений, характеризующих изменения морфологии мозга при депрессиях, височной эпилепсии и шизофрении, но в отношении болезней зависимости они немногочисленны и противоречивы. Так, исследования, проведенные с помощью ядерно-магнитного резонанса у лиц португальской популяции, показали, что в норме асимметрии в объеме МК не существует [8]. Авторы из Гарвардского университета [5], наоборот, указывают, что имеющая место в контроле асимметрия объема МК исчезает у наркоманов. Проведенный нами анализ структурно-количественных характеристик МК обнаружил наличие асимметрии у НА-крыс, которая формируется за счет большей удельной площади базолатеральной группировки.
Известно, что базолатеральная группировка структур МК вовлечена в формирование эмоциональной памяти, тревожности и реакций страха, при этом ведущую роль играет DRD2 [4]. С помощью экспериментальных моделей выяснено, что у мышей, проявляющих большую тревожность, размеры базолатеральной группировки МК изменены [10]. Это согласуется с результатами наших исследований поведения ПА- и НА-крыс в приподнятом крестообразном лабиринте и в установке «Открытое поле», которые показали наличие признаков тревожного поведения у ПА-крыс [3].
Имеющиеся в литературе сведения позволяют объяснить как повышенный уровень катехоламинов в МК, выявленный нами у ПА-крыс, может приводить повышению уровня тревожности. В основе этого лежит изменение функциональной активности эфферентных (пирамидных) нейронов ядер базолатеральной группировки. Показано, что приходящие из ствола тирозин-гидроксилаза-содержащие (ТГ) терминали контактируют не с пирамидными нейронами, а с ГАМК-ергическими интернейронами, формируя тормозные синапсы [6]. Повышенный приток катехоламинов в МК в этих условиях приводит к дизингибиции пирамидных нейронов, повышению активности в нервных кругах, составляющих субстрат формирования тревожного поведения, в состав которых входит и первичная соматосенсорная кора. У НА-крыс площадь базолатеральной группировки и площадь первичной соматосенсорной коры больше, чем у ПА-крыс, что можно предположительно объяснить увеличением в их составе представительства тормозных интернейронов, однако это предположение должно быть выяснено в дальнейших исследованиях.
Базолатеральная группировка МК появляется в филогенезе позвоночных как надстройка над кортикомедиальной группировкой. Известно, что эфференты базолатерального и латерального ядер следуют к базальным ганглиям, в гиппокампальную формацию, к различным областям неокортекса, включая поля фронтальной коры.
Заключение. Проведенный анализ выявил наличие значимо меньшей удельной площади первичной соматосенсорной коры и базолатеральной группировки МК в правом полушарии у предпочитающих алкоголь крыс по сравнению с не предпочитающими алкоголь крысами. У не предпочитающих алкоголь крыс удельная площадь МК в правом и левом полушариях значимо не различается, отражая отсутствие его асимметрии.
Рецензенты:
Каюмов Фарит Амирович, доктор медицинских наук, профессор, профессор кафедры гистологии БГМУ, Башкирский государственный медицинский университет, г. Уфа.
Мусина Ляля Ахияровна, доктор биологических наук, профессор, заведующая лабораторией электронной микроскопии отдела морфологии, ведущий научный сотрудник ФГБУ «Всероссийский центр глазной и пластической хирургии» Министерства здравоохранения РФ, г. Уфа.



