Введение
Апоптоз (программируемая клеточная гибель) является одним из ключевых клеточных процессов, которые контролируются группой протеолитических ферментов – каспаз. Различают инициаторные (8, 2, 10, 9) и эффекторные каспазы (3, 7, 6), т.е. каспазы функционируют как протеолитические каскады [5]. Поскольку нарушение регуляции апоптоза приводит к онкологическим, аутоиммунным и нейродегенеративным заболеваниям, изучение апоптоза позволит понять патогенез этих заболеваний и, следовательно, создать новые лекарственные препараты. Путь с поверхности клеточной мембраны и митохондриальный сходятся на активации эффекторной каспазы-3 [2], поэтому уровень активности данного фермента является удобным маркером для детекции апоптоза.
Проведение неинвазивного прижизненного мониторинга активности каспазы-3 в режиме реального времени стало возможным с помощью генетически кодируемых FRET-сенсоров (большинство которых получено на основе флуоресцентных белков). Использование во FRET-сенсорах красных белков позволяет уменьшить фоновый сигнал за счет попадания в терапевтическое окно прозрачности, увеличить проникаемость сигнала вглубь тканей из-за меньшего рассеяния и снизить негативное влияние возбуждающего излучения на клетки [1].
Цель исследования
Целью данной работы стало изучение свойств генетически кодируемого FRET-сенсора каспазы-3 FusionRed-Linker1-eqFP670, представляющего собой пару дальнекрасных белков FusionRed [4] и eqFP670 [3], соединенных гибким полипептидным линкером LKDEVDGDEVDGAS, содержащим тетрапептид DEVD, специфически распознаваемый и гидролизуемый каспазой-3.
Материалы и методы
Очистка полученного сенсора
Клетки E.coli штамм BL21(DE3), содержащие белок FusionRed-LINKER1-eqFP670, осаждали центрифугированием (20 мин при 4 тыс. об/мин, 4 ºС), суспендировали в буфере 20 мМ Трис´HCl, рН 7.8, 0.15М NaCl и разрушали с помощью френч-пресса. После разрушения клеток очистка полученного лизата проводилась с помощью гель-фильтрационной хроматографии на носителе Superdex 200 10/300 GL с использованием хроматографа AKTA purifier производства компании GE Healthcare (Швеция). Скорость элюирования составляла 0.5 мл/мин. Рабочий буфер: 150 мМ NaCl; 20 мМ Tris·HCl pH = 8,7. Регистрация поглощения выполнялась на двух длинах волн – 280 и 560. Целевой белок собирали по поглощению на 560 нм.
Калибровка колонки была выполнена с помощью стандартов для гель-фильтрации производства компании BioRad (Thyroglobulin (bovine) – 670 kDal γ-globulin (bovine) – 158 kDa; Ovalbumin (chicken) – 44 kDa; Myoglobin (horse) – 17 kDa; Vitamin B12 – 1,35 kDa).
Калибровочная кривая была получена путем построения зависимости коэффициента распределения Kav = (Ve-V0)/(Vt-V0) от десятичного логарифма молекулярной массы (Mr) стандартов, где Ve – объем элюирования, V0 – мертвый объем и Vt – общий объем колонки. Молекулярную массу белка определяли методом электрофореза в денатурирующих условиях по Лэммли в 12% ПААГ на приборе MiniProtean II (Bio-Rad, США), с использованием набора маркеров молекулярных масс белков (Fermentas, США).
Измерение гидродинамического радиуса исследуемых сенсоров методом динамического светорассеивания
Для измерения гидродинамического радиуса использовали установку DynaPro Titan и программного обеспечения Dynamics 6.6.7.9 производства Wyatt Technology (США). Измерения проводили при температуре образца 25 °С, интенсивность лазерного облучения составляла 100%. Для интерпретации результатов использовали предустановленную модель (MW-R model) «Globular Proteins». Для каждого измерения, в соответствии с рекомендациями производителя, было установлено время накопления сигнала 10 с и 10 измерений на один эксперимент. Определение олигомерного состояния проводили на основе данных о гидродинамическом радиусе исследуемого белка с помощью программного обеспечения Dynamics 6.6.7.9 (Wyatt Technology, США).
Определение эффективности переноса энергии в конструкции FusionRed-Linker1-eqFP670
Спектры поглощения образцов FusionRed и конструкции FusionRed-Linker1-eqFP670 в буфере 150мМ NaCl; 20 мМ Трис-НСl рН 8,7 регистрировались на спектрофотометре Cary 300 (Varian, USA). Затем на спектрофлуориметре Cary Eclipse (Varian, USA) регистрировались спектры флуоресценции этих же образцов при возбуждении флуоресценции на длине волны 530 нм. На основании полученных спектров по формуле (1) была рассчитана эффективность переноса энергии в конструкции FusionRed-Linker1-eqFP670:
E= 1 - n = 1- (Sem/ DFusionRed)/(S/D) , (1),
где Sem - площадь под спектром эмиссии флуоресценции конструкции, DFusionRed - значение оптической плотности FusionRed в конструкции на длине волны 530 нм, S - площадь под спектром эмиссии флуоресценции индивидуального FusionRed, D - значение оптической плотности индивидуального FusionRed на длине волны 530 нм.
Для нахождения DFusionRed было проведено разложение спектра поглощения FusionRed на два пика с помощью разложения Гаусса и определены положения и полуширины пиков. Спектры поглощения конструкции разложили с помощью четырёх Гауссов, после чего просуммировали оптические плотности каждой из двух компонент FusionRed на длине волны 530 нм в спектре поглощения конструкции.
Определение эффективности расщепления генетически кодируемого субстрата FusionRed-Linker1-eqFP670
Белок слияния был отдиализован к буферу 100 mM NaCl, 50 mM HEPES, 10 mM DTT, 1 mM ЭДТА, 10% глицерин, 0,5% CHAPS, pH 7,4. Концентрация сенсора, используемая в эксперименте, равнялась 1,4 мкМ. К 93 мкл раствора субстрата добавляли 7 мкл каспазы-3 (100 ед/мкл), тщательно перемешивали и инкубировали в течение 24 часов при температуре 37 оС. Измерения спектров флуоресценции проводили на спектрофлуориметре Cary Eclipse (Varian, USA) при возбуждении светом с длиной волны 530 нм.
Расщепление исследуемого сенсора было также продемонстрировано с помощью электрофореза в денатурирующих условиях по Лэммли в 15% ПААГ на приборе MiniProtean II (Bio-Rad, США), с использованием набора маркеров молекулярных масс белков (Fermentas, США).
Результаты и обсуждение
Характеристика степени созревания сенсора
По данным ПААГ-электрофореза, в элюате находится достаточно чистый образец FusionRed-Linker1-eqFP670. При этом наблюдаются две основные полосы – 55 и 46 кДа, в то время как в районе 26 кДа белковых фракций практически нет. Поскольку при созревании FusionRed в полипептидной цепи образуется разрыв, наблюдаемые полосы можно сопоставить соответственно форме субстрата с несозревшим FusionRed (53,6 кДа) и со зрелым FusionRed, содержащим разрыв полипептидной цепи (46,3 кДа).
Определение олигомерного состояния сенсора
Результаты гель-фильтрации говорят о том, что субстрат FusionRed-Linker1-eqFP670 в основном выходит в виде фракции, молекулярная масса которой составляет около 437 кДа, следовательно, так как масса цельной конструкции составляет 53,6 кДа, белок выходит в форме октамера.
В результате экспериментов по динамическому светорассеянию было вычислено, что гидродинамический радиус белка FusionRed-Linker1-eqFP670 равен 6,2 нм, что в приближении сферической модели соответствует молекулярной массе, равной 244 кДа, соответствующей тетрамерной форме белка. Таким образом, белок слияния FusionRed-Linker1-eqFP670 представляет собой тетрамер, имеющий тенденцию к октамеризации при повышении концентрации.
Определение эффективности переноса энергии
Для оценки эффективности переноса энергии в сенсоре FusionRed-Linker1-eqFP670 было найдено отношение квантовых выходов FusionRed в составе сенсора и в виде индивидуального белка: n = (Sem/DFusionRed530)/(S/D) = 76%, т.е. в полученной конструкции происходит индуктивно-резонансный перенос энергии, эффективность которого составляет E = 100% - 76% = 24%. Снижение интенсивности флуоресценции полученного белка слияния FusionRed-Linker1-eqFP670 на длине волны эмиссии FusionRed по сравнению с индивидуальным FusionRed на 22% свидетельствует о наличии переноса энергии между донором и акцептором и хорошо соотносится с рассчитанным значением эффективности переноса энергии, равным 24% в соответствии с рисунком 1.
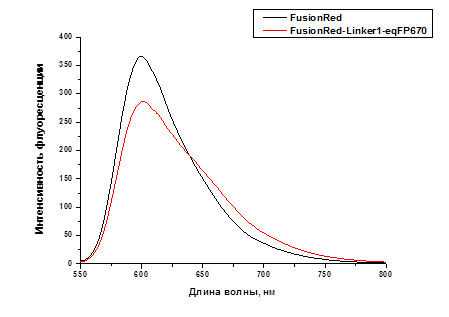
Рисунок 1 - Спектры флуоресценции индивидуального FusionRed (черная линия) и белка слияния FusionRed-Linker1-eqFP670 (красная линия). Возбуждение флуоресценции на 530 нм.
Гидролиз сенсора FusionRed-Linker1-eqFP670 каспазой-3 in vitro
В соответствии с рисунком 2 интенсивность флуоресценции возрастает приблизительно в 1,4 раза.
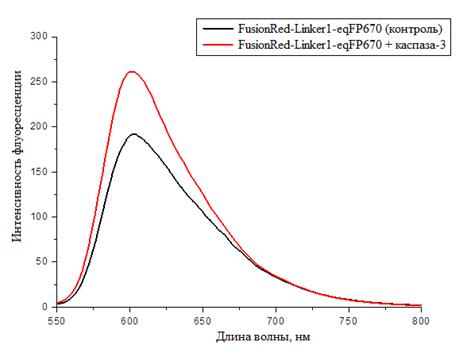
Рисунок 2 - Спектр флуоресценции конструкции FusionRed-Linker1-eqFP670 до (чёрная линия) и после (красная) обработки каспазой-3.
Таким образом, спектры флуоресценции свидетельствуют об эффективном расщеплении линкера под действием каспазы-3.
Для подтверждения полученных данных проведён электрофорез исходного образца FusionRed-Linker1-eqFP670 и после обработки каспазой-3. В соответствии с рисунком 3 для исходного образца характерны две основные полосы (57 и 47,5 кДа). Первая полоса соответствует конструкции FusionRed-Linker1-eqFP670 с несозревшей формой FusionRed, а вторая – зрелой конструкции. После инкубации с каспазой-3 наблюдается исчезновение полосы 47,5 кДа, зато появляются две новые полосы: в районе 28 кДа, чему соответствует eqFP670 с участком линкера, и 20 кДа, что характерно для фрагмента FusionRed.

Рисунок 3 - ПААГ-электрофорез в денатурирующих условиях в присутствии додецилсульфата натрия, 4-15% полиакриламидный гель. Перед нанесением образцы были прогреты на кипящей водяной бане в течение 5 минут. 1 – исходный белок; 2 – конструкция, обработанная каспазой-3; 3 – маркеры молекулярной массы белка, кДа.
Таким образом, конструкция FusionRed-Linker1-eqFP670 эффективно расщепляется под действием каспазы-3 и обладает выраженными спектральными изменениями в ответ на добавление каспазы-3.
Работа выполнена при финансовой поддержке Министерства образования и науки по государственному контракту № 14.512.11.0052.
Рецензенты:
Королева О.В., д.б.н., зав. лабораторией молекулярных основ биотрансформаций Института биохимии им. А.Н. Баха РАН, г. Москва.
Шишкин С.С., д.б.н., профессор, зав. лабораторией биомедицинских исследований Института биохимии им. А.Н. Баха РАН, г. Москва.



