Введение
Биологически активный белок лактоферрин привлекает исследователей всего мира уже более 70 лет. Он принадлежит к семейству белков-трансферринов, осуществляющих перенос железа в клетки и контролирующих уровень свободного железа в крови и во внешних секретах. Лактоферрин представлен преимущественно в молоке человека и других млекопитающих.
Лактоферрин обладает перспективными в биофармацевтическом отношении свойствами: антибактериальными, антивирусными, противогрибковыми, противопаразитическими, антиканцерными, противовоспалительными, иммуномодуляционными, антиоксидантными и регенеративными. Данный белок востребован при производстве биологически активных добавок, детского питания, фармацевтической и парфюмерно-косметической продукции и др.
Мировая потребность в лактоферрине сегодня (90 т) значительно превышает предложение. Лактоферрин продолжает оставаться в ряду дорогостоящих белков. На данный момент один грамм лактоферрина человека стоит около 15000 долларов, поэтому вопрос об удешевлении и увеличении его производства стоит очень остро.
Российский рынок представлен импортными препаратами высокоочищенного лактоферрина крупного рогатого скота. Процедура его выделения из коровьего молока является трудоемкой. Кроме того, он не идентичен человеческому лактоферрину.
Использование донорского женского молока в качестве источника лактоферрина во многих странах ограничено, а в Российской Федерации запрещено в связи с возможностью вирусной контаминации (СПИД, гепатит).
Таким образом, получение рекомбинантного аналога лактоферрина человека, аутентичного природному белку в препаративных количествах, является актуальной задачей. Предпринимались неоднократные попытки по использованию различных систем для получения рекомбинантного лактоферрина: Aspergillus niger, трансгенная соя, рис, и др. Тем не менее такие проблемы, как низкий уровень экспрессии белка, высокая стоимость, низкая биодоступность, а также сложные процедуры очистки по-прежнему не снимают актуальности проблемы поиска оптимального метода производства генно-инженерного лактоферрина в производственных масштабах.
Цель работы – анализ известных методов получения рекомбинантного лактоферрина и разработка способа получения аналога лактоферрина человека, аутентичного природному белку путем микробного синтеза.
Обзор известных способов получения рекомбинантного лактоферрина
Продукцию рекомбинантного лактоферрина человека производят при использовании эукариотических клеточных систем. Все исследования в данной области направлены на создание высокотехнологичной и низкозатратной системы продукции рекомбинантного лактоферрина, обладающего всем спектром физико-химических и биологических свойств, присущих природному белку [9].
В некоторых странах (США, Япония) развернут широкий фронт исследований по получению рекомбинантного лактоферрина человека в микроскопических грибах (Aspergillus awamori, Aspergillus oryzae), растениях (табак, картофель, рис). В Южной Корее и Голландии предпринимаются попытки организовать в промышленных масштабах выпуск рекомбинантного лактоферрина человека, выделенного из молока трансгенных коров, в Белоруссии – из молока трансгенных коз, в России – из куриных яиц [1–2, 10]. Основные организмы-биореакторы, используемые для получения рекомбинантного лактоферрина человека, представлены в табл. 1.
Таблица 1
Основные организмы-биореакторы, используемые для получения рекомбинантного лактоферрина человека
|
Система продукции |
Выход |
Недостатки |
|
Трансгенные коровы (очистка из молока) |
2-3 г/л |
Трудоемкость и длительность процесса получения трансгенных организмов. Сложность при очистке молока. |
|
Трансгенные козы (очистка из молока) |
3-4 г/л |
|
|
Pichia pastoris |
1 г/л |
Снижение биологической активности за счет отсутствия адекватных механизмов внесения специфических пострансляционных модификаций в организмах-продуцентах |
|
Aspergillus sp. |
2 г/л |
|
|
Трансгенный рис |
1,6 мг/г семян |
|
|
Куриное яйцо |
0,8 мг/яйцо |
Сложность получения трансгенных яиц, низкий выход |
На сегодняшний день в продаже имеется лактоферрин человека, полученный при помощи грибков рода Aspergillus [7], а также из риса. Компания Agennix (США) выполнила исследования рекомбинантного лактоферрина человека из Aspergillus awamori. Но биологическая доступность препарата составила менее 0,5 %. Вследствие отличий в механизмах пострансляционной модификации в клетках низших и высших эукариот белок, полученный из Aspergillus, структурно и функционально отличается от природного. Более того, использование грибов Aspergillus для продукции рекомбинантных белков связано с высоким риском загрязнения афлатоксинами, являющиеся потенциальными канцерогенами [3].
В США, Японии, Китае проводятся эксперименты по получению лактоферрина из трансгенных растений риса, табака (Nicotiana tabacum), картофеля [14–16]. Получение таких растений основано на природной способности почвенной бактерии Agrobacterium tumefaciens переносить часть собственной ДНК в виде Т-области мегаплазмиды в растительные клетки. Конкретно, эта часть Ti-плазмиды была использована учёными для переноса генно-инженерных конструкций, включающих целевой ген [10, 17].
Способ получения целевого белка включает следующие стадии: 1) построения вектора, содержащего промоутер и ген лактоферрина, 2) введение вектора в Agrobacterium, 3) преобразования Agrobacterium в растительную клетку и 4) массовое производство белка-лактоферрина с использованием трансформированных клеток растений [20].
Хотя мысль внедрения гена лактоферрина в растительный геном для выработки белка в растении представляется перспективной, этот подход не лишен недостатков. Среди них необходимо отметить низкий уровень экспрессии лактоферрина, даже при использовании сильных промоторов; перегруженность углеводным компонентом, к тому же при получении трансгенных растений в сельскохозяйственных масштабах существует опасность утечки трансгена в окружающую среду в результате переопыления с близкородственными дикорастущими видами (ауткроссинг) [2, 6].
Среди биоректоров на основе клеток позвоночных можно выделить три типа: культура клеток, соматический трансгеноз и генетический трансгеноз. В качестве генетического трансгеноза используют различные классы позвоночных, главным образом, птиц и млекопитающих. Клетки птиц, в отличие от клеток млекопитающих, обладают тем преимуществом, что они не содержат в своем составе вирусов, патогенных для человека, а также прионов, вследствие чего могут служить безопасным источником рекомбинантных белков медицинского назначения. Однако производство белков в культуре клеток птиц в настоящее время используется ограниченно, что связано с проблемами доставки генетического материала.
Культуры клеток растений и млекопитающих для продукции рекомбинантного лактоферрина характеризуются недостаточным уровнем экспрессии гена для последующей очистки продукта и разработки производственной технологии.
Особый интерес представляют работы, посвященные продукции рекомбинантного лактоферрина человека в клетках молочной железы животных-биореакторов (мышей, коз, кроликов и коров) и его секреции в молоко. С крупными животными работают специалисты в Голландии и Китае. Голландские учёные получили трансгенную корову с человеческим лактоферрином в молоке восемь лет назад [18]. Но им удалось добиться концентрации всего 2,8 г/л, причем у последующих поколений животных процент лактоферрина заметно снижался. Дальше научных разработок проект не продвинулся. В Китае у трансгенных коз удалось получить всего 0,7 г/л молока этого уникального белка. Выведением трансгенных коз занимаются также и в Калифорнии [2, 12].
В Финляндии пытались получить трансгенных коров. Но попытка обернулась неудачей, поскольку коровы-биореакторы поголовно страдали маститом. В Эдинбурге, в Рослинском институте, где вывели овцу Долли, разводят также генетически модифицированных кур [3, 13].
Наибольшие успехи в данной технологии удалось достичь белорусским и российским ученым, объединившим свои усилия в рамках проекта «БелРосТрансген». Были созданы первые опытные стада коз, которые продуцируют с молоком бактерицидный белок человека – лактоферрин [17].
Стратегия создания сельскохозяйственных молочных животных в качестве биореакторов основана на введении в геном животных генетических конструкций, содержащих последовательности генов человека, кодирующих биологически активные белки, и управляемых регуляторными элементами одного из «генов молока» коровы или козы [6].
Фрагмент ДНК человека вводят в оплодотворенную яйцеклетку до слияний мужского и женского ядер. После слияния ядер клетку помещают в инкубатор. После начала деления оплодотворенную яйцеклетку пересаживают в другой организм – козу, которая как живой инкубатор выносит плод [8].
Согласно этой стратегии трансгенные животные способны синтезировать на высоком уровне белок человека исключительно в молочной железе и секретировать его в молоко, которое, в свою очередь, становится источником для выделения белка человека.
Такие системы характеризуются высоким выходом целевого продукта, а полученный таким образом рекомбинантный лактоферрин – аутентичностью природному белку. Однако получение рекомбинантного лактоферрина в клетках молочной железы животных-биореакторах in vivo является дорогостоящим процессом, требующим высоких затрат на содержание (особенно в России при среднегодовой температуре ниже нуля), труда и времени, также есть возможность инфицирования продукта прионами и вредного воздействия препаратов на самих животных и др. [2, 5].
Группой российских ученых сотрудников НИИ эпидемиологии и микробиологии им. Н. Ф. Гамалеи РАМН совместно с учёными Московского научно-исследовательского онкологического института им. П. А. Герцена была создана и протестирована новая система для эффективного производства человеческого лактоферрина в куриных яйцах [19]. Разработанная система основана на введении гена лактоферрина в оплодотворённые куриные яйца с помощью частиц аденовируса CELO. Это широко распространённый вирус, не вызывающий у взрослых птиц серьёзных заболеваний. В случае заражения этим вирусом оплодотворённых яиц в них могут накапливаться значительные количества вирусных белков. Уровень содержания человеческого лактоферрина достигал всего 0,8 мг на яйцо [9, 12].
Аденовирусный вектор, несущий в составе генома ген лактоферрина человека, вводят в аллантоис 9–10-дневного куриного эмбриона. Последующее культивирование осуществляют путем инкубации яйца при температуре 37 °C в течение 70–75 часов. Затем выделяют рекомбинантный белок из аллантоисной жидкости куриного эмбриона [11]. Недостатками данной системы являются низкий выход белка и необходимость высокого контроля качества очистки.
Также известны патенты на способы получения лактоферрина человека с помощью: клубники (Патент №WO090184, 2003), кукурузы (Maize), насекомых (Spodoptera frugiperda, Bombyx mori (Патент №WO030517, 1999), Candida (Патент №WO047203, 1999), Saccharomyces cerevisiae и др., однако значительных результатов с помощью данных систем достичь не удалось.
Представляется перспективным использование в качестве продуцента рекомбинантного лактоферрина штамма E. coli в виду хорошо изученной генетики данного микроорганизма, доступности удобных экспрессионных векторных систем и штаммов хозяина, простоты в использовании, низкой стоимости.
При получении рекомбинантного лактоферина с использованием бактериальных культур могут быть реализованы три вида экспрессии гена ltf : цитоплазматическая, периплазматическая и экстраклеточная (рис. 1).
Цитоплазматическая экспрессия предполагает осуществление следующих стадий: клонирование и экспрессия изучаемого гена, выделение и очистка телец включения, солюбилизация агрегированного белка, рефолдинг растворенного белка, получение биологически активного белка. Такой подход имеет ряд преимуществ: высокий выход белка, легкость отделения телец включения от растворимых телец включения, низкая степень деградации белков. Однако у цитоплазматической экспрессии имеются недостатки: отсутствие у белков биологической активности, многостадийный процесс получения биологически активного белка.
Периплазматическая экспрессия включает стадии: конструирование оптимальной для экспрессии в бактериях мРНК, конструирование вектора, клонирование и экспрессия изучаемого гена, выделение из периплазматического пространства и очистка белка, получение белка в биологически активном состоянии. Периплазматической экспрессии присущи достоинства и недостатки. Достоинства метода включают эффективное концентрирование белка, что облегчает дальнейшую очистку; правильное сворачивание белка благодаря окислительному потенциалу плазмы и тиолсульфидным изомеразам. Недостатки метода: сложность и недостаточная изученность транспорта белка в периплазматическое пространство, образование телец включения вследствие высокого содержания дисульфидных связей.
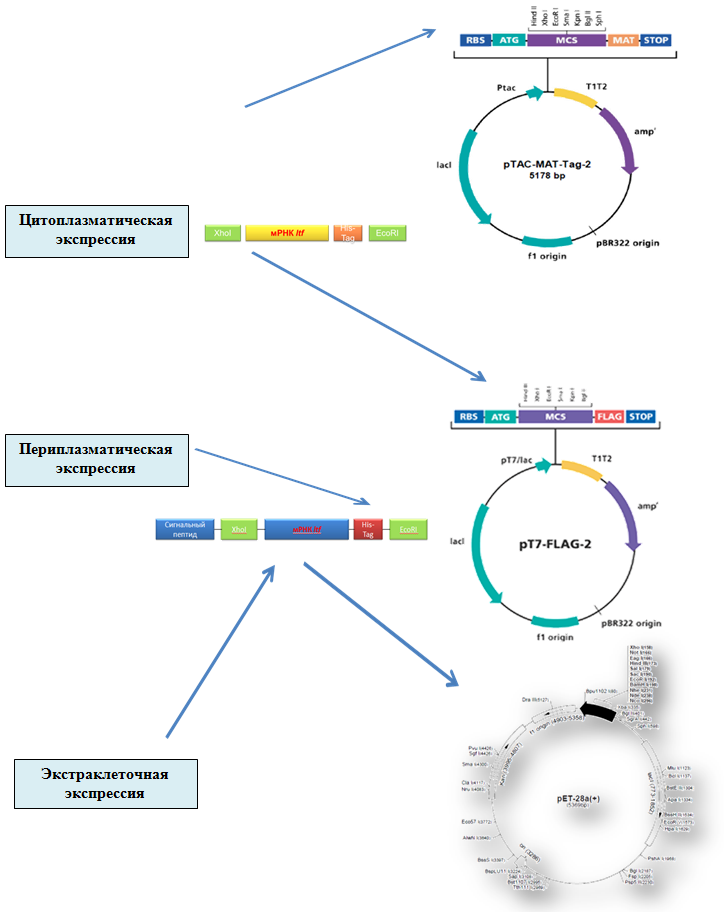
Рис. 1. Схема клонирования гена ltf
Экстраклеточная экспрессия может быть реализована двумя путями. I путь: конструирование оптимальной для экспрессии в бактериях мРНК, конструирование вектора с сигнальным пептидом, клонирование и экспрессия изучаемого гена, индуцирование пермеабилизации внешней мембраны, выделение белка из культуральной среды, получение биологически активного белка. II путь: конструирование оптимальной для экспрессии в бактериях мРНК с С-концевым гемолизином, конструирование вектора, клонирование и экспрессия изучаемого гена, выделение белка из культуральной среды, получение биологически активного белка.
Результаты собственных исследований
На основании проведенного обзора отечественных и зарубежных источников по получению рекомбинантного лактоферрина человека определена цель экспериментальных исследований – разработка способа получения лактоферрина человека с помощью штаммов, осуществляющих его продукцию в цитоплазме и периплазме клеток, а также оптимизация условий культивирования, обеспечивающих получение белка в растворимой форме.
В ходе проведенных исследований синтезирована мРНК лактоферрина человека, исходя из последовательности базы данных GenBank таким образом, чтобы непосредственно за кодирующей последовательностью был расположен участок, соответствующий гексагистидиновой последовательности. В результате индуцируемой экспрессии клонированного гена будет синтезироваться лактоферрин, содержащий дополнительную гексагистидиновую последовательность в С-концевой области полипептидной цепи, позволяющую осуществлять последующую аффинную чистку белка на Ni-NTA-агарозе.
Сконструированы плазмиды рТАС, рТ7 и вектор рЕТ28а+, модифицированный сигнальной последовательностью OmpA, обеспечивающей транспорт белков через внутреннюю мембрану в периплазму, содержащие в своем составе (кДНК) мРНК лактоферрина человека. Полученными плазмидами трансформированы клетки штамма E. coli BL21DE3. Затем исследовалась экспрессия лактоферрина в клетках, трансформированных плазмидами мрЕТ28а+, рТ7 и рТАС при различных температурах (37°С, 23°С, 15°С) с целью выбора оптимального режима. Концентрацию лактоферрина определяли в культуральной среде после разрушения клеток и в растворенных тельцах включения.
В результате экспериментальных исследований установлено, что экспрессия лактоферрина происходит при всех исследуемых температурах и используемых видах продукции (цитоплазма / периплазма клеток). Наибольший синтез белка наблюдается при 37 ºС. Максимальные выходы гибридного белка в растворимой форме достигаются в результате культивирования рекомбинантного штамма при 23 °С. При более высоких (37 ºС) и низких (15 ºС) температурах белок, напротив, накапливается преимущественно в тельцах включения.
Наиболее продуктивным в отношения синтеза лактоферрина является штамм E. сoli BL21DE3 / pT7, осуществляющий продукцию белка в цитоплазме клеток.
Заключение
Проведен обзор известных эукариотических и бактериальных клеточных систем, используемых для получения рекомбинантного лактоферрина, максимально приближенного к лактоферрину человека. Выявлены достоинства и недостатки известных генно-инженерных способов получения лактоферрина человека. Выбран перспективный штамм – продуцент рекомбинантного лактоферрина человека. Предложена схема клонирования гена ltf с реализацией трех вариантов продукции целевого белка: цитоплазматической, периплазматической и экстраклеточной экспрессии.
Проведены собственные исследования по получению рекомбинантного лактоферрина человека с использованием в качестве источника белка штамма E. сoli и сконструированных плазмид мрЕТ28а+, рТ7 и рТАС. Показана экспрессия лактоферрина при всех исследуемых температурных режимах и используемых видах секреции (цитоплазматической / периплазматической). Установлено, что максимальный выход белка наблюдается при температуре культивирования рекомбинантного штамма E. сoli 37 ºС, максимальный выход растворимой формы лактоферрина характерен для температуры 23 °С. Выявлено, что при 37 ºС и 15 ºС рекомбинантный белок накапливается преимущественно в тельцах включения. Определен наиболее продуктивный штамм E. сoli BL21DE3 / pT7, осуществляющий продукцию лактоферрина в цитоплазме клеток.
Работа выполнена в рамках ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009–2013 годы, соглашение на предоставление гранта №14.В37.21.1232 от 14.09.2012 г.
Рецензенты:
Ульрих Е. В., д.т.н., профессор, профессор ФГБОУ ВПО «Кузбасский государственный технический университет им. Т. Ф. Горбачева», г.Кемерово.
Просеков А. Ю., д.т.н., профессор, заведующий кафедрой «Бионанотехнология» ФГБОУ ВПО «Кемеровский технологический институт пищевой промышленности», г.Кемерово.



