Введение
Воспалительный процесс является ведущим патогенетическим звеном многих заболеваний, которые составляют около 80 % всей патологии в практике врача любой специальности. В настоящее время в комплексной терапии острых и хронических заболеваний для купирования боли и уменьшения выраженности воспалительной реакции применяют большое число лекарственных препаратов преимущественно из группы нестероидных противовоспалительных средств и глюкокортикостероидов. Однако наряду с благоприятным фармакологическим действием и достаточной степенью клинической эффективности, все они вызывают ряд нежелательных побочных реакций. В связи с этим остается актуальным поиск высокоэффективных лекарственных средств, подавляющих воспаление и обладающих минимальными побочными реакциями [3].
Известно, что в патогенезе воспаления значительную роль играют свободные радикалы, которые обладают высокой реактогенной способностью. Образование свободных радикалов является физиологической реакцией, но при чрезмерной активации и высоких концентрациях свободных радикалов происходит повреждение мембран клеток и субклеточных структур, что приводит к развитию заболеваний. Одним из подходов в лечении таких заболеваний, патогенетическим фактором которых является свободно-радикальная патология, является использование антиоксидантов.
Известно, что антиоксиданты различной химической структуры обладают противовоспалительными свойствами как при внутреннем, так и при наружном применении (мексидол, димефосфон, витамин Е и др.) [1]. В связи с этим перспективным направлением поиска лекарств является исследование новых противовоспалительных препаратов с антиоксидантной активностью при лечении воспалительных заболеваний широкого круга.
Целью настоящего исследования явилась оценка противовоспалительной активности новых производных тиадиазола на модели «формалиновый отёк лапы» у крыс.
Материалы и методы исследования
Изучение противовоспалительной активности новых производных тиадиазола проводили на модели «острый формалиновый отёк лапы» у крыс [7]. Эксперименты выполнены на 30 белых неинбредных крысах обоего пола массой 170,2±1,2 г. Подопытных животных содержали в условиях вивария (с естественным режимом освещения; при температуре 22–24; относительной влажности воздуха 40–50 %) с использованием стандартной диеты (ГОСТ Р 50258-92). Исследования проводили в соответствии с правилами качественной лабораторной практики (GLP) при проведении доклинических исследований в РФ [4], а также правилами и Международными рекомендациями Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1986) [3]. Перед постановкой эксперимента животные проходили карантин в течение 10–14 дней [6, 7].
Противовоспалительную активность производных тиадиазолов оценивали в экспериментах на модели «формалинового» отека лапы. Острый воспалительный отек вызывали субплантарным введением (под подошвенный апоневроз) в заднюю правую лапу крысы 0,1 мл 2 % водного раствора формалина. Выраженность отека оценивали, измеряя толщину лапки подопытного животного с помощью инженерного электронного штангенциркуля Vorel 15240 (Польша) до и через 2, 4, 6 часов, а также в динамике через 24 и 48 часов после введения раствора формалина. Противовоспалительную активность исследуемых соединений выражали в процентах угнетения отека.
Исследовали действие двух новых производных тиадиазола с лабораторными шифрами ЛХТ 3-10 и ЛХТ 10-10, синтезированных в ОАО «Всероссийский центр по изучению безопасности биологически активных веществ» (ВНЦ БАВ, Россия, Старая Купавна). Перед введением исследуемые вещества разводили в изотоническом растворе натрия хлорида и вводили внутрибрюшинно в терапевтической дозе равной 1/20 LD50 (50 мг/кг). Значение LD50 рассчитывали по данным токсикологических исследований. Оценку острой токсичности новых производных тиадиазола при их однократном внутрибрюшинном введении крысам проводили методом Прозоровского В. Б., Прозоровской М. П. (1980) [5].
Подопытные животные были разделены на 4 группы (по 7 крыс в каждой): 1) крысы, получавшие внутрибрюшинно ЛХТ 3-10 в дозе 50 мг/кг до введения формалина, 2) крысы, получавшие внутрибрюшинно ЛХТ 10-10 в дозе 50 мг/кг до введения формалина, 3) крысы, получавшие внутрибрюшинно кетопрофен в дозе 50 мг/кг до введения формалина, 4) крысы контрольной группы, получавшие внутрибрюшинно изотонический раствор натрия хлорида.
Результаты исследования обработаны статистически с применением стандартного пакета программ MicrosoftOfficeExcel 2003. Для ряда выборок вычисляли среднюю арифметическую и среднюю квадратическую ошибку. Определение нормальности распределения переменных проводили на основании гистограмм распределения, величины асимметрии и эксцесса. Для оценки достоверности различий выборок, имеющих нормальное распределение, применяли параметрический t-критерий Стьюдента. За достоверное принимали различие при уровне вероятности 95 % и более (p <0,05).
Результаты и осуждение
Было выявлено, что при субплантарном введении 0,1 мл 2 % раствора формалина у подопытных крыс развивается выраженный отек лапы, о чем свидетельствует достоверное увеличение ее объема. Отмечено, что максимальный отёк лапки (пик воспаления) развивался через 2 часа после введения формалина, при этом объем лапы у подопытных животных контрольной группы увеличивался в среднем на 29 % (р<0,05). Через 48 часов после введения формалина различий в выраженности отёка в опыте и контролем выявлено не было.
При внутрибрюшинном введении исследованных производных тиадиазола также как и в серии опытов с использованием кетопрофена отмечалось уменьшение выраженности «формалинового» отёка. Так, было выявлено, что уже через 2 часа после введения кетопрофена отек лапы был достоверно меньше на 12,5 %, а после введения производных тиадиазолов ЛХТ 3-10 и ЛХТ 10-10 в среднем на 8 % по сравнению с контролем. Достоверных отличий между самими производными тиадиазола ЛХТ 3–10 и ЛХТ 10–10 обнаружено не было.
При внутрибрюшинном введении кетопрофена (50 мг\кг) выраженность отека лапы подопытных животных была в среднем меньше, чем в контроле.
Таблица 1. Изменение толщины лапы крыс под влиянием производных тиадиазола и кетопрофена на выраженность «формалинового» отека лапы у крыс при формалиновом отеке
|
Серия опыта |
до |
2 часа |
4 часа |
6 часов |
24 часов |
48 часов |
|
Nacl |
3,77±0,09 |
4,88±0,09* |
4,77±0,09* |
4,55±0,09* |
4,30±0,09* |
3,83±0,09 |
|
ЛХТ 3-10 |
3,77±0,09 |
4,56±0,09* |
4,47±0,09* |
4,31±0,09* |
4,09±0,09* |
3,84±0,09 |
|
ЛХТ 10-10 |
3,77±0,09 |
4,49±0,09* |
4,44±0,09* |
4,20±0,09* |
4,01±0,09* |
3,85±0,09 |
|
Кетопрофен |
3,77±0,09 |
4,27±0,09* |
4,17±0,09* |
3,96±0,09* |
3,89±0,09 |
3,83±0,09 |
Примечание: * – различия с контролем (до опыта) достоверны (р<0,05).
Через 6 часов объем лапы у подопытных животных, получавших кетопрофен при «формалиновом отеке», достоверно не отличался от его значения до введения формалина.
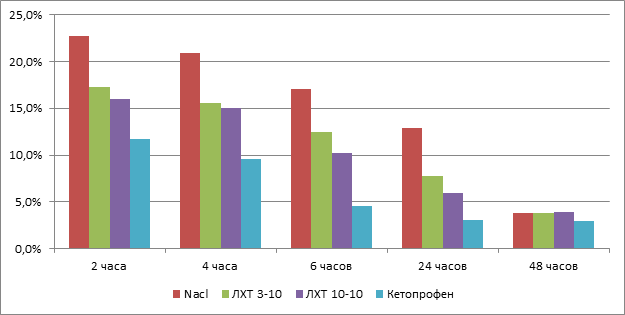
Рис.1. Влияние кетопрофена и новых производных тиадиазола на выраженность формалинового отека лапы крыс
Исследование также показало, что соединение ЛХТ 3-10 и ЛХТ 10-10 проявляют антиэкссудативный эффект, который отмечен через 2, 4, 6 часов от начала эксперимента, а также через 24 часа после введения формалина и сопоставим по силе эффекта и скорости его развития таковой у препарата сравнения кетопрофена.
Введение подопытным животным вещества под лабораторным шифром ЛХТ 3-10 и ЛХТ 10-10 в дозе 50 мг/кг снижало прирост объёма отека на 10 % (p<0,05) по сравнению с животными контрольной группы.
Препарат сравнения кетопрофен также препятствовал развитию воспалительной реакции, уменьшая прирост отека на 29,7 % (p<0,05), что в среднем в 1,1 раза (p<0,05) меньше, чем в группе животных, получивших ЛХТ 3-10, ЛХТ 10-10.
Уменьшение признаков острого экссудативного воспаления в группе крыс, которые получали ЛХТ 3-10, ЛХТ 10-10 и кетопрофен, было отмечено через 4 часа после введения формалина.
Таким образом, результаты экспериментального исследования показали, что среди производных тиадиазола имеются соединения, обладающие противовоспалительной активностью. Возможно, что противовоспалительные свойства новых производных тиадиазола с лабораторными шифрами ЛХТ 3-10 и ЛХТ 10-10 связаны с их антиоксидантными свойствами, обусловленными наличием в их химической структуре пиколиновой и янтарной кислоты.
Полученные результаты позволяют рекомендовать исследуемые соединения с лабораторными шифрами ЛХТ 3-10 и ЛХТ 10-10 для расширенных доклинических испытаний потенциальных лекарственных средств с и противовоспалительной активностью.
Учитывая тот факт, что большинство НПВС обладает ульцерогенной активностью, на следующем этапе экспериментальных исследований оценивали изменения слизистой оболочки желудка у крыс, получавших внутрижелудочно производные тиадиазола.
Анализ результатов показал, что из исследованных 5 новых производных тиадиазола с лабораторными шифрами ЛХТ 1-10, ЛХТ 3-10, ЛХТ 10-10, ЛХТ 12-10, ЛХТ 14-10 низкая выраженность ульцерогенного эффекта наблюдалась у производных тиадиазола с шифрами ЛХТ 3-10 и ЛХТ 10-10. Производные тиадиазола (ЛХТ 1-10, ЛХТ 12-10, ЛХТ 14-10) наряду с препаратом сравнения индометацином вызывали значительные повреждения слизистой оболочки в виде язв, эрозий, кровоподтеков.
Таблица 2
Выраженность ульцерогенного действия новых производных тиадиазола и индометацина при внутрижелудочном введении у крыс
|
№ |
Серия опыта |
Доза мг/кг |
Ульцерогенная активность (баллы) |
|
1. |
1-10 |
50 |
2±0,21 |
|
2. |
3-10 |
50 |
0,25±0,05* |
|
3. |
10-10 |
50 |
0,25±0,06* |
|
4. |
12-10 |
50 |
2,5±0,19 |
|
5. |
14-10 |
50 |
2,5±0,29 |
|
6. |
индометацин |
50 |
2,5±0,15 |
Примечание: * – различия с контролем (до опыта) достоверны (р<0,05).
В последние годы сформировалась новая точка зрения на механизмы повреждения слизистой ЖКТ. Многие исследователи считают, что этот механизм комплексный и обусловлен не только торможением нестероидными противовоспалительными препаратами синтеза простогландинов и нарушением синтеза мукополисахаридов, но и снижением разности трансмукозного потенциала в желудке и повышением обратной диффузии ионов H+, а в кислой среде – проницаемости апикальных мембран слизистой желудка может быть только предпосылкой для формирования повреждений, но одного этого механизма недостаточно для развития повреждений, вызываемых ацетилсалициловой кислотой. В механизме ульцерогенного действия НПВП определенную роль играет и повышение интенсивности перекисного окисления липидов. Образующиеся в результате действия НПВП продукты свободно-радикального окисления принимают участие в поражении ЖКТ, а также могут участвовать в разрушении мукополисахаридов. Есть данные литературы, показывающие, что антиоксиданты уменьшают повреждающее действие НПВП (АСК, индометацина и др). Противоязвенный эффект витамина С, α-токоферола, метилурацила обьясняют именно антиоксидантным механизмом [3].
Следует отметить, что в структуру новых производных тиадиазола входят янтарная (ЛХТ 10-10) и пиколиновая (ЛХТ 3-10) кислоты, придающие соединениям антиоксидантные свойства, что, возможно, имеет значение для реализации их фармакологической активности.
Таким образом, результаты экспериментального исследования показали, что среди производных тиадиазола имеются соединения, обладающие противовоспалительной активностью. Возможно, что противовоспалительные свойства новых производных тиадиазола с лабораторными шифрами ЛХТ 3-10 и ЛХТ 10-10 связаны с их антиоксидантными свойствами, обусловленными наличием в их химической структуре пиколиновой и янтарной кислоты.
Полученные результаты позволяют рекомендовать исследуемые соединения с лабораторными шифрами ЛХТ 3-10 и ЛХТ 10-10 для расширенных доклинических испытаний потенциальных лекарственных средств с их противовоспалительной активностью.
Таким образом, результаты экспериментального исследования показали, что среди производных тиадиазола имеются вещества, обладающие анальгетической и противовоспалительной активностью.
Выводы
1. Среди производных тиадиазола имеются соединения с противовоспалительной активностью.
2. Новые производные тиадиазола с лабораторными шифрами ЛХТ 3-10 и ЛХТ 10-10 при внутрибрюшинном введении в дозе 50 мг/кг (1/20 LD50) уменьшают выраженность формалинового отека лапы у крыс на 8 %
3. Противовоспалительная активность кетопрофена была в среднем в 1,1 раза (р<0,05) выше, чем новых производных тиадиазола с шифрами ЛХТ 3-10 и ЛХТ 10-10.
4. Ульцерогенной активности у новых производных тиадиазола под шифрами ЛХТ 3-10 и ЛХТ 10-10 не наблюдалось.
Рецензенты:
Филлипова О. В., д-р мед. наук, профессор, профессор кафедры фармации последипломного образования БГОУ ВГУ, г. Воронеж.
Платонов И. А., д-р мед. наук, профессор кафедры фармакологии с курсом фармации ФПК и ППС Смоленской государственной медицинской академии, г. Смоленск.



