Введение. Известно, что тимус – орган, подверженный выраженным возрастным инволютивным изменениям, а также острой акцидентальной атрофии различной этиологии. Биологическое старение сопровождается угнетением многих звеньев иммунитета, при этом страдают как клеточный, так и гуморальный иммунный ответ [9]. В настоящее время снижение иммунной реактивности организма вследствие старения считается одной из причин более высокой заболеваемости раком у лиц пожилого возраста [6]. Есть мнение, что одной из причин снижения противоопухолевой резистентности может являться возрастная инволюция вилочковой железы [7].
Расширение знаний о значении тимуса и динамике его морфологических изменений при разных патологических состояниях показали возможную обратимость его инволютивной перестройки [11]. Одним из примеров обратимости инволютивных изменений тимуса является беременность, при которой в железе наблюдаются явления акцидентальной атрофии. Эти признаки развиваются на фоне повышенного уровня гормонов и полностью компенсируются после завершения лактации [5].
Перспективным направлением для исследования внутритимических механизмов возрастной индуцированной атрофии тимуса является изучение нарушений перекрестных взаимодействий между развивающимися тимоцитами и поддерживающей стромой коркового и мозгового вещества долек [4; 8; 10]. В этой связи особый интерес представляет исследование возможности регулирования цитокинового профиля тимопоэтического компонента железы. Одним из соединений, обладающим иммуномодулирующим влиянием на продукцию цитокинов антигенпрезентирующими клетками, является отечественный синтетический препарат полиоксидоний. В наших предыдущих работах было установлено, что курсовое введение полиоксидония сопровождается признаками, указывающими на стимуляцию тимопоэза и повышение функциональной активности тимуса непосредственно после окончания курсового воздействия [1; 3]. В этой связи интерес представляет определение длительности этого эффекта и его возможного влияния на течение возрастных инволютивных изменений тимуса в динамике.
Цель исследования – изучение морфологии и молекулярного фенотипа тимуса через один, три и пять месяцев после курсового введения иммуномодулятора полиоксидоний в сравнении с изменениями при возрастной инволюции.
Материалы и методы исследования. Работа выполнена на 60 белых нелинейных крысах-самцах 5 месяцев массой 180-220 грамм. Уход и содержание животных проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных». Животные были разделены на две группы. Животным первой группы (30 крыс) внутримышечно вводили раствор полиоксидония из расчета 0,1мг/кг 2 раза в неделю в течение 3-х недель. Способ введения и доза рассчитывались исходя из средней терапевтической дозы препарата для человека. Животные второй группы – интактные (30 крыс), служили для определения возрастных инволютивных изменений и контроля. Выведение из эксперимента животных опытной группы проводилось через 30, 90 и 150 суток после окончания введения полиоксидония путем декапитации. Одновременно выводились интактные животные соответствующего возраста. Объектом исследования служил тимус. В работе применялись следующие методы.
1. Иммуногистохимический метод с использованием пяти коммерческих моноклональных (МАКАТ) и поликлональных (ПКАТ) антител фирм Santa Cruze (США) и NovoCastra (Великобритания):
-
МКАТ к кластеру дифференцировки лимфоцитов 3 типа (CD3);
-
МКАТ к кластеру дифференцировки лимфоцитов 68 типа (CD68);
-
ПКАТ к белку нейроэктодермы S-100 для идентификации дендритных клеток;
-
МКАТ к белку-регулятору апоптоза Bcl-2;
-
МКАТ к белку клеточной пролиферации Ki-67.
Материал для исследования методом иммуногистохимии фиксировали 10%-ным нейтральным забуференным формалином в течение 24 ч, выполняли стандартную спиртово-ксилоловую проводку. Подготовленные образцы тканей заливали в парафин, готовили срезы толщиной 4 мкм, которые наносили на высокоадгезивные стекла и высушивали при температуре 37 °С в течение 18 ч. Демаскировка и иммуногистохимическая окраска проводилась на автостейнере Leica Bond Max (Германия). Контролем иммуногистохимической реакции служила неиммунизированная кроличья и мышиная сыворотка. Результат реакции оценивали путем подсчета позитивно окрашенных клеток на 100 клеток в десяти полях зрения при увеличении х400, выражая результаты в процентах и единицах в поле зрения.
2. Окраска срезов тимуса гематоксилином и эозином для изучения общегистологической картины микропрепаратов и проведения линейных морфометрических измерений.
3. Компьютерная морфометрия с использованием лицензионных программ Leica application suite 3.6.0 и «Микроанализ». Данные обрабатывались статистически, достоверность определялась t-критерием Стьюдента.
Результаты исследования и обсуждение. Возрастная инволюция тимуса у крыс 6-10 месяцев сопровождается структурной перестройкой органа, которая проявляется в постепенном уменьшении доли лимфоидной ткани с увеличением количества жировой и фиброзной. Атрофия паренхимы железы выражается в снижении средней площади тимической дольки с 1,52 ±0,02 мм² у крыс 6 месяцев до 0,97 ±0,06 мм² (P<0,01) у крыс 10 месяцев. При этом регистрируется снижение толщины коркового вещества с 328 ±56 мкм до 197 ±34 мкм (P<0,001), а также площади мозгового вещества с 0,61 ±0,04 мм² до 0,46 ±0,05 мм². Отмечается замещение паренхимы жировой тканью, при этом процесс замещения идет с периферических отделов органа. При обработке препаратов тимуса антителами к кластеру дифференцировки лимфоцитов 3 типа в корковом и мозговом веществе выявляются многочисленные зрелые тимоциты. Установлено, что у интактных крыс 6 месяцев позитивную реакцию с CD 3 дают 13% клеток коркового и 53% клеток мозгового вещества (рис. 1). У животных 10 месяцев количество CD3+ тимоцитов коркового вещества достоверно возрастает до 29% (P<0,001), тогда как в мозговом веществе снижается до 35% (P<0,01).
Окраска препаратов интактных крыс 6 месяцев к маркеру нейроэктодермы S-100 выявляет немногочисленные дендритные клетки, локализованные в мозговом веществе и на границе коркового и мозгового вещества. Их количество достигает 18,4±2,9 в поле зрения соответственно. У животных 8 и 10 месяцев отмечается увеличение числа S-100+ клеток до 21,8±2 (P<0,01) и 34,2±5,3 (P<0,001) в поле зрения соответственно. Определение у животных 6 месяцев белка Bcl-2 выявляет немногочисленные позитивные клетки, локализованные в кортико-медуллярной зоне. Количество этих клеток не превышает 2,4±0,12 в поле зрения. У крыс 8 и 10 месяцев количество этих клеток возрастает до 4,7±0,25 (P<0,01) и 3,95±0,4 (P<0,01) соответственно. При исследовании экспрессии CD68 установлено, что большая часть CD68+ макрофагов располагается в мозговом веществе и в кортико-медуллярной зоне, тогда как в корковом веществе этих клеток гораздо меньше. Количество макрофагов в поле зрения у животных 6 месяцев не превышает 24,9±4,37, тогда как у крыс 8 и 10 месяцев достоверно увеличивается до 41,97±3,1 (P<0,01) и 48,36±3,8 (P<0,001) соответственно (рис. 2). Обработка препаратов тимуса интактных крыс 6 месяцев антителами к маркеру клеточной пролиферации Ki-67 выявляет многочисленные пролиферирующие клетки. Индекс Ki-67 у интактных крыс этого возраста составляет 39% в корковом и 11,6% - в мозговом веществе дольки. Инволютивные изменения в тимусе у животных 10 месяцев характеризуются достоверным снижением индекса Ki-67 как в корковом, так и в мозговом веществе дольки до 26,4% (P<0,01) и 6,9% (P<0,001) соответственно.
Через месяц после курсового введения полиоксидония в тимусе крыс отмечается незначительное увеличение морфометрических характеристик дольки, которое выражено в увеличении толщины коркового вещества и площади дольки. При обработке срезов гематоксилином и эозином обращает на себя внимание большая по сравнению с контролем гетерогенность клеточного состава коркового вещества дольки, обусловленная увеличением клеток макрофагального ряда с оксифильной цитоплазмой и небольшим, эксцентрично расположенным ядром. При окраске срезов моноклональными антителами к CD68 отмечается достоверное повышение экспрессии этого антигена в корковом и в мозговом веществе дольки, при этом количество клеток, экспрессирующих CD68, возрастает до 37,2 ±4,03 (Р<0,01) в поле зрения (рис. 3). При обработке срезов антителами к CD3 выявлено достоверное увеличение числа CD3+ тимоцитов коркового вещества до 20,2% (Р<0,01), при этом в мозговом веществе количество этих клеток достоверно не отличается от интактных животных соответствующего возраста (рис. 4). При исследовании распределения антиапоптотического белка Bcl-2 и маркера клеточной пролиферации Ki-67 установлено достоверное повышение экспрессии этих антигенов. При этом клетки, позитивные к Bcl-2, располагаются, преимущественно, в мозговом веществе и в кортико-медуллярной зоне, тогда как число Ki-67+ клеток возрастает в корковом веществе. В мозговом веществе дольки подобного повышения не зарегистрировано. На этом фоне в мозговом веществе и в кортико-медуллярной зоне достоверно больше S-100+ дендритных клеток, количество которых возрастает до 28,3±2,9 (Р<0,01).
При исследовании морфологии тимуса, его морфометрических характеристик и антигенного фенотипа через три месяца после курсового введения полиоксидония достоверные отличия были выявлены лишь в количестве S-100+ дендритных клеток, которых по-прежнему больше, чем у интактных животных соответствующего возраста. При сравнении морфологии и молекулярного фенотипа тимуса через пять месяцев после введения полиоксидония с изменениями при возрастной инволюции у интактных животных соответствующего возраста достоверных отличий не выявлено.
Как показали наши исследования, курсовое введение полиоксидония в средней терапевтической дозе, адекватной применяемой у людей, оказывает на тимус выраженный, но кратковременный иммуностимулирующий эффект. Установлено, что через один месяц после введения полиоксидония в железе имеются признаки повышения тимопоэза, которые проявляются достоверным повышением клеточной пролиферации в корковом веществе и увеличением числа зрелых тимоцитов в этой зоне, а также достоверным повышением экспрессии Bcl-2. Известно, что полиоксидоний способен стимулировать выход из костного мозга клеток-предшественников [2]. Следовательно, повышение клеточной пролиферации и количества зрелых CD3+тимоцитов в корковом веществе, по-видимому, является следствием усиления дифференцировки тимоцитов в зрелые формы.
Другой эффект полиоксидония на тимус реализован влиянием на клеточное звено иммунитета через активацию макрофагов и дендритных клеток. Нами установлено, что через месяц после введения полиоксидония в тимусе существенно больше CD68+макрофагов и S-100+ дендритных клеток по сравнению с тимусом интактных крыс соответствующего возраста. Ранее в наших работах было показано, что введение полиоксидония сопровождается дисбалансом биогенных аминов в структурах дольки тимуса и увеличением количества тучных клеток [1; 3]. Все эти признаки, в совокупности с повышением клеточной пролиферации и дифференцировки тимоцитов, позволяют утверждать, что полиоксидоний обладает выраженным стимулирующим влиянием на центральный орган иммуногенеза - тимус. Тем не менее иммуностимулирующий эффект курсового введения полиоксидония имеет достаточно кратковременный характер, который сохраняется в отдельных клеточных структурах железы через три месяца после воздействия и не оказывает значимого влияния на морфологию и иммунофенотип тимуса при дальнейшем наблюдении. Изменения тимуса у животных с введением полиоксидония через пять месяцев после воздействия не имеют достоверных отличий от интактных крыс соответствующего возраста.
Заключение. Однократное курсовое введение полиоксидония обладает кратковременным иммуностимулирующим эффектом на вилочковую железу, но не изменяет течение ее возрастной инволюции в динамике.
Шифр специальности: 03.03.04 - клеточная биология, цитология, гистология
Рисунки.
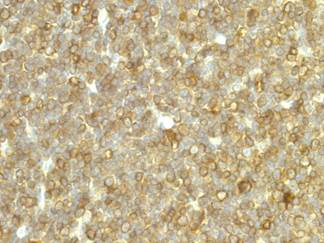
Рисунок 1. Тимус интактной крысы 6 месяцев. Экспрессия CD 3 в тимоцитах коркового вещества. Иммуногистохимическая реакция к CD 3. Ув. 400
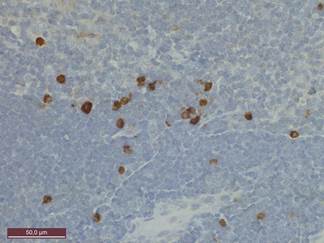
Рисунок 2. Тимус интактной крысы 6 месяцев. Экспрессия CD68 в макрофагах кортико-медуллярной зоны. Иммуногистохимическая реакция к CD 68. Ув. 400
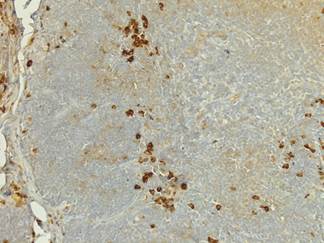
Рисунок 3. Тимус крысы 6 месяцев через месяц после курсового введения полиоксидония. Увеличение макрофагов в корковом веществе и кортико-медуллярной зоне. Иммуногистохимическая реакция к CD68. Ув. 200

Рисунок 4. Тимус крысы 6 месяцев через месяц после курсового введения полиоксидония. Увеличение CD3+ тимоцитов в корковом веществе дольки. Иммуногистохимическая реакция к CD3. Ув. 400
Рецензенты:
Воронов Леонид Николаевич, доктор биологических наук, профессор кафедры биологии и методики преподавания ФГБОУ ВПО «Чувашский государственный педагогический университет имени И.Я. Яковлева», г. Чебоксары.
Долгов Игорь Юрьевич, доктор медицинских наук, профессор, главный врач БУ «Республиканский клинический онкологический диспансер», главный онколог Минздравсоцразвития Чувашской Республики, г. Чебоксары.



