Введение
Мягкие лекарственные формы незаменимы при лечении и профилактике дерматологических заболеваний в целом и терапии раневых процессов различной этиологии в частности. Интерес к ним особенно возрос в последние годы, когда началось развитие нового направления – фитодерматологии. Разработка лекарственных средств на основе растительного сырья является перспективным направлением современного фармацевтического производства. Это обуславливается, прежде всего, эффективностью и мягким действием фитопрепаратов. Низкая токсичность позволяет без риска побочных явлений использовать их в длительной терапии. Включение препаратов растительного происхождения в мази и гели в качестве биодобавок или основных действующих компонентов объясняется не только их терапевтической эффективностью, но и благоприятным воздействием на структуру кожи и организм в целом: способностью ускорять клеточную регенерации, глубоко проникать в подкожную клетчатку, регулируя водно-солевой баланс, активизировать ферментные системы, нормализовать гормональный и общий обмен [4; 6; 7].
Перспективным источником получения высокоэффективных лекарственных препаратов на его основе является прозанник крапчатый (Achyrophorus maculatus L.) – многолетнее травянистое растение семейства астровые (Asteraceae), распространенное преимущественно в европейской части России и в южных районах Сибири [10]. В народной медицине прозанник крапчатый применяют как противовоспалительное, антисептическое, ранозаживляющее, противоопухолевое средство, а также при болезнях кожи [5; 8].
Целью данного исследования явилось морфологическое изучение репаративных процессов в кожной ране при использовании гелей различных составов.
Материалы и методы
Экспериментальное исследование in vivo было выполнены на 54 белых крысах-самцах линии Wistar, массой 180,0±20,0 г, прошедших карантин в виварии ГБОУ ВПО «КГМУ». Все животные содержались в одинаковых условиях на стандартном пищевом рационе.
Экспериментальным животным под эфирным наркозом моделировали инфицированную рану, для чего на выбритом от шерсти участке спины иссекали кожу с подкожно-жировой клетчаткой размером 15x15 мм. Для стандартизации условий лечения, предупреждения деформации раны, а также для предупреждения высыхания, загрязнения раневой поверхности и укусов другими животными над раной подшивали к коже «Устройство для защиты ран» [3].
Животные были разделены на 3 серии по 18 в каждой, из которых контрольной была серия без лечения. В контрольной серии животным производилась только ежедневная обработка раны 3%-ным раствором перекиси водорода. В первой серии сравнения ежедневно производилась обработка раны 3%-ным раствором перекиси водорода и наложение марлевой салфетки с 5%-ным гелем натрий карбоксиметилцеллюлозы. Во второй серии - ежедневно производилась обработка раны 3%-ным раствором перекиси водорода и наложение марлевой салфетки с 15%-ным гелем на основе густого экстракта травы прозанника крапчатого. Перевязки экспериментальным животным во всех сериях производили один раз в день, ежедневно в течение 10 суток [2].
Гистологическое изучение раневых биоптатов производили на третьи, седьмые и десятые сутки от начала лечения. Животных выводили из эксперимента путем передозировки эфирного наркоза. Забор материала осуществляли путем иссечения участка мягких тканей дна и прилежащего края раны. Взятый материал сразу фиксировали в 10%-ном растворе нейтрального формалина с последующей проводкой по восходящим спиртам и заливкой в парафин по стандартной методике. Затем изготавливали гистологические срезы толщиной 5-7 мкм и окрашивали гематоксилином и эозином [2; 9].
Полученные данные обрабатывали статистически посредством электронных таблиц Microsoft Excel и «Биостатистика»: вычисляли средние арифметические, стандартное отклонение. Нормальность распределения признаков определяли по критерию Шапиро-Уилка. Обработку результатов проводили с использованием непараметрических критериев для множественных выборок Крускала-Уоллиса и Ньюмена-Кейлса. При уровне значимости p<0,05 выявленные различия считались статистически значимыми [1].
Результаты и их обсуждение
В результате проведенного экспериментального исследования были получены следующие данные: в гистологических препаратах кожи и подлежащих тканей были выявлены выраженные некробиотические и дистрофические изменения, отек и вакуольная дегенерация соединительной ткани, паретические изменения и тромбоз сосудов, обширные очаги кровоизлияний с формированием рассеянных, очаговых или диффузных, воспалительных инфильтратов (рис. 1, 2).
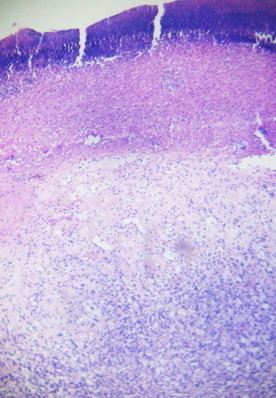
Рис. 1. Некробиотические и дистрофические изменения слоев кожи на третьи сутки эксперимента с использованием 5%-ной NaКМЦ. Окр. Г+Э. Увел. х90.
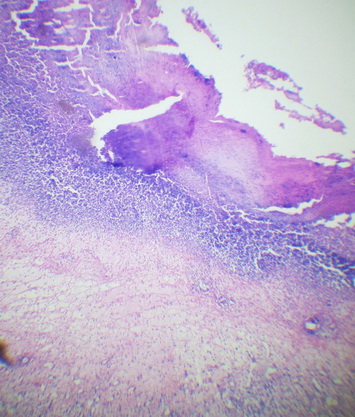
Рис. 2. Некробиотические и дистрофические изменения слоев кожи на третьи сутки эксперимента с использованием 15%-ного геля на основе густого экстракта травы прозанника крапчатого. Окр. Г+Э. Увел. х90.
Отмечались глубокие нарушения многослойного плоского ороговевающего эпителия, его деструкция, очаги изъязвления, отторжения, в участках, прилежащих к раневому дефекту, эпителий резко истончен, ярко-розового цвета с плохо различимыми контурами клеток, ядра клеток уплощены, слабо базофильны и длинником своим расположены параллельно поверхности кожи. Выражены изменения придатков кожи: волосяных луковиц, сальных и потовых желез (рис. 3, 4).
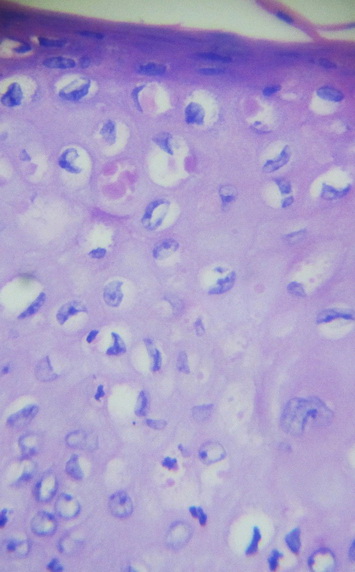
Рис. 3. Деструктивные изменения эпидермиса в участках, прилежащих к раневому дефекту. Окр. Г+Э. Увел. х400.
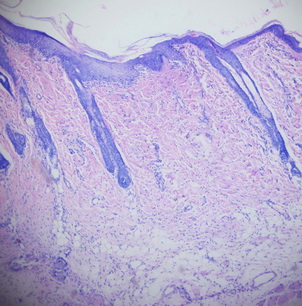
Деструктивные изменения затрагивали все слои кожи. Очаговые или диффузные воспалительные инфильтраты были представлены преимущественно палочко- и сегментоядерными нейтрофилами, эозинофилами, лимфоцитами, тучными клетками, находящимися в стадии дегрануляции и макрофагальными элементами (рис. 5, 6).
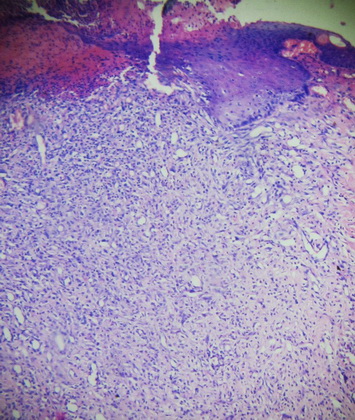
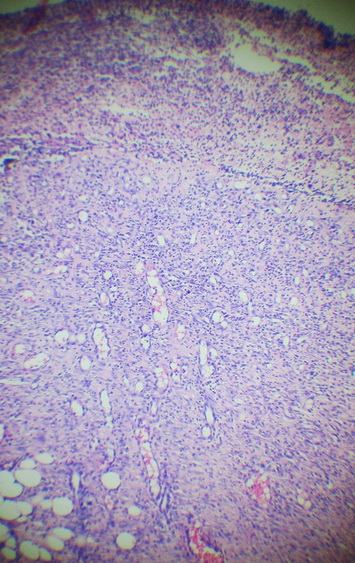
Рис. 6. Внешний вид грануляционной ткани, инфильтрированной полиморфноядерными лейкоцитами в препаратах с использованием 15%-ного геля на основе густого экстракта травы прозанника крапчатого. Окр. Г+Э. Увел. х90.
Сосуды дермы и гиподермы расширены и полнокровны. В большинстве сосудов наблюдались краевое стояние лейкоцитов и микротромбозы (рис. 7). В периваскулярной ткани видны многочисленные кровоизлияния (рис. 8).
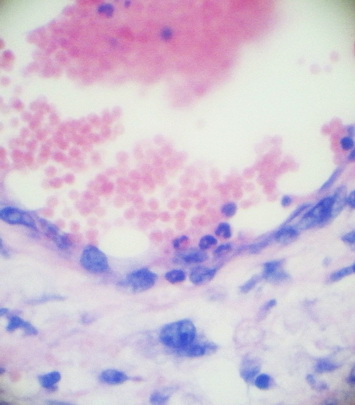
Рис. 7. Краевое стояние лейкоцитов. Окр. Г+Э. Увел. х400.
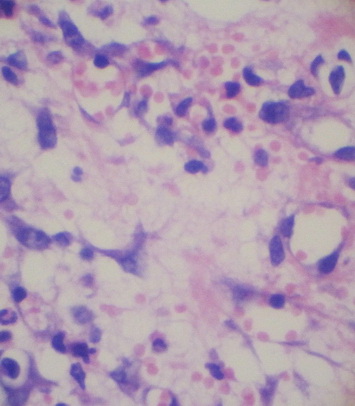
В подкожно-жировой клетчатке выявлена лейкоцитарная инфильтрация, которая в большей степени выражена на границе с собственной мышцей кожи. Мышечные волокна фрагментированы, окружены круглоклеточным инфильтратом.
Представленная морфологическая картина изменений характерна на 3-и сутки для всех экспериментальных групп.
При микроскопическом исследовании на 7-е сутки (рис. 9, 10, 11) репаративной регенерации кожи отмечается нарастание лейкоцитарной инфильтрации грануляционно лейкоцитарного вала, который четко отграничивает некротические участки.
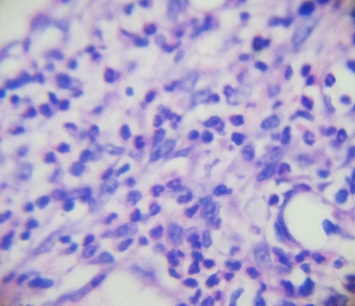
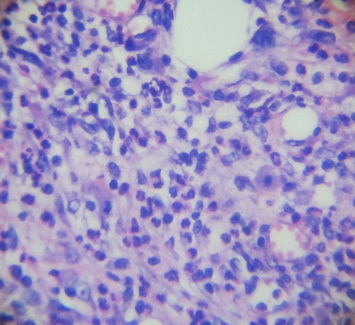
Рис. 10. Клеточный компонент грануляционной ткани на первые сутки в серии с использованием 5%-ной NaКМЦ.
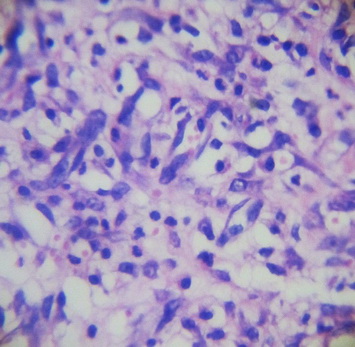
Наблюдается пока еще недостаточно зрелая грануляционная ткань, которая хорошо васкуляризована, так как процессы неоангиогенеза ярко выражены, в некоторых участках наблюдается незначительный интерстициальный отек. При этом выявляется выраженная клеточность грануляционной ткани: в большом количестве в поле зрения наблюдаются не только фибробласты, фиброциты, гистиоциты, лимфоциты, но и нейтрофильные гранулоциты, особенно в неэпителизированных отделах, прикрытых струпом, т.е. клеточный компонент существенно преобладает над волокнистым.
К 10-м суткам эксперимента по краям дефекта раны идет подрастание эпидермального пласта под некротические участки. Дерма – с сохраненной структурой и пролиферацией клеток в стенках волосяных влагалищ, с неравномерной толщиной вновь образующихся стержней. В участках, содержащих грануляционную ткань, в поле зрения, среди клеточной массы преобладают фибробласты. Постепенно волокнистый компонент начинает преобладать над клеточным, и процесс регенерации завершается формированием рубцовой ткани, представляющей собой пучки грубых коллагеновых волокон с расположенными среди них немногочисленными клетками и сосудами (рис. 12, 13).
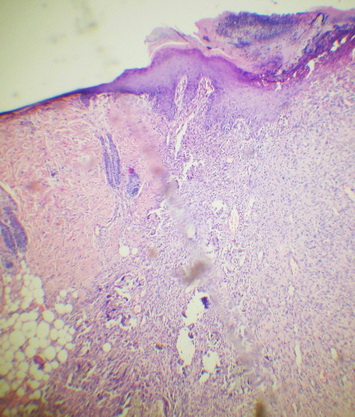
Рис. 12. Подрастание эпидермального пласта к десятым суткам эксперимента. Окр. Г+Э. Увел. х90
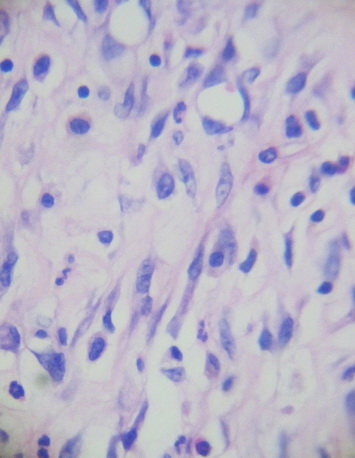
Рис. 13. Новообразованная соединительная ткань с преобладанием клеток фибробластического ряда. Окр. Г+Э. Увел. х400.
Картина воспалительно-репаративного процесса в разных экспериментальных группах имела достоверные отличия, начиная с 7-х суток эксперимента. Так, на 7-е сутки в контрольной серии с использованием перекиси водорода и серии с использованием 5%-ной NaКМЦ наблюдалось снижение толщины и количества слоев эпидермиса в участках кожи, прилегающих к ране, в сравнении с серией эксперимента с использованием 15%-ного геля на основе густого экстракта прозанника крапчатого, где эпидермальная кинетика была более выразительна. В ростковых слоях эпидермиса в третьей группе наблюдалось значительно большее количество клеток, находящихся в стадии митотического деления. Площадь некротических изменений и вновь образованной грануляционной ткани была достоверно меньше в третьей серии эксперимента. Грануляционная ткань состояла из большего количества формирующихся сосудистых петель, ориентированных перпендикулярно к раневой поверхности, и многочисленных тяжей фибробластов, среди которых встречались клетки с митозами. Грануляционная ткань диффузно инфильтрирована лимфоцитами, с обилием тучных клеток и макрофагами, в сравнении с первой и второй группами эксперимента, где преобладала полиморфноклеточная лейкоцитарная инфильтрация (рис. 14-16).
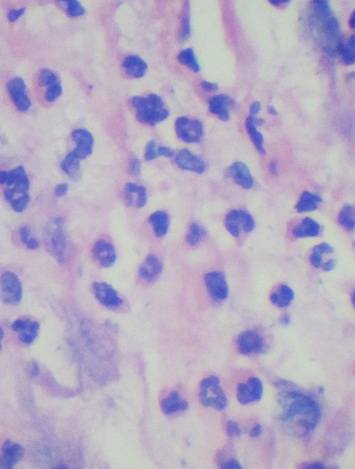
Рис. 14. Преобладание полиморфноклеточной лейкоцитарной инфильтрации в контрольной серии. Окр. Г+Э. Увел. х900.
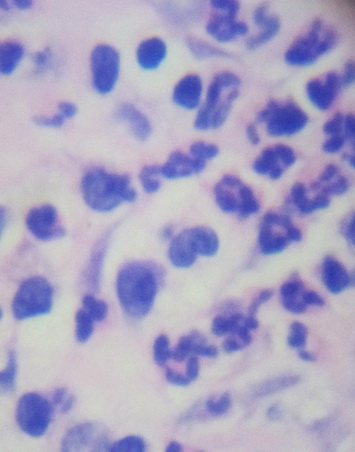
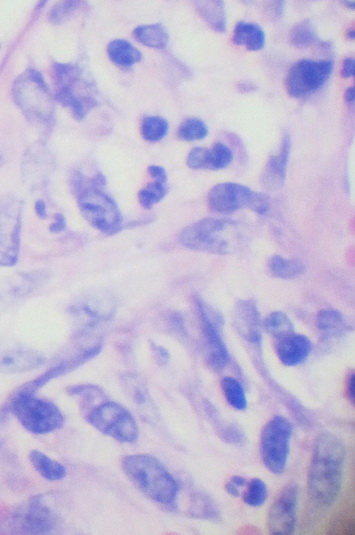
Рис. 16. Преобладание элементов фибробластического ряда в серии с использованием 15%-ного геля на основе густого экстракта травы прозанника крапчатого. Окр. Г+Э. Увел. х900.
К 10-м суткам эксперимента скорость регенераторных процессов была существенно ниже в первой и второй группах, где эпителизация раневой поверхности была завершена не полностью. В центральных участках сохранялись некротические массы, которые прорастали регенерирующий эпителий в виде надвигающегося вала. Подлежащая грануляционная ткань незрелая с преобладанием клеточных элементов соединительной ткани – фибробластов.
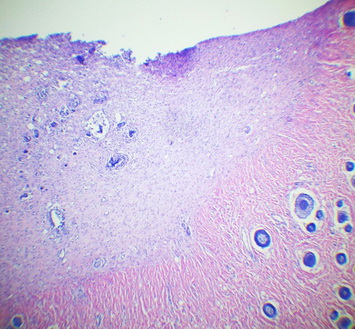
Рис. 17. Степень эпителизации раневой поверхности к десятым суткам эксперимента в контрольной серии. Окр. Г+Э. Увел. х90.
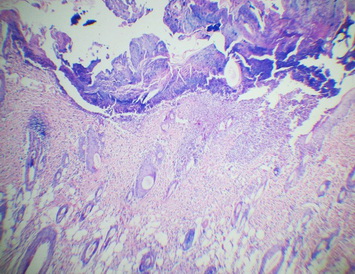
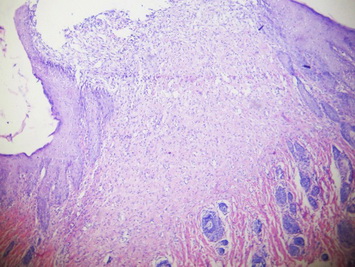
В группе животных, получавших в качестве лечения 15%-ный гель на основе густого экстракта прозанника крапчатого, на 10 сутки произошла полная эпителизация раны. При большом увеличении видно, что в сформировавшемся регенерате грануляционной ткани преобладают волокнистые структуры над клеточными элементами - фибробластами, что указывает на высокую степень зрелости грануляционной ткани (рис. 17-19).
Выводы
- Таким образом, полученные результаты морфологического исследования показывают, что 15%-ный гель на основе густого экстракта травы прозанника крапчатого обладает хорошо выраженным стимулирующим эффектом на пролиферативную и функциональную активность клеток грануляционной ткани, который со временем возрастает.
- Несмотря на практически полное восстановление эпидермиса, произрастающего от краев раневой поверхности, на отдельных участках частично сохранился струп, при использовании перекиси водорода и 5%-ной NaКМЦ. Оценка количества клеточных элементов на стандартной единице площади среза показала более высокое их содержание в грануляционной ткани, чем в группе с использованием геля, что говорит о меньшей степени зрелости этой ткани.
- Реактивные изменения дермы, а именно ее клеточная плотность в группах с использованием перекиси водорода и 5%-ной NaКМЦ была значительно выше уже на начальных сроках эксперимента, в сравнении с группой с использованием 15%-ного геля на основе густого экстракта травы прозанника крапчатого, что свидетельствует о более затяжном характере воспалительного процесса, следовательно, и о более длительном заживлении раны.
- Относительно большее количество клеток фибробластического ряда у животных с использованием 15%-ного геля на основе густого экстракта травы прозанника крапчатого, чем с использованием перекиси водорода и 5%-ной NaКМЦ, также свидетельствует о повышенной регенераторной активности в этой группе.
- Выявленное максимальное количество макрофагов в группах с использованием 15%-ного геля на основе густого экстракта травы прозанника крапчатого также свидетельствует об ускорении процессов регенерации, так как макрофаги при репаративных и патологических процессах не только модулируют пролиферативную и синтетическую функции фибробластов, но и путем паракринной стимуляции активизируют миграцию и пролиферацию эндотелиоцитов, процессы ангиогенеза.
Рецензенты:
Сипливая Л.Е., д.б.н., профессор, заведующая кафедрой фармацевтической, токсикологической и аналитической химии ГБОУ ВПО «КГМУ», г. Курск.
Шорманов В.К., д.фарм.н., профессор кафедры фармацевтической, токсикологической и аналитической химии ГБОУ ВПО «КГМУ», г. Курск.



