Введение
Жизнедеятельность микроорганизмов вносит существенный вклад в коррозию нефтепромыслового оборудования. По некоторым данным [3], до 80 % коррозионных разрушений в нефтедобывающей промышленности осуществляется сульфатредуцирующими бактериями. В Северной Америке 25–50 % коррозионных повреждений внутренней поверхности трубопроводов являются следствием процессов жизнедеятельности микроорганизмов [10].
На данный момент наиболее распространенным способом борьбы с сульфатредуцирующими бактериями в нефтепромысловых средах является обработка химическими реагентами (ХР) – бактерицидами.
Первым этапом промышленного применения бактерицидов являются лабораторные испытания, в ходе которых определяется принципиальная возможность применения ХР на промысле.
Традиционный способ оценки эффективности ХР относительно планктонных СРБ (РД 39-3-973-83 [6]) включает несколько последовательных этапов: контакт культуры микроорганизмов с реагентом, пересев проконтактировавших клеток на питательную среду Постгейта, термостатирование посевов с последующим наблюдением за состоянием питательной среды. Качественная оценка эффективности ХР производится по наличию или отсутствию черного осадка сульфида железа в питательной среде, образующегося в результате реакции между ионами железа, добавляемого в среду, и сульфид-ионами, являющимися продуктами бактериальной сульфатредукции.
Данная методика, несмотря на широкое применение, имеет определённые недостатки. К ним относятся: неуточнённый состав и отсутствие доноров электронов в воде, применяемой для контакта культуры микроорганизмов с бактерицидом; дополнительные манипуляции с клетками СРБ (пересев после контакта на питательную среду), что может привести к гибели части клеток, задержке их прорастания, следовательно, некоторому искажению результатов; длительное термостатирование посевов и наблюдение за состоянием питательной среды (в течение 15 суток), что, вероятно, обусловлено увеличением длительности лаг-фазы после контакта культуры с ХР.
Известно, что для оценки жизнеспособности бактерий, в том числе и анаэробных, широко применяют такой показатель, как дегидрогеназная активность [7, 8, 9]. Дегидрогеназы принимают непосредственное участие в сульфатном дыхании СРБ, осуществляя отрыв атомов водорода от органических субстратов и транспорт электронов в дыхательную цепь. На наш взгляд, данный показатель вполне мог бы быть применён и для определения эффективности бактерицидов относительно СРБ.
В связи с вышесказанным, целью данного исследования является изучение возможности разработки новой методики определения бактерицидной эффективности реагентов, основанной на измерении относительной дегидрогеназной активности бактерий и компенсирующей вышеуказанные недостатки.
Материалы и методы исследования
Источником выделения СРБ послужила вода с центрального пункта сбора нефти Усть-Тегусского месторождения (Тюменская область, Уватский район). Химический состав воды определяли согласно соответствующим методикам выполнения измерений. Культивирование СРБ производили на среде Постгейта с лактатом натрия (4,0 г/л 50 %-ного раствора) [6]. Активность дегидрогеназ СРБ определяли фотоколориметрически по восстановлению 2,3,5-трифенилтетразолия хлористого в формазан [1, 8]. Количество белка и сероводорода, образуемого выделенными накопительными культурами СРБ, определяли методом О. Лоури [2] и йодометрическим титрованием [6], соответственно. Кинетические параметры роста культуры СРБ – удельную скорость роста и время удвоения биомассы – вычисляли по формулам, предложенным А. И. Нетрусовым с соавторами [5], используя данные, полученные при определении концентрации белка.
Бактерицидную эффективность реагентов определяли двумя способами: по вышеуказанной методике [6] и по изменению дегидрогеназной активности СРБ, обработанных реагентом, относительно необработанных бактерий. Активные основы испытуемых реагентов были представлены как самостоятельными веществами, так и смесями: № 1 – алкилдиметилбензиламмоний хлорид (АДБАХ); № 2 – изотиазолон; № 3 – глутаровый альдегид (ГА), 50 %; № 4 и № 5 – 2,2-дибромо-3-нитрилопропиоамид (ДБНПА), 20 % и 100 %, соответственно; № 6 – тетра(гидроксиметил)фосфоний сульфат (ТГФС), 75 %; № 7 – смесь глутарового альдегида (10–30 %), формальдегида (10–30 %) и четвертичных солей аммония (1–5 %).
Контакт культуры СРБ с реагентами в обоих вариантах производили в пенициллиновых флаконах в течение 24 часов. Для этого применяли модели пластовой воды – источника выделения данной культуры СРБ, с лактатом натрия в качестве донора электронов. По истечении времени контакта во флаконы, предназначенные для определения дегидрогеназной активности, вносили по 1 мл 0,5 %-ного раствора 2,3,5-ТТХ (MP Biomedicals, USA) и инкубировали при температуре 33,5 о С, через 24 часа проводили экстракцию образовавшегося формазана ацетоном и анализировали оптическую плотность экстрактов на фотоэлектроколориметре при λ=485 нм. Калибровочный график для определения концентрации формазана строили по 0,025 %-ном раствору трифенилформазана (MP Biomedicals, USA) в ацетоне.
Параллельно этому опыту из флаконов, предназначенных для оценки бактерицидной эффективности по РД, по истечении времени контакта отбирали по 5 мл жидкости, переносили их в чистые флаконы, которые доливали средой Постгейта под пробку и инкубировали при температуре 33,5 о С в течение 14 суток, отмечая появление признаков роста СРБ (помутнение среды и появление черного осадка сульфида железа).
Для каждой концентрации реагента испытания проводили в трёх повторностях. О бактерицидной эффективности реагентов судили по изменению концентрации формазана в опытных флаконах по отношению к контрольным (не обработанная реагентом накопительная культура бактерий) и отсутствию признаков роста СРБ (при оценке по РД).
Результаты и обсуждение
Основываясь на данных химического анализа пластовой воды Усть-Тегусского месторождения, послужившей источником выделения исследуемых бактерий, можно предположить, что виды выделенной накопительной культуры СРБ, являясь обитателями слабосоленых вод, относятся к нейтрофильным (по отношению к рН – 6,42), мезофильным (по отношению к температуре – плюс 40 °С) (табл. 1).
Численность СРБ в накопительной культуре – 107 КОЕ/мл. Концентрация образуемого за 15 суток сероводорода – 352 ± 4,25 мг/л. Во время экспоненциальной фазы удельная скорость роста культуры СРБ составила 0,09 ч-1, время удвоения биомассы – 7,7 ч.
Таблица 1
Физико-химические условия среды обитания СРБ, выделенных из пластовой воды Усть-Тегусского месторождения *
|
pH |
Содержание ионов, мг/л |
|||||||
|
Cl- |
HCO3 |
SO42 |
CO32- |
Ca2 |
Mg2+ |
Na++K+ |
Feобщ |
|
|
6,42 |
13756,25 |
610,0 |
8,44 |
не обнаруж. |
1290,0 |
114,0 |
7444,64 |
7,80 |
Примечание: * – суммарная минерализация – 23231,13 мг/л; тип воды по В. А. Сулину – хлор-кальциевый; температура среды при отборе пробы – 40 о С.
При изучении динамики изменения дегидрогеназной активности исследуемой культуры СРБ в течение 192 часов выявлено, что максимум активности дегидрогеназ (в 16 больше раз по сравнению с начальным значением) приходился на 48 часов инкубации (0,034±0,006 и 0,544±0,022 мг формазана/мл культуры в сутки). В дальнейшем (на 52 часа инкубации и далее) достоверных различий по дегидрогеназной активности не наблюдалось (при 5 %-ном уровне значимости) (рис. 1).
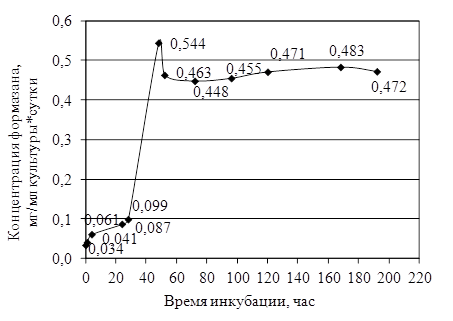
Рис. 1. Динамика изменения дегидрогеназной активности накопительной культуры СВБ Усть-Тегусского месторождения
Данная накопительная культура СРБ по сравнению с культурой СРБ Приобского месторождения, исследованной в работе О. В. Зайцевой [1], является более активной (при такой же численности СРБ в культуре её удельная скорость роста в течение экспоненциальной фазы роста в среднем составляла – 0,026 ч-1, время удвоения биомассы – 26,65 ч, продукция формазана – 0,155 мг/мл культуры в сутки).
Поскольку максимальная дегидрогеназная активность была зафиксирована на вторые сутки инкубации культуры СРБ, для испытаний применяли 2–3-х-суточную накопительную культуру (после пятикратного пересева).
Результаты, полученные при определении бактерицидной эффективности реагентов двумя различными способами, отражены на рис. 2.
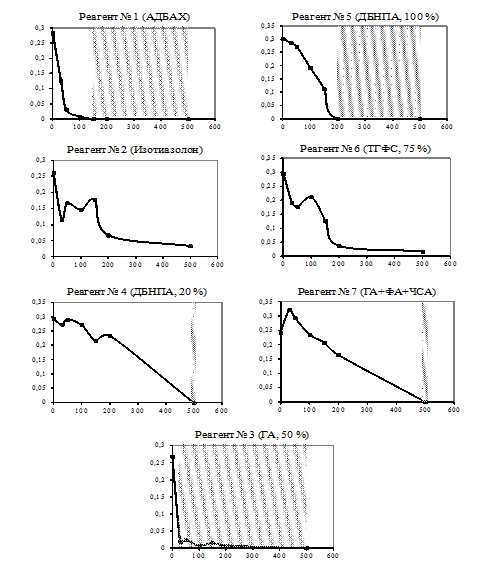
Примечание: (по оси абсцисс – концентрация реагента, мг/л, ординат – дегидрогеназная активность, мг формазана на мл культуры в сутки; штриховкой отмечены эффективные концентрации бактерицидов, определенные по стандартной методике).
Рис. 2. Сопоставление результатов определения бактерицидной эффективности ХР с изменением дегидрогеназной активности СРБ
Реагенты № 4 и № 7 проявили 100 %-ную эффективность по РД только при 500 мг/л, отсутствие активности дегидрогеназ было зарегистрировано также при концентрации этих ХР 500 мг/л. При меньших концентрациях этих реагентов наблюдался рост бактерий на среде Постгейта и зафиксирована дегидрогеназная активность, а при 30–50 мг/л наблюдалось незначительное увеличение активности дегидрогеназ, которое не было статистически подтверждено (при 5 %-ном уровне значимости).
Реагенты № 2 и № 6 не были эффективны при исследуемых концентрациях. Известно, что для изотиазолона (активная основа реагента № 2) характерна наиболее низкая из всех представителей неокисляющих бактерицидов скорость воздействия, а ТГФС (активная основа реагента № 6) может быстро биоразалагаться. Возможно, именно эти факторы явились причиной неэффективности данных реагентов. Однако при высоких концентрациях данных реагентов (200-500 мг/л) отмечено достоверное по сравнению с контролем снижение дегидрогеназной активности СРБ более чем на 74,4 % и 87,8 %, соответственно. Из чего можно предположить, что при более высоких концентрациях данные реагенты могут проявить 100 %-ную эффективность.
Наиболее высокую эффективность показал реагент № 3, обеспечив полное подавление СРБ уже при концентрации 30 мг/л. В сопроводительной информации к данному ХР отмечено, что он обеспечивает полное подавление роста Desulfovibrio desulfuricans (один из видов СРБ) в количестве 106 КОЕ/мл при концентрации 40 мг/л – в течение 24 часов, а при концентрации 80 мг/л – в течение 7 часов. Таким образом, эффективность реагента № 3 подтверждается результатами и наших испытаний.
Результаты определения дегидрогеназной активности, полученные с реагентом № 3, не совпадали с результатами, полученными по традиционной методике. Так, во флаконах, содержащих 2,3,5-ТТХ, наблюдалось появление слабо-розовой окраски (достоверное снижение дегидрогеназной активности культуры СРБ при обработке реагентом № 3 составило более 90,7 % при всех его концентрациях), что могло свидетельствовать о присутствии в них жизнеспособных бактерий, в то время как на среде Постгейта рост отсутствовал.
Наличие розовой окраски могло быть обусловлено неполным подавлением сульфатредуцирующих бактерий. Для выявления жизнеспособных СРБ был сделан посев из данных флаконов на питательную среду Постгейта, при этом рост СРБ не наблюдался, а определение количества белка в этих флаконах не показало достоверных различий между ними и контролем среды (средой без СРБ и реагента). Анализируя полученные результаты, можно предположить, что реагент № 3 в концентрациях от 30 до 200 мг/л неполностью подавил СРБ исследуемой накопительной культуры, о чём свидетельствует наличие их незначительной дегидрогеназной активности. Однако в результате его воздействия клетки бактерий стали некультурабельными, и именно поэтому их рост на среде Постгейта не был зафиксирован.
Следует отметить, что авторы работы [4] по оценке бактерицидных свойств четвертичных солей аммония и глутарового альдегида (веществ, являющихся активными основами реагентов № 1 и № 3) в отношении СРБ, выделенных из пластовых вод других нефтяных месторождений, сообщают о высокой бактерицидной эффективности этих соединений при оценке традиционным способом (АДБАХ – 80-200 г/м3, глутаровый альдегид – 50-100 г/м3). Близкие к этим результаты получены и в нашей работе.
Таким образом, сопоставление результатов определения бактерицидной эффективности различных реагентов, полученных в ходе измерения дегидрогеназной активности СРБ и по общепринятой методике, выявило их схожесть. Это указывает на возможность разработки методики определения бактерицидной эффективности реагентов относительно СРБ, основанной на измерении дегидрогеназной активности накопительной культуры микроорганизмов.
Выводы
Накопительная культура сульфатредуцирующих бактерий (СРБ), выделенная из вод системы ППД Усть-Тегусского месторождения, является мезо- и нейтрофильной, обладает высокой дегидрогеназной активностью.
При определении бактерицидной эффективности реагентов с различными активными основами двумя методами: по выживаемости СРБ на среде Постгейта после обработки реагентом и по изменению дегидрогеназной активности получены сходные результаты.
Показана возможность ускоренного определения бактерицидной эффективности реагентов относительно СРБ, основанной на измерении дегидрогеназной активности накопительной культуры микроорганизмов. Основные преимущества предлагаемой методики по сравнению с традиционной:
- отсутствие пересева проконтактировавших клеток снижает трудоемкость, объемы вовлекаемых материалов (лабораторной посуды, реактивов) и вероятность искажения результатов за счет минимизации времени контакта СРБ с кислородом;
- возможность получения результатов в более краткие сроки по сравнению с традиционной методикой (1 сутки и 15 суток после контакта СРБ, соответственно);
- показатель активности ферментов микроорганизмов можно использовать как критерий жизнеспособности клетки.
Рецензенты:
Соромотин Андрей Владимирович, доктор биологических наук, директор НИИ экологии и рационального использования природных ресурсов, ФГБОУ ВПО «Тюменский государственный университет Минобрнауки России», г. Тюмень.
Петухова Галина Александровна, доктор биологических наук, профессор кафедры экологии и генетики ФБГОУ ВПО «Тюменский государственный университет Минобрнауки России», г. Тюмень.



