Введение
Белок теплового шока семейства 90 (Hsp90) относится к классу внутриклеточных белков-шаперонов и обеспечивает фолдинг вновь синтезированных белков, сборку мультимолекулярных комплексов, участвуют в транспорте белков и пептидов между клеточными органеллами и деградации белков, предотвращают агрегацию и денатурацию белков при различных видах стресса [1]. Выявлено более 100 внутриклеточных белков-клиентов Hsp90, многие из которых связаны с онкогенезом. В этой связи ингибирование внутриклеточного Hsp90 с помощью природных и синтетических ингибиторов оказалось перспективным направлением в создании противоопухолевых препаратов [9]. Кроме выполнения внутриклеточных функций, Hsp90 обнаружен во внеклеточном пространстве и на клеточной мембране [8], где участвует в формировании врожденного и приобретенного иммунитета, в том числе противоопухолевого иммунитета, способен выступать в качестве «сигнала опасности» в организме [1]. Комплексы Hsp90 с опухолевыми пептидами, очищенные из опухолевых клеток, рассматриваются в качестве возможных противоопухолевых вакцин. Показано, что экстраклеточный Hsp90 участвует в процессе миграции нормальных и опухолевых клеток, а также в инвазии опухолевых клеток [3, 4, 9]. Hsp90 способен стимулировать миграцию кератиноцитов, микроваскулярных эндотелиальных клеток и дермальных фибробластов при заживлении ран и может лечь в основу препаратов ранозаживляющего действия [1, 9]. Ингибирование экстраклеточного Hsp90 снижает инвазивность опухолевых клеток [9], в связи с чем экстраклеточный Hsp90 считается перспективной молекулярной мишенью для разработки противоопухолевых препаратов, ингибирующих метастазирование опухолей.
Для поиска ингибиторов внутриклеточного и экстраклеточного Hsp90, разработки противоопухолевых вакцин на основе Hsp90, а также разработки препаратов ранозаживляющего действия на основе Hsp90 необходимо наличие простых и эффективных методов очистки Hsp90 из тканей и клеток. Известные традиционные методы очистки Hsp90 являются многостадийными и включают несколько видов хроматографии: гидрофобную, ионообменную в сочетании с гель-фильтрацией и адсорбционную на колонке с гидроксилапатитом, являются достаточно продолжительными и малоэффективными [5]. Целью данной работы была разработка простого и эффективного метода очистки функционально активного Hsp90 из различных клеток и тканей с использованием тиофильной хроматографии.
Методика исследования
В работе использовали клеточные линии A-172 (глиобластома человека), HT1080 (фибросаркома человека), ВНК21 (почка сирийского хомяка) и NIH3T3 (фибробласты мыши) из коллекции клеточных культур Института цитологии РАН. Клетки выращивали в среде ДМЕМ, содержащей 10 % эмбриональной бычьей сыворотки (ЭБС) и антибиотики (по 40 ед. пенициллин, стрептомицин, гентамицин) (ДМЕМ-10%ЭБС). Мозги мыши получали от мышей Balb/c из вивария Института биофизики клетки РАН. Мозги быка получали с бойни Серпуховского района.
Для очистки Hsp90, ткани мозга быка и мыши гомогенизировали с использованием гомогенизатора Поттера в 6-ти объемах 10 мМ Трис-HCl буфера (pH 7,4), содержащего 10 мМ NaCl и ингибиторы протеаз (ФМСФ (1 мМ), апротинин (2 мкг/мл), леупептин (2 мкг/мл), пепстатин А (2 мкг/мл)). Гомогенат центрифугировали в течение 20 мин при 20000 g, надосадочную фракцию фильтровали и центрифугировали в течение 2 ч при 100000 g. К осветленному супернатанту добавляли аммоний сульфат (АС) до 40 %-ного насыщения и оставляли на 4 ч при температуре 4°С. Осадок белков удаляли центрифугированием (20 мин, 20000 g, 4°С). Супернатант доводили сухим АС до 80 %-ного насыщения, инкубировали в течение 12 ч при температуре 4°С, а затем центрифугировали (20 мин, 20 000 g, 4°С). Осадок (фракция 40–80 % АС) растворяли в фосфатно-солевом буферном растворе (ФСБР, 150 мM NaCl, 5 мМ Na-фосфатный буфер, рН 7,3), содержащим 15 % АС (ФСБР-15%АС). Препарат трижды наносили на колонку с тиофильным гелем (Т-гель), уравновешенным в ФСБР-15 % АС. Т-гель получали по методу Porath et. al. (1985) [7]. Колонку промывали 100 объемами уравновешивающего буфера. Элюцию белков проводили ФСБР-5 % АС. Элюированные белковые фракции диализовали против 20 мМ Tрис-HCl (pH 7,4) буфера, содержащего 20 мМ NaCl. Ионообменную хроматографию проводили с использованием ДЭАЭ-Сефарозы, уравновешенную буфером для диализа. Связавшиеся с носителем белки элюировали линейным градиентом NaCl 20-600 мМ в 20 мМ Tрис-HCl (pH 7,4). Фракции анализировали с помощью электрофореза и Вестерн-блот анализа. Hsp90-содержащие фракции объединяли.
Электрофорез проводили в 10 %-ном полиакриламидном геле в присутствии додецилсульфата натрия [2]. Для количественной оценки содержания специфических белков в препаратах гели сканировали и обрабатывали при помощи программы TotalLab v.2.01. Для выявления Hsp90 и других белков теплового шока в Вестерн-блот анализе использовали следующие специфические антитела: Hsp 90αβ (SC-59578, Santa Cruz), Hsp90α (H1832-81, USBiological), Hsp90β (H1832-96, USBiological), Hsc70 (SPA 815, Stressgen), Hsp70 (SPA 810, Stressgen) и Hsp96 (SPA 850, Stressgen).
Для определения цитотоксичности и анти-пролиферативной активности Hsp90 (концентрации 1,0, 0,1 и 0,01 мг/мл) использовали МТТ-колориметрический метод [6]. Анализ проводили на клетках А-172 и НТ1080.
Определение миграции клеток методом нанесения «экспериментальной раны» на монослое клеток проводили с использованием клеток A-172 и ВНК-21, как описано ранее [3, 4]. Площадь зарастания исходной «раны» на клеточном монослое определяли через 6 ч после добавления исследуемых образцов. Определение миграции клеток с помощью вкладышей с полиэтилентерефталат (РЕТ) мембраной (CellSert, Millipore, размер пор 8 мкм) проводили с использованием клеток A-172, HT1080 и NIH3T3, в соответствии со стандартными протоколами. Перед экспериментом клетки выдерживали в среде ДМЕМ, содержащей 0,2 % БСА (ДМЕМ-БСА) в течение 20 ч при 37 °С (голодание). Во вкладыш помещали клетки в среде ДМЕМ-БСА, в качестве хемоаттрактанта в нижнем резервуаре использовали ДМЕМ-5 % ЭБС. Прошедшие за 6 ч через мембрану клетки фиксировали, окрашивали кристалл виолетом, лизировали, переносили в лунки 96-луночного планшета и измеряли оптическую плотность при длине волны 595 нм [4]. Влияние препаратов на миграцию клеток оценивали, сравнивая оптическую плотность А595 контрольных лунок и лунок, в которых клетки инкубировали с образцами Hsp90. Hsp90 исследовали в концентрации 0,1 мг/мл. В качестве контроля использовали среду без Hsp90, а также бычий сывороточный альбумин (БСА) и очищенный Hsp70 быка (концентрация 0,1 мг/мл). Статистическую обработку полученных результатов проводили с использованием t-теста Стьюдента (уровень значимости Р < 0,05).
Результаты и их обсуждение
Первый этап работы был посвящен определению оптимальных условий связывания Hsp90 с Т-гелем и элюции Hsp90 с Т-геля. Для определения оптимальных условий связывания Hsp90 на Т-геле, Hsp90-содержащую фракцию (40–80 % АС) гомогената мозга, растворенную в ФСБР с разными концентрациями АС, наносили на носитель, предварительно уравновешенный теми же растворами. Элюцию связавшихся Hsp90 проводили в ФСБР, в котором наблюдается полная элюция Hsp90. Показано, что при увеличении концентрации АС эффективность связывания Hsp90 с Т-гелем увеличивалась: при 0–10 % АС Hsp90 не связывался с носителем, при концентрации АС 15–20 %, достигалось практически полное связывание Hsp90 с носителем (рис. 1). При 15 % АС в ФСБР достигалась достаточно высокая эффективность связывания Hsp90 с носителем (70–80 %) и более высокая чистота препарата на этом этапе очистки, в сравнении с 20 % АС (рис. 1).
А Б
Б 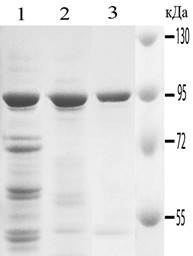
Рис. 1. А. Отработка метода очистки Hsp90 на тиофильном геле. 1 – 4 – оптимизация условий связывания Hsp90 с носителем. Представлены данные электрофоретического анализа исходного препарата (фракция 40-80% АС мозга быка (1)) и фракций, прошедших через Т-гель при связывании в 15 % АС (2), в 20 % АС (3) в 25 % АС (4). 5 – 8 – оптимизация условий элюции Hsp90 с носителя. 5 – исходный препарат (фракция 40-80% АС мозга быка), 6, 7, 8 – фракции, элюированные в ФСБР, ФСБР-7,5 % АС и ФСБР-10 % АС, соответственно. 9 – белковые маркеры. Б. Чистота препарата Hsp90 на различных этапах очистки. 1 – фракция 40–80 % АС мозга быка; 2 – Hsp90 очищенный на Т-геле в оптимальных условиях; 3 – Hsp90 после ионообменной хроматографии.
При отработке условий элюции Hsp90, исходный материал наносили на несколько колонок с Т-гелем при концентрации АС 40 %, обеспечивающей эффективную посадку белка на носитель, а элюирование проводили разными концентрациями АС в ФСБР. Показано, что Hsp90 полностью элюировался с носителя в ФСБР без АС. С увеличением концентрации АС эффективность элюции снижалась; при этом чистота препарата Hsp90 – увеличивалась. Для элюции, нами была выбрана 5 %-ная концентрация АС, как наиболее подходящая для получения максимально чистого белка, с минимальным содержанием примесей (Рис. 1).
Полный цикл очистки Hsp90 включал следующие этапы: гомогенизацию ткани, осветление гомогената центрифугированием, осаждение 40 % АС, осаждение 80 % АС, тиофильную и ионообменную хроматографии. После тиофильной хроматографии, проводимой в оптимальных условиях (посадка – ФСБР-15 %АС, элюция ФСБР-5 %АС) чистота Hsp90 составляла 75–80 %. После ионообменной хроматографии, чистота Hsp90 в объединенной Hsp90-содержащей фракции составляла 97–99 % (табл. 1). Hsp90 одинаково эффективно очищался из мозга быка и мыши. При этом очищались обе изоформы белка – Hsp90a и Hsp90b, не контаминированные другими HSP (Hsp70, Hsс70 и Hsp96), что было продемонстрировано с помощью Вестерн-блота с использованием антител, специфичных к Hsp90a, Hsp90b, Hsp70, Hsс70 и Hsp96. Суммарный выход hsp90 составлял около 50 %.
Таблица 1. Очистка Hsp90 из мозга быка с использованием тиофильной хроматографии
|
|
Потери Hsp90 на разных этапах очистки, (%) |
Степень чистоты Hsp90, (%) |
|
|
Исходная ткань |
0 |
~ 1,0 |
|
|
Гомогенат ткани (после центрифугирования при 20000 g) |
20–25 |
1,0–1,5 |
|
|
Осветленный гомогенат ткани (после центрифугирования при 100000 g) |
~ 5 |
1,5–2,0 |
|
|
Осаждение 40 % АС |
Осадок 40 % АС |
~ 5 |
|
|
Супернатант 40 % АС |
|
3–4 |
|
|
Осаждение 80 % АС |
Осадок 40–80 % АС |
|
3–4 |
|
Супернатант |
~ 5 |
|
|
|
Тиофильная хроматография |
~ 10 |
75–80 |
|
|
Ионообменная хроматография |
~ 10 |
95–97 |
|
Для оценки функциональной активности полученных препаратов Hsp90 исследовали способность Hsp90 стимулировать миграцию опухолевых клеток, описанную в литературе [4, 5]. Очищенные Hsp90 из мозга мыши и быка в концентрациях до 1,0 мг/мл не обладали прямой цитотоксичностью и не влияли на пролиферацию клеток А-172, НТ1080, ВНК-21 и NIH3T3. С использованием метода определения скорости зарастания поврежденного участка монослоя клеток показано, что скорость миграции клеток А-172 в присутствии Hsp90 из мозга быка и мыши, была достоверно выше на 30±4 % и 35±5 %, по сравнению с контрольными лунками без HSP и лунками с контрольными белками – Hsp70 и БСА (0,1 мг/мл) (рис. 2). На немигрирующей культуре ВНК-21 был показан крайне низкий уровень миграции клеток.
С использованием метода оценки скорости миграции клеток через РЕТ мембрану показано, что Hsp90 из мозга быка и мозга мыши стимулировал миграцию клеток А-172 через мембрану на 21±2 % и 25±2 %, в сравнении с контролем без Hsp90. В случае клеточной культуры НТ1080, в присутствии Hsp90 из мозга быка и мозга мыши количество мигрировавших клеток было на 30±2 % и 27,6±2 % больше, по сравнению с контролем без HSP. При отсутствии в нижнем резервуаре со средой хемоаттрактанта (ЭБС), опухолевые клетки практически не мигрировали (спонтанная миграция). На клетках немигрирующей культуры NIH3T3 миграция через мембрану была близка к значению спонтанной миграции клеток. Контрольные белки – БСА и Hsp70 из мозга быка в концентрации 0,1 мг/мл не влияли на миграцию опухолевых клеток (рис. 3).
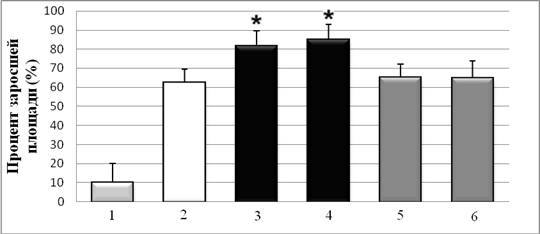
Рис. 2. Влияние Hsp90 на миграцию клеток А-172 (метод «экспериментальной раны» на клеточном монослое). 1 – спонтанная миграция; 2 – контроль без Hsp90; 3 – Hsp90 (бык); 4 – Hsp90 (мышь); 5 – БСА; 6 – Hsp70. * – P < 0,05
А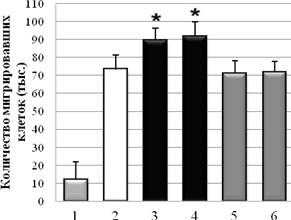 Б
Б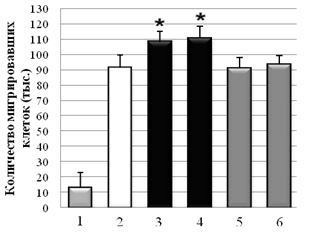
Рис. 3. Влияние Hsp90 на миграцию опухолевых клеток A-172 (А) и HT1080 (Б) через РЕТ мембрану (1 – спонтанная миграция; 2 – контроль без Hsp90; 3 – Hsp90 (бык); 4 – Hsp90 (мышь); 5 – БСА; 6 – Hsp70. * –P < 0,05
Полученные результаты свидетельствовали, что нативный Hsp90 из мозга мыши и быка, очищенный с помощью разработанного нами метода, достоверно стимулировал миграцию опухолевых клеток глиобластомы человека А-172 и фибросаркомы человека НТ1080, что свидетельствовало о его функциональной активности.
Таким образом, разработан новый метод очистки Hsp90 с помощью тиофильной хроматографии, который позволяет получать нативный функционально активный Hsp90 из тканей различных видов животных с чистотой 97–99 %. Высокая чистота Hsp90 (до 80 %) достигалась уже на стадии хроматографии на Т-геле, что позволяет рассматривать этот носитель в качестве высокоспецифичного сорбента для очистки Hsp90.
Рецензенты:
Новоселов В. И., доктор биологических наук, профессор, главный научный сотрудник «Лаборатории механизмов рецепции», Федерального государственного бюджетного учреждения науки Института биофизики клетки РАН, г. Пущино.
Акатов В. С., доктор физико-математических наук, профессор, заведующий «Лаборатории тканевой инженерии», Федерального государственного бюджетного учреждения науки Института теоретической и экспериментальной биофизики РАН, г. Пущино.



