По разным зарубежным данным, частота встречаемости гипоксически-ишемической энцефалопатии составляет от 1 до 8 случаев на 1000 новорожденных [8; 9]. Повреждение мозга в настоящее время является самой распространенной патологией у детей и лежит в основе многих тяжелых заболеваний, таких как резистентная эпилепсия, поведенческие расстройства, олигофрения, детский церебральный паралич, задержка психомоторного развития и др. [1; 2]. Клиническая картина новорожденных, родившихся в асфиксии, очень полиморфна и зависит от продолжительности острой интранатальной асфиксии, наличия или отсутствия хронической внутриутробной гипоксии, сроком гестации при рождении. Как правило, асфиксия средней и тяжелой степени предполагает полиорганные поражения (сердечно-сосудистые, легочные, почечные, желудочно-кишечные, гематологические). Исход асфиксии для ребенка существенно зависит от своевременной диагностики и тактики ведения в постаноксическом периоде [7]. На сегодняшний день для диагностики церебральной гипоксии применяются многочисленные исследования, такие как изучение акушерского и гинекологического анамнеза у матери, течение беременности и родов, неврологическое обследование новорожденного, оценка метаболических показателей, оценка по шкале Апгар. Также используются дополнительные методы исследования: нейросонография, допплерография, нейровизуализация; нейрофизиологические – электроэнцефалография, полиграфия, вызванные потенциалы, различные виды электромиографии; диагностические пункции – люмбальная, субокципитальная и т.д. [5]. В последние годы особое внимание уделяется поиску новых биохимических маркеров для лабораторной диагностики ишемии головного мозга. Учитывая механизм развития ишемии с развитием глутаматно-кальциевого каскада и изменением структуры NMDA-рецепторов, перспективным считается метод определения аутоантител к NR- субъединице NMDA-рецептора, как маркеру церебральной ишемии у новорожденных. По литературным данным, исследования, проводимые на взрослых пациентах с цереброваскулярной патологией, показали высокую диагностическую значимость метода определения аутоантител к NMDA- рецепторам как маркерам ишемии мозга [6]. Интересно выявление антител к белку S100 у новорожденных, перенесших острую интранатальную гипоксию, в том числе одномоментно, с определением уровня антител к NMDA-рецепторам. В острейшую фазу повреждения мозга (часы, дни) изменяется структура нейрональных мембран, выпадает белок S100. Определение уровня антител к нему может служить достоверным диагностическим тестом мозговой катастрофы. Белок S100 не специфичен для ишемии, антитела к нему могут определяться при повреждении мозга при травмах, эпилепсии и т.д. [4]. В одной из работ выявилась достоверная корреляционная связь между тяжестью поражения мозга и высоким титром белка S100 в сыворотке крови у новорожденных с перинатальным гипоксическим поражением ЦНС [3].
Целью исследования является: уточнение клинических критериев тяжести острой фазы постгипоксической энцефалопатии, в том числе с определением уровня антител к нейроспецифическим антигенам: антител к NMDA-рецепторам и белку S100 у доношенных новорожденных, родившихся в асфиксии.
Материал и методы
Набор материала для исследования производился на базе роддома Республиканского кардиологического центра города Сыктывкара, в отделении реанимации новорожденных и палате интенсивной терапии при отделении патологии новорожденных; на базе Детской Республиканской больницы города Сыктывкара; на базе Детской городской больницы № 1 города Санкт-Петербурга, Родильного дома № 10, города Санкт-Петербурга, в период с 2008–2009 год. Антитела к NMDA рецепторам и белку S100 определялись методом ИФА в лаборатории при академической группе академика РАМН А. А. Скоромца, г. Санкт-Петербург.
Характеристика новорожденных контрольной группы
Контрольную группу составили 25 здоровых доношенных новорожденных. Гестационный возраст составил 38–40 недель. По шкале Апгар, при рождении, дети имели 8–9 баллов, вес более 3 кг. Нахождение в стационаре было обусловлено наличием патологии, не связанной с поражением головного мозга или наличием гипоксических состояний, например, пупочные грыжи, кисты яичников, затянувшаяся физиологическая желтуха и т. д. Акушерско-гинекологический и соматический анамнез матерей не отягощен патологией. Количество самостоятельных родов, прошедших без осложнений, составило 80 %. Плановые операции кесарева сечения составили 20 %. По половому составу контрольная группа была представлена 13 девочками и 12 мальчиками. Состояние с рождения и в раннем неонатальном периоде соответствовало возрастным нормам.
Характеристика новорожденных основной группы
В основную группу были включены 47 новорожденных в возрасте от 0 до 1 месяца, родившиеся в состоянии асфиксии. Новорожденные находились в условиях стационара с диагнозом «Церебральная гипоксия» различной степени тяжести. Гестационный возраст детей варьировал от 37 до 40 недель. Критериями исключения из исследования были: грубые пороки развития, недоношенность, билирубиновые энцефалопатии, наследственные заболевания, метаболические и токсические поражения головного мозга.
Новорожденным проводился соматический и неврологический осмотры, по историям болезни фиксировались паспортные данные и, в формализованном виде, ключевые моменты анамнеза, истории беременности и родов – всего по 57 показателям по каждому пациенту. В дальнейшем производился забор венозной крови в количестве 1 мл, центрифугирование, замораживание сыворотки и лабораторная обработка всего массива. Для каждого ребенка определялись показатели титра аутоантител к NMDA-рецепторам и белку S100. Далее детально изучались взаимосвязи между показателями.
Результаты исследования
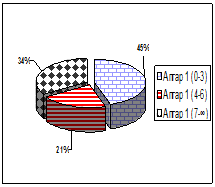
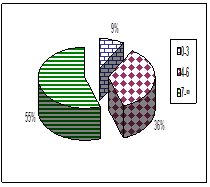
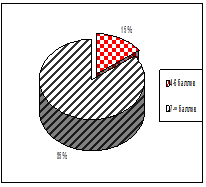
При рождении, младенцев оценивали по шкале Апгар на первой, пятой и седьмой минутах. На 1 минуте количество баллов от 0–3 составили 45 % обследуемых; 4–6 баллов – 21 %; 7 и выше – 34 % новорожденных. На пятой минуте по шкале Апгар количество баллов от 0–3 баллов, составили 9 %; от 4–6 баллов получили 36 %; и наибольшее количество детей – 55 % составляют сектор от 7 и выше. На 7 минуте 40 детей (85 %) получили 7 баллов и выше; 7 пациентов (15 %) от 4 до 6 баллов (рис. 1).
|
Оценка по шкале Апгар на 1 минуте |
Оценка по шкале Апгар на 5 минуте |
Оценка по шкале Апгар на 7 минуте |
Рис. 1. Оценка по шкале Апгар
По степени тяжести асфиксии данные распределились следующим образом: 45 % обследуемых составили тяжелую степень; 21 % – среднюю степень; 34 % новорожденных составили легкую степень асфиксии. Дыхательная недостаточность (ДН) отмечалась у 33 новорождённых (69 %). ДН 1 степени выявлена в 5 наблюдениях, что составило 10 %. ДН 2 степени определялась у 5 пациентов (10 %), ДН 3 степени была у 23 новорождённых (49 %). Таким образом, дыхательная недостаточность была выявлена у большей части новорожденных, и её основное количество представлено ДН 3 степени (рис. 2).
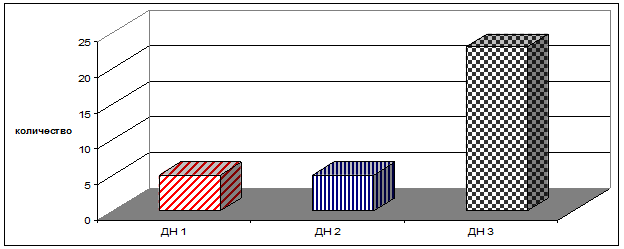
Рис. 2. Распределение по степеням дыхательной недостаточности
31 человек (66 %) были переведены на искусственную вентиляцию легких. Длительность нахождения на ИВЛ составила от 1 до 48 дней в среднем 8,97 ± 9,03 дня.
В 23 наблюдениях была выявлена аспирация околоплодных вод (49 %), у 6 пациентов определено наличие отёка лёгких (13 %).
Среди новорождённых 33 ребенка страдали недостаточностью кровообращения (70 %), в 14 наблюдениях констатирована НК1 степени (30 %), у 17 больных – 2 степени (36 %), 2 пациента страдали недостаточностью кровообращения 3 степени (4 %). 4 степень НК в наблюдениях отмечен не был. Таким образом, основу группы составили пациенты с 1–2 степенью НК.
Неврологические изменения в раннем неонатальном периоде представлены следующим образом: спонтанный генерализованный тремор отмечен у 4 младенцев (9 %), захождение швов черепа отмечено у одного пациента (2 %), расхождение швов выявлено у четырёх младенцев (9 %), что являлось 9 % наблюдений, повышение мышечного тонуса определялось у двух пациентов (4 %), мышечная гипотония отмечена у 44 пациентов (94 %), в том числе тяжелая гипотония (поза лягушки) (43 %). Угнетение рефлексов новорождённых отмечено в 38 наблюдениях (81 %), снижение сухожильных и периостальных рефлексов выявлено у 41 пациента (87 %) от общего числа младенцев, судороги отмечены у трёх новорождённых (6 %),у трех новорожденных отмечено состояние комы (6 %), менингеальные симптомы не выявлялись.
В позднем неонатальном периоде (с 8 по 28 день жизни), динамика неврологических нарушений представлена следующим образом: один ребенок продолжал находиться в состоянии комы (2 %), мышечная гипотония представлена у 31 (67 %) новорожденного, в том числе тяжелая (поза лягушки) (10 %), снижение сухожильных и периостальных рефлексов в динамике представлено у 27 (59 %) детей, угнетение рефлексов новорожденных определялось у 25 (55 %) детей.
По данным нейросонографии в раннем неонатальном периоде (первая неделя жизни): внутричерепные кровоизлияния (субэпендимальные) у 10 человек (23 %), признаки отека вещества головного мозга у 25 человек (55 %), признаки церебральной ишемии у 32 ребенка (70 %). В позднем неонатальном периоде (с 8 по 28 день жизни): вентрикулодилатация боковых желудочков в 100 % случаев, изменение эхоплотности таламусов – у 14 детей (30 %), субэпендимальные кисты, эпендиматит – у 3 человек (6 %), перивентрикулярные субкортикальные кисты – у 19 человек (40%), мультикистозная энцефаломаляция у одного ребенка (2 %).
рH крови новорождённых при рождении был в пределах от 6,76 до 7,40, в среднем составив 7,111±0,14. В позднем неонатальном периоде значения рН колебались от 7,3 до 7,5, в среднем 7,37±0,59.
Всем новорожденным был произведен однократный забор венозной крови для определения антител к NMDA-рецепторам и белку S100. Кровь для исследования бралась одновременно с взятием крови для ежедневных биохимических анализов, без дополнительных инвазивных вмешательств.
Обсуждение результатов
В результате лабораторных исследований получены результаты NMDA-теста в пределах от 0,04 до 0,39 оптических единиц (OD), составив в среднем по группе наблюдения (0,083±0,079). Совокупность результатов по диапазону NMDA-теста была разбита на 4 группы: от 0 до 0,05 (у 21 новорожденного – 45 %); от 0,05 до 0,1 (у 13 новорожденных – 28 %); от 0,1 до 0,2 (у 10 новорожденных – 21 %); от 0,2 и выше (у 3 новорожденных – 6 %). Наибольшее количество новорождённых было с концентрацией антител к NMDA-рецепторам в диапазоне от 0 до 0,05.
Антитела к белку S100 получены в диапазоне от 0,003 до 0,435 OD, составив в среднем по группе наблюдения (0,119±0,089). Совокупность результатов теста по белку S100 была разбита на 4 группы: от 0 до 0,05 (у 9 новорожденных – 19 %); от 0,05 до 0,1 (у 17 новорожденных – 36 %); от 0,1 до 0,2 (у 14 новорожденных – 30 %); от 0,2 и выше (у 7 новорожденных – 15 %). Наибольшее количество детей было с концентрацией белка S100 в диапазоне от 0,05 до 0,1.
Новорожденным контрольной группы также производился забор крови для определения уровня антител к NMDA-рецепторам и белку S100. Полученные результаты: уровень антител NMDA рецепторам оказался в диапазоне от 0–0,02 OD, уровень антител к белку S 100 составил от 0–0,003 OD. Для дальнейшей интерпретации результатов были сопоставлены нормальные значения контрольной группы с показателями, полученными в основной группе. Практически все полученные значения уровня антител к белку S 100 выше нормы. Это свидетельствует о том, что белок S 100 является маркером повреждения мозга. В то время как значения титра антител к NMDA-рецепторам ближе к пределам нормальных значений, что говорит об отсроченном образовании антител к NMDA-рецепторам при ишемии.
Методами статистического анализа определены достоверные корреляции между уровнем антител к NMDA-рецепторам и белку S100 в сыворотке крови и клиническими и инструментальными данными матерей и новорождённых. Для NMDA-теста получены 10 взаимных корреляций с показателями: обвитие пуповины, вес ребенка, асфиксия тяжелой степени, дыхательная недостаточность 1 степени, отек легких, патологическая поза, значения билирубина, АСТ. Все достоверные корреляции произошли в диапазонах значений больше нормы (0,05–0,2и выше), при р<0,05 и 0,25≤R≤0,75 (умеренная сила корреляции). Для теста к белку S100 получено 16 достоверных корреляций с показателями, характеризующими тяжесть состояния ребенка: низкая оценка на 1 и 5 минутах по шкале Апгар, обвитие пуповины, меконий в околоплодных водах, кома, цианоз кожи новорожденного, вес ребенка, дыхательная недостаточность 2 степени, недостаточность кровообращения 1 степени, изменения мышечного тонуса, судороги, значение рН крови, значение АСТ. Корреляционные связи выявились во всем числовом диапазоне при р<0,05 и 0,25≤R≤0,75 (умеренная сила корреляции).
Показатели, прокоррелировавшие с белком S100, являются тяжелыми проявлениями полиорганной недостаточности острой фазы постгипоксической энцефалопатии. Большее количество коррелятов выявлено с наибольшими числовыми значениями антител к белку S 100. Это доказывает, что белок S 100, являясь структурным белком нейрональных мембран, уже в первые часы воздействия гипоксии, начинает разрушаться, проникать сквозь гематоэнцефалический барьер в кровоток с последующей активацией иммунной системы и формированием антител к нему.
Для NMDA-теста практически на всем протяжении числовых диапазонов больше корреляций с показателями, характеризующими дыхательные нарушения и приводящими к ним состояниями (отек легких, обвитие пуповины, дыхательную недостаточность 1 степени, асфиксия тяжелой степени). А поскольку дыхательная недостаточность является одной из основных причин церебральной ишемии, выявление ее в качестве достоверного предиктора можно считать закономерным.
Заключение
Для уменьшения риска рождения детей в асфиксии целесообразно выявлять беременных женщин с высоким риском развития внутриутробной гипоксии, своевременно ее диагностировать, проводить лечебные мероприятия по коррекции выявленных нарушений. Всем новорожденным, родившимся в состоянии асфиксии, необходима адекватная оценка тяжести состояния, комплексный подход к диагностике перинатального поражения ЦНС, включающий: клиническую оценку, нейровизуализационную (мониторинг нейросонографии, по показаниям проведение КТ или МРТ) для оптимального подбора тактики ведения. Для оценки тяжести постгипоксической энцефалопатии возможно исследование определения уровня антител к белку S100 и NMDA-рецепторам как маркерам раннего повреждения мозга. При выявлении высокого титра антител к белку S100 и NMDA-рецепторам у новорожденных, родившихся в асфиксии, вероятны более тяжелые проявления постгипоксической энцефалопатии. Неврологическое сопровождение и терапия в этих случаях должны проводиться более активно.
Рецензенты:
Иова Александр Сергеевич, доктор медицинских наук, профессор, заведующий кафедрой детской невропатологии и нейрохирургии, заведующий научно-исследовательской лабораторией инновационных технологий медицинской навигации ГБОУ ВПО «Северо-Западный государственный медицинский университет имени И. И. Мечникова» Министерства Здравоохранения Российской Федерации, г. Санкт-Петербург.
Слюсарь Татьяна Александровна, доктор медицинских наук, профессор, заведующая кафедрой нервных болезней и восстановительной медицины с курсом психического здоровья факультета последипломного образования ГБОУ ВПО Тверской государственной медицинской академии МЗ России, г. Тверь.