Введение
В условиях выраженной эндогенной интоксикации особая роль принадлежит патологии сердечно-сосудистой системы, так как именно гемодинамические сдвиги зачастую и определяют дальнейший ход событий [12]. Миокард становится мишенью вторичного повреждения, вызванного эндогенными токсическими соединениями, с комплексом морфофункциональных изменений, описываемым собирательным понятием дисметаболическая (токсическая) кардиомиопатия [7; 9]. Взаимосвязь перекисного окисления липидов и нарушений гемостаза с активацией коагуляционных механизмов при эндотоксикозе в настоящее время не вызывает сомнений [1]. Перспективным представляется применение при эндотоксикозе препаратов, нормализующих липидный метаболизм клеток и улучшающих реологические свойства крови, тем самым уменьшающих явления токсического поражения органов, в том числе миокарда, как одного из наиболее чувствительных к гипоксии органов-мишеней при эндотоксикозе.
Целью работы явилось изучение влияния препарата с антиоксидантными свойствами этоксидола на функционально-метаболическое состояние миокарда, эритроцитов и тромбоцитов при эндотоксикозе.
Материалы и методы исследования. Основой работы явились экспериментальные исследования на взрослых беспородных собаках, которым моделировали острый перитонит [4]. Под общим обезболиванием (тиопентал-натрий в дозе 0,04 мг/кг) животным в брюшную полость шприцем вводили 20%-ную каловую взвесь из расчета 0,5 мл/кг массы тела животного. Через сутки после этой манипуляции выполняли срединную лапаротомию, оценивали возникшие патологические изменения в брюшной полости и санировали ее. В контрольные сроки (1-е, 3-и, 5-е сутки) животным производили релапаротомию, забор крови из бедренной вены, биопсию ткани миокарда. В послеоперационном периоде животным I (контрольной) группы проводили антибактериальную (внутримышечные инъекции 2 раза в сутки раствора гентамицина из расчета 0,8 мг/кг массы тела) и инфузионную (внутривенные введения 5%-ного раствора глюкозы и 0,89%-ного раствора хлорида натрия из расчета 50 мл/кг массы животного) терапию. Во II (опытной) группе животным в комплексную терапию включали внутривенные введения 5%-ного раствора антоксиданта этоксидола (10 мг/кг массы). В динамике заболевания исследовали качественный и количественный состав липидов кардиомиоцитов, эритроцитов и тромбоцитов, функционально-метаболическое состояние миокарда, форменных элементов крови. Выполняли ЭКГ, использовали хроматографические методы анализа липидов. Полученные цифровые данные обрабатывали методом вариационной статистики с использованием критерия Стъюдента.
Результаты и обсуждение. Как известно, одним из главных проявлений эндотоксикоза является ухудшение деятельности сердца, нередко обуславливающее летальный исход [6; 7]. Наши исследования показали существенные нарушения электрофизиологических параметров сердечной деятельности, свидетельствующие об ухудшении автоматизма, возбудимости, проводимости миокарда. Также отмечено значительное усиление эктопической активности миокарда: практически у всех животных возникли частые желудочковые и наджелудочковые экстрасистолы, в половине случаев на ЭКГ регистрировались пароксизмы наджелудочковой тахикардии, отмечались преходящие блокады проведения импульса. У 60% животных зарегистрированы ишемические изменения на ЭКГ в виде депрессии сегмента ST>1мВ. Нарушения ритма и проводимости, проявления субэндокардиальной ишемии у животных сохранялись на фоне применения антибактериальной и дезинтоксикационной терапии в течение всего периода наблюдения. Данное обстоятельство свидетельствует о прогрессировании токсического поражения миокарда при остром разлитом перитоните, несмотря на использование антибактериальной и дезинтоксикационной терапии.
Ухудшение электрофизиологических параметров миокарда сопровождалось активизацией процессов перекисного окисления липидов, повышением ферментативной активности фосфолипазы А2, угнетением собственной антиоксидантной защиты, коррелирующих с нарушениями липидного спектра мембран кардиомиоцитов: уровень лизофосфолипидов возрастал на 398,24%, свободных жирных кислот – на 171,60%, уменьшалось содержание суммарных фосфолипидов на 89,72%, фосфатидилхолина – на 17,54% (р<0,05). Таким образом, выявленные существенные модификации липидного метаболизма в тканевых структурах миокарда при эндотоксикозе, сопряженные с нарушением основных электрофизиологических функций кардиомиоцитов, безусловно, являются одними из важнейших патогенетических факторов формирования токсической кардиомиопатии.
Большой интерес представляет изучение функционально-метаболического состояния форменных элементов крови при токсических состояниях, так как они достаточно объективно отражают общий статус организма и выступают в качестве механизма прогрессирования эндотоксикоза [2]. Нами выявлены существенные модификации функционального статуса эритроцитов и тромбоцитов, что было зафиксировано в виде уменьшения деформабельности на 62,51%, увеличения жесткости и неспецифической проницаемости мембран эритроцитов на 41,45 и 44,81% (р<0,05) соответственно. Отмечен значительный рост агрегационной активности тромбоцитов: степень агрегации тромбоцитов превосходила норму на 104,14%, скорость агрегации – на 374,32%, время агрегации тромбоцитов уменьшилось по сравнению с нормой на 45,63% (р<0,05) (рис. 1).
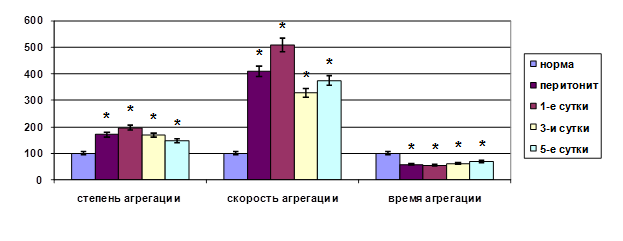
Рис. 1. Динамика функциональной активности тромбоцитов при эндотоксикозе (* – достоверность отличия по отношению к норме при p<0,05).
Отмечен значительный рост интенсивности перекисного окисления липидов и активности фосфолипазы А2 в форменных элементах крови при эндотоксикозе. Эти процессы также коррелировали с модификацией липидного спектра форменных элементов крови. Так, в липидном спектре эритроцитов отмечался рост триацилглицеридов, свободных жирных кислот и эфиров холестерола, снижение уровня холестерола и суммарных фосфолипидов, в спектре которых возрастало содержание лизофосфолипидов на 182,83% (р<0,05), обладающих детергентными свойствами.
Липидный спектр биомембран тромбоцитов также подвергался изменениям: снижалось содержание суммарных фосфолипидов и эфиров холестерола на 28,04 и 45,07% соответственно (р<0,05), фосфатидилсерина – на 44,61%, фосфатидилинозита – на 41,44%, вдвое возрастал уровень свободных жирных кислот и холестерола, уровень лизофосфолипидов возрос в пять раз.
Таким образом, проведенные исследования подтвердили наличие выраженных нарушений липидного спектра мембран форменных элементов крови, которая первой реагирует на компоненты эндотоксикоза [1]. Нарушения липидного спектра биомембран эритроцитов и тромбоцитов обуславливают ухудшение функциональной активности этих клеток. Снижение деформабельности, увеличение жесткости и неспецифической проницаемости эритроцитов, усиление агрегационной способности тромбоцитов уменьшают способность клеток к продвижению в капиллярах, увеличивают вероятность сладж-феномена, определяя нарушения микроциркуляции и обеспечения органов и тканей кислородом [8; 12]. Данный факт определяет важную роль функционально-метаболических расстройств форменных элементов крови в усугублении токсического поражения миокарда как органа, чрезвычайно чувствительного к нарушениям кислородообеспечения [3; 5].
В связи с этим необходимость своевременной коррекции возникших нарушений липидного обмена и расстройств гемостаза с целью предупреждения развития полиорганной недостаточности, одним из грозных проявлений которой является токсическая кардиомиопатия, не вызывает сомнений. Для решения этой задачи во второй экспериментальной группе животным включали антиоксидант этоксидол. Показатели электрофизиологической активности миокарда на фоне применения этоксидола свидетельствуют об улучшении основных электрофизиологических параметров миокарда: улучшались показатели автоматизма, возбудимости и проводимости (рис. 2).
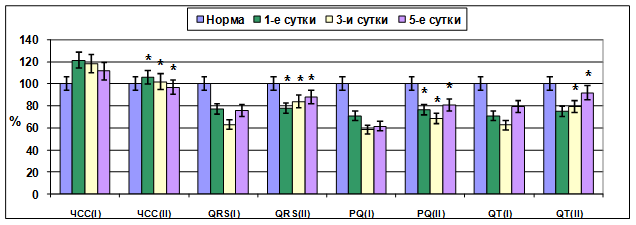
Рис. 2. Влияние этоксидола на продолжительность интервалов ЭКГ при эндотоксикозе (исходный уровень показателей принят за 100%; I-контрольная группа, II-опытная группа; * – достоверность изменений в опытной группе по отношению к контрольной при р<0,05).
Отмечено уменьшение эктопической активности миокарда под влиянием этоксидола. Так, к окончанию эксперимента лишь у 25% животных регистрировались желудочковые экстрасистолы. Это свидетельствует о том, что включение этоксидола в схему лечения эндотоксикоза способствует нормализации функционального статуса кардиомиоцитов, следовательно, уменьшению проявлений токсической кардиомиопатии.
Включение в схему лечения перитонита эндотоксикоза способствовало коррекции липидного спектра кардиомиоцитов, что предупреждает прогрессирование мембранодеструктивных явлений в тканевых структурах сердечной мышцы, а, следовательно, снижает вероятность развития токсической кардиомиопатии [5; 6]. Положительный липидрегулирующий эффект этоксидола был зафиксирован уже с первых суток терапии.
В ходе исследований отмечено также уменьшение ишемических проявлений на ЭКГ: к пятым суткам экспериментального исследования количество эпизодов депрессии сегмента ST регистрировалось менее чем у 20% животных, что свидетельствует об улучшении субэндокардиального (микроциркуляторного) кровотока. Это, вероятно, обусловлено тем, что применение этоксидола способствовало нормализации липидных нарушений мембран форменных элементов крови, что привело к улучшению их функционального статуса. Так, сорбционная способность и жесткость биомембран эритроцитов снижались относительно контрольных данных, возрастал индекс деформабельности эритроцитов. Изучение параметров кинетики АДФ-индуцированной агрегации тромбоцитов на фоне применения этоксидола показало, что ее степень и скорость уменьшались относительно контроля (рис. 3).
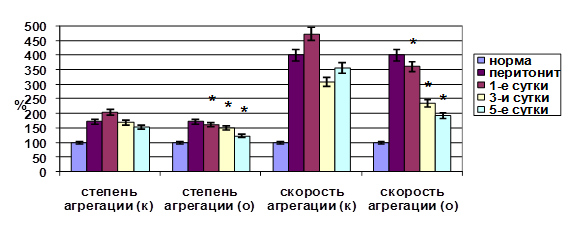
Рис. 3. Динамика функциональной активности тромбоцитов при эндотоксикозе на фоне применения этоксидола (* – достоверность отличия показателей по отношению к контролю при p<0,05; к – данные контрольной группы исследований; о – данные опытной группы исследований).
Таким образом, применение этоксидола способствует купированию эритроцитарной и тромбоцитаной дисфункции. Важнейшим механизмом реализации данного положительного эффекта явилась способность этоксидола корригировать липидный спектр биомембран эритроцитов и тромбоцитов за счет снижения интенсивности основных липидмодулирующих факторов. Активность фосфолипазы А2 эритроцитов и тромбоцитов снижалась, а активность супероксиддисмутазы возрастала относительно контроля.
Исследование липидного состава биомембран эритроцитов на фоне применения этоксидола показало, что уровень свободных жирных кислот и эфиров холетерола снизились на 20,61 и 22,67% соответственно (р<0,05), лизофосфолипидов – на 39,11%, фосфатидилсерина – на 18,40% (р<0,05). Содержание суммарных фосфолипидов возросло на 12,24%, фосфатидилинозита – на 19,07%, свободного холестерола – 18,29% соответственно по сравнению с контрольными данными (р<0,05). Исследование интенсивности липидмодулирующих факторов и липидного состава биомембран тромбоцитов на фоне применения этоксидола показало аналогичные результаты.
Таким образом, применение этоксидола при эндогенной интоксикации способствует быстрому восстановлению липидного спектра биомембран не только кардиомиоцитов, но и форменных элементов крови. Коррекция функционально-метаболического статуса эритроцитов и тромбоцитов, безусловно, является благоприятным фактором улучшения микроциркуляции и трофики миокарда, что выявляет еще один патофизиологический путь реализации кардиопротекторного действия этоксидола и делает перспективным его применение для лечения токсических кардиомиопатий.
Рецензенты:
Торшин Владимир Иванович, д.б.н., профессор, заведующий кафедрой нормальной физиологии ФГБОУ ВПО «Российский университет дружбы народов», г. Москва.
Демуров Евгений Аркадьевич, д.м.н., профессор кафедры общей патологии и патологической физиологии ФГБОУ ВПО «Российский университет дружбы народов», г. Москва.



