Введение
Обработка минеральными кислотами – наиболее перспективный способ очистки железных руд от кальция, магния и некоторых других примесей с целью получения сверхчистого железорудного концентрата [2, 4]. Но серная и фосфорная кислоты образуют с кальцием нерастворимые соединения сульфат и ортофосфат кальция, а соляная кислота, как было установлено нами, взаимодействует с рудными минералами, что приводит к потерям железа. Поэтому исследования по очистке железной руды от примесей кальция и магния проводились с использованием азотной кислоты, а также её соли – нитрата трёхвалентного железа.
Методика экспериментов и анализов
В опытах использовался чистый магнетитовый концентрат Оленегорской руды, содержащий 71,5 % железа. Массовая доля примесей в концентрате составляет (%): SiO2 – 0,44; Al2O3 – 0,20; CaO – 0,30; MgO – 0,10; MnO – 0,12; нерастворимый остаток – 0,35. Степень измельчения этого концентрата составляет 92 % класса минус 0,05 мм. Растворы азотной кислоты готовились из 60 %-й HNO3 квалификации «ч» по ГОСТ 4461–77.
Обработка концентрата растворами кислоты проводилась в герметичном стеклянном реакторе, снабжённом термометром, пропеллерной мешалкой, обороты которой можно регулировать, и пробоотборником. Реактор был размещён в термостате, с помощью которого температура в нём поддерживалась постоянной с точностью ±0,2 °.
Каждый опыт проводился при постоянной температуре. Для этого порция концентрата загружалась в реактор в сухом виде и нагревалась вместе с реактором в термостате до определённой температуры. В это время раствор кислоты нагревался в отдельной колбе и вливался в реактор после достижения такой же температуры. В момент вливания раствора включалось перемешивание, и начинался отсчёт времени опыта.
Пробы раствора из реактора отбирались для проведения анализов вначале через 10, 20 и 30 мин, следующие – через 60 мин, потом через 2 и 3 часа от начала опыта. Определение кальция и магния проводили методом объёмного титрования, выбранным из большого числа известных методик [3, 5] применительно к специфике объекта исследования. Кальций определяли титрованием раствором этилендиаминтетрауксусной кислоты (ЭДТА) при рН 12–13
в присутствии мурексида (пурпурата аммония) в качестве индикатора. Для определения магния применялось титрование тем же раствором ЭДТА, но в нейтральной среде с индикатором эрихромом. Степень очистки вычисляли по отношению массы кальция (магния), перешедшего в раствор, к его массе в исходной порции и выражали в процентах.
Очистка азотной кислотой
В гетерогенных химических процессах между твёрдыми продуктами и растворами, к которым относится изучаемая проблема, их показатели зависят от многих параметров: концентрации раствора, температуры, степени измельчения твёрдого вещества, соотношения реагирующих веществ, интенсивности перемешивания. Эти параметры были в данной работе исследованы проведением соответствующих серий опытов.
В первой серии изучалось влияние соотношения между раствором и концентратом
(соотношение Ж:Т по массе). При этом использовали 10 %-ю азотную кислоту, температуру поддерживали равной 60 °С, интенсивность перемешивания – 200 об/мин. Полученные результаты приведены в табл. 1. Для их наглядного представления о кинетике процесса построены графики (рис. 1), которые показывают развитие процесса во времени.
Таблица 1
Результаты опытов по очистке Оленегорского концентрата от кальция 10 %-й азотной кислотой при различном соотношении Ж:Т
Постоянные условия: температура 60 °С, интенсивность перемешивания 200 об/мин
|
Время, мин |
Степень извлечения СаО (%) при соотношении Ж:Т: |
|||||
|
3:1 |
5:1 |
7:1 |
10:1 |
15:1 |
20:1 |
|
|
10 |
3,83 |
5,76 |
8,76 |
14,1 |
18,5 |
21,2 |
|
20 |
4,81 |
8,05 |
12,4 |
18,0 |
24,5 |
28,4 |
|
30 |
5,36 |
9,33 |
14,8 |
20,2 |
27,6 |
31,4 |
|
60 |
5,77 |
11,69 |
18,1 |
23,7 |
31,9 |
36,5 |
|
120 |
5,83 |
13.45 |
19,5 |
25,8 |
32,6 |
39,3 |
|
180 |
5,86 |
13,86 |
19,6 |
26,0 |
32,9 |
40,2 |
Полученные результаты однозначно свидетельствуют о том, что при увеличении соотношения Ж:Т степень очистки концентрата от кальция увеличивается, поэтому в дальнейших экспериментах этот показатель поддерживался на максимальном уровне (20:1).
Во второй серии изучалось влияние интенсивности перемешивания: была проведена обработка концентрата 10 %-й азотной кислотой при Ж:Т 20:1 и температуре 60 °С в пяти опытах, в которых скорость вращения мешалки составляла 50, 100, 200, 300 и 400 об/мин. Через 3 ч от начала опытов степень извлечения кальция, согласно результатам анализа растворов в конечных пробах, составила:
|
cкорость вращения (об/мин): |
50 |
100 |
200 |
300 |
400 |
|
cтепень извлечения СаО (%): |
37,5 |
46,9 |
58,5 |
59,0 |
58,8 |
Эти результаты означают, что увеличение интенсивности перемешивания имеет значение до 200 об/мин, так как при более высокой скорости вращения степень очистки практически остаётся на одном уровне 59 %. Этот результат можно объяснить тем, что перемешивание в гетерогенных процессах влияет на скорость массопереноса (диффузии) в жидкой среде и не влияет на процессы внутренней диффузии (внутри твёрдых частиц).
Опыты в третьей серии проводились при различных концентрациях кислоты: использовались как разбавленные растворы с массовой долей HNO3 1, 2, 3 и 10 %, так и растворы средней концентрации с массовой долей 20 и 30 %. Результаты этой серии опытов приведены в табл. 2 и на рис. 2.
Таблица 2
Влияние массовой доли азотной кислоты в растворе на степень очистки концентрата от кальция
Постоянные условия: температура 60 °С, соотношение Ж:Т 20:1, интенсивность перемешивания 200 об/мин
|
Время, мин |
Степень извлечения СаО (%) при массовой доле HNO3: |
|||||
|
1 % |
2 % |
3 % |
10 % |
20 % |
30 % |
|
|
10 |
10,4 |
17,8 |
32,0 |
43,5 |
50,3 |
55,6 |
|
20 |
14,2 |
22,8 |
41,2 |
51,2 |
56,0 |
59,1 |
|
30 |
16,4 |
25,4 |
44,1 |
53,2 |
57,6 |
59,1 |
|
60 |
20,7 |
28,4 |
48,5 |
56,6 |
58,9 |
59,2 |
|
120 |
25,5 |
31.2 |
50,6 |
59,1 |
59,1 |
59,1 |
|
180 |
26,6 |
32,1 |
51,2 |
59,1 |
59,1 |
59,2 |
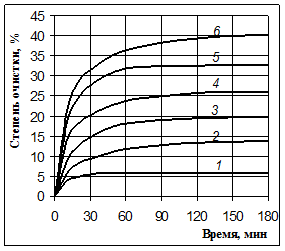
Рис. 1. Очистка Оленегорского концентрата от кальция 10 %-й азотной кислотой при 60 °С и соотношениях Ж:Т: 3:1 (1), 5:1 (2), 7:1 (3), 10:1 (4), 15:1 (5), 20:1 (6)
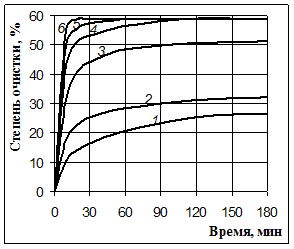
Рис. 2. Очистка Оленегорского концентрата от кальция при 60 °С и Ж:Т 20:1 азотной кислотой с массовой долей: 1% (1), 2% (2), 3 % (3), 10 % (4), 20 % (5) и 30 % (6)
Полученные результаты необычны: видно, что скорость процессов, приводящих к очистке от примесей кальция, повышается при увеличении концентрации азотной кислоты, но при достижении степени очистки около 59 % наступает предел, который при использовании 10 %-й кислоты наступает через 2 ч от начала опыта, 20 %-й – через 1 час и при 30 %-й – через 30 мин. Повышение концентрации кислоты сокращает время достижения этого предела, но степень извлечения кальция при этом не увеличивается. Возникает предположение о том, что с азотной кислотой взаимодействует только доступная для контакта с раствором часть примеси, а кальций, скрытый внутри частиц, с раствором кислоты не взаимодействует.
Косвенным подтверждением этого предположения являются результаты опытов, проведенных при различных температурах. Во всех опытах этой серии массовая доля кислоты в растворе, соотношение Ж:Т и интенсивность перемешивания были одинаковыми, а температура изменялась через каждые двадцать градусов. Результаты, представленные в табл. 3 и на рис. 3, показывают о достижении предела очистки при каждой температуре, но численное значение предельного извлечения кальция увеличивается, что может быть связано с некоторым увеличением растворимости минералов железа при увеличении температуры.
Таблица 3
Влияние температуры на очистку концентрата от кальция
Постоянные условия:концентрация HNO3 в растворе 10 %, соотношение Ж:Т 20:1, интенсивность перемешивания 200 об/мин
|
Время, мин |
Степень извлечения СаО (%) при температуре раствора: |
|||
|
20 °С |
40 °С |
60 °С |
80 °С |
|
|
10 |
21,5 |
31,7 |
42,8 |
53,4 |
|
20 |
30,7 |
42,6 |
52,8 |
60,6 |
|
30 |
34,9 |
46,5 |
55,9 |
63,3 |
|
60 |
40,3 |
50,9 |
58,4 |
65,0 |
|
120 |
41,2 |
52,6 |
58,8 |
65,6 |
|
180 |
44,0 |
52,8 |
59,0 |
66,2 |
Другим подтверждением предположения о трудности извлечения кальция являются результаты кинетической обработки опытных данных, полученных в последней серии опытов.
Известно кинетическое уравнение для самотормозящихся реакций [1]:
![]() ln
ln![]() – b·
– b·![]() = M
= M
где a – степень извлечения примеси (в данном случае кальция) ко времени t,
b и М – постоянные величины, имеющие следующие значения:
b = ![]() : M =
: M = ![]()
где k – константа скорости реакции,
D – коэффициент диффузии реагента через слой очищенного твёрдого вещества,
S – поверхность раздела фаз,
V – объём жидкого реагента,
В – количество жидкого реагента на единицу объёма твёрдого вещества,
m – коэффициент, учитывающий переход от поверхностной концентрации к объёмной.
Обработка экспериментальных данных по этому уравнению проводится в координатах
![]() ln
ln![]() ¾·
¾·![]()
и если уравнение приемлемо, то результаты опытов укладываются на прямую линию,
тангенс угла наклона которой равен коэффициенту b, а отрезок, отсекаемый на оси категорий (вертикальной оси), – коэффициенту М.
На рис. 3 и 4 результаты последней серии опытов, приведенные в таблице 3, представлены в обычных координатах и в координатах уравнения для самотормозящихся реакций. На рис. 4 опытные данные действительно образуют прямые линии, что свидетельствует о применимости выбранного уравнения для описания скорости процесса.
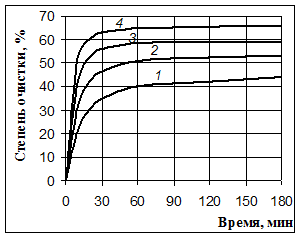
Рис. 3. Очистка Оленегорского концентрата от кальция 10 %-й азотной кислотой при 20° (1), 40° (2), 60° (3) и 80°С (4)
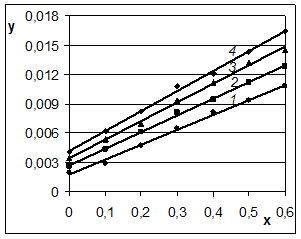
Рис. 4. Кинетика очистки Оленегорского концентрата при 20° (1), 40° (2), 60° (3) и 80°С (4) в координатах: x = ![]() , у =
, у = ![]() ln
ln![]()
По расположению линий на рис. 4 вычислены постоянные величины b и М уравнения для самотормозящихся реакций, которые имеют следующие значения:
|
Т: |
20 °C |
40 °C |
60 °C |
80 °C |
|
b: |
0,052 |
0,060 |
0,064 |
0,067 |
|
М: |
0,0096 |
0,014 |
0,020 |
0,025 |
Если принять, что поверхность раздела фаз (S) и коэффициент, учитывающий переход от поверхностной концентрации к объёмной (m), по ходу опыта мало изменяются, и они являются постоянными величинами, то по значениям b и М можно вычислить константу скорости реакции и далее по уравнению Аррениуса – энергию активации. Такие вычисления были проведены для получения дополнительной информации о кинетике процесса. Полученное значение энергии активации, равное 12 кДж/моль, свидетельствует о том, что лимитирующей стадией очистки от кальция являются диффузионные процессы, поскольку энергия активации любой химической реакции значительно больше.
Если это действительно так, то для интенсификации процесса целесообразно проводить разрушение слоя очищенного твёрдого реагента. Исходя из этого, был проведен следующий опыт. Концентрат, обработанный 10 %-й азотной кислотой в течение одного часа при 60 °С (степень очистки при этом составила 50,6 %), был после промывки и высушивания растёрт в агатовой ступке до прохождения через сито 0,034 мм и повторно обработан кислотой при тех же условиях. При повторной обработке степень очистки от кальция увеличилась до 93,9 %.
В конце каждого опыта растворы анализировали на содержание не только кальция, но и магния. Этими анализами установлено, что магний тоже переходит в раствор, и степень его извлечения приблизительно такая же, как и кальция. Для получения сверхчистого железорудного концентрата этот результат имеет положительное значение.
Содержание кальция и магния в концентратах, обработанных азотной кислотой, определялось после каждого опыта спектральным методом. В концентрате после двукратной обработки азотной кислотой (с промежуточным истиранием) содержание этих примесей составляет 0,005–0,009 %. Этот показатель является более достоверной характеристикой возможностей данного химического метода, так как он получен прямым анализом продукта.
Очистка раствором соли азотной кислоты
Проведены опыты по очистке концентрата от кальция нитратом железа (III). Водный раствор этой кислоты содержит азотную кислоту вследствие обратимой реакции гидролиза:
Fe(NO3)3 + H2O D FeOH(NO3)2 + HNO3
Можно было ожидать, что образующаяся азотная кислота будет взаимодействовать с примесями кальция и магния, но её расход будет компенсирован смещением вправо равновесия реакции гидролиза и протекания второй и третьей ступеней этого процесса:
FeOH(NO3)2 + H2O D Fe(OH)2NO3 + HNO3
FeOH(NO3)2 + H2O D Fe(OH)3 + HNO3
В опытах использовали 10 %-й раствор нитрата железа (III), степень гидролиза которого, по измерениям водородного показателя, составляет около 30 % (20 °С) и 50 % (60 °С).
Результаты выполненных экспериментов приведены в табл. 4.
Таблица 4
Результаты очистки концентрата от кальция раствором нитрата железа (III)
|
Время, мин |
Степень извлечения СаО (%) при температуре раствора: |
|||
|
20 °С |
40 °С |
50 °С |
60 °С |
|
|
30 |
5,03 |
5,76 |
6,48 |
7,25 |
|
60 |
5,92 |
6,78 |
7,56 |
8,15 |
|
120 |
7,02 |
8,06 |
8,88 |
9,65 |
|
180 |
7,72 |
8,86 |
9,75 |
10,6 |
Опыты показали слабую эффективность солевого метода: максимальная степень очистки составляет 10,6 %, что намного меньше, чем при использовании растворов кислоты.
Выводы
1. Оптимальными условиями кислотной очистки Оленегорского концентрата являются: массовая доля HNO3 в растворе 10 %, температура 40–80 °С, соотношение Ж:Т 20:1, интенсивное перемешивание пульпы. При этих условиях обработка концентрата в течение одного – трёх часов приводит к извлечению от 52,8 до 66,2 % кальция и магния.
2. При этих условиях двукратная обработка по одному часу с промежуточным измельчением концентрата обеспечивает 93,9 %-е извлечение примесей кальция и магния, остаточное содержание этих примесей в концентрате составляет 0,005–0,009 %.
3. Изученный процесс кислотной очистки описывается кинетическим уравнением для самотормозящихся реакций, энергия активации процесса составляет 12 кДж/моль.
4. Использование вместо азотной кислоты её раствора нитрата железа (III) нецелесообразно в связи с уменьшением степени очистки от кальция до 10,6 %.
Рецензенты:
Козик Владимир Васильевич, доктор химических наук, профессор, заведующий кафедрой неорганической химии Томского государственного университета, г. Томск.
Коробочкин Валерий Васильвич, доктор технических наук, профессор, заведующий кафедрой химической технологии Томского политехнического университета, г. Томск.



