Введение
Эритроциты – высокоспециализированные клетки крови, выполняющие газотранспортную функцию переноса кислорода из лёгких к органам и тканям, а диоксида углерода – в обратном направлении. Зрелые эритроциты человека лишены ядра и органелл и имеют форму двояковогнутого диска с максимально высоким отношением площади к объёму, что обеспечивает наиболее оптимальный газообмен. Общая площадь поверхности эритроцитов взрослого человека составляет 3 800 м2. Особая форма эритроцитов увеличивает их диффузионную поверхность с одновременным уменьшением диффузного расстояния. Особенности цитоскелета и строения клеточной мембраны двояковогнутых эритроцитов позволяют им претерпевать значительные деформации при прохождении через узкие изогнутые капилляры с последующим восстановлением формы.
При старении и в случае изменения формы пластичность эритроцитов уменьшается. Так, пластичность существенно снижена у сфероцитов (при гемолитической желтухе), серповидных эритроцитов (при серповидноклеточной анемии), микроцитов (при железодефицитной анемии), макроцитов (при В12-фолиеводефицитной анемии), что является одной из причин задержки и разрушения таких эритроцитов в ретикулярной ткани селезенки. Транспорт кислорода обеспечивается гемоглобином, на долю которого приходится около 98% массы белков цитоплазмы эритроцитов.
Кроме того, форма красных кровяных клеток зависит от осмотического давления в эритроцитах и в плазме крови, а также от состояния цитоскелета мембраны эритроцитов, влияющего на упругие свойства оболочек красных кровяных телец. Известно, что содержание белков в эритроцитах выше, а низкомолекулярных веществ – ниже, чем в плазме. Осмотическое давление, создаваемое высокой внутриклеточной концентрацией белков в эритроцитах, в значительной степени компенсируется малой концентрацией низкомолекулярных веществ, и поэтому осмотическое давление в эритроцитах несколько выше, чем в плазме.
Онкотическое давление крови – часть осмотического давления, создаваемого белками плазмы, которое равно 0,03–0,04 атм. Онкотическое давление в основном обусловлено альбуминами. Вследствие малых размеров и высокой гидрофильности они притягивают к себе воду, и она удерживается в сосудистом русле. При снижении онкотического давления крови происходит выход воды из сосудов в интерстициальное пространство с развитием отёка тканей. Ниже схематически представлено медицинское значение физико-химических свойств крови [4].
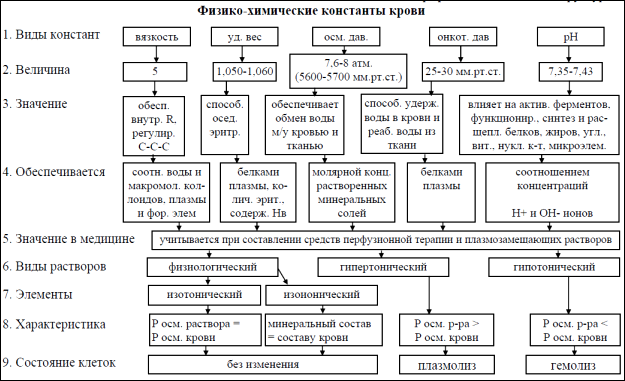
Для определения осмотического давления крови применяют криоскопический метод, регистрируя депрессию (точку замерзания), которая для крови составляет 0,56-0,58 °С. Депрессия молярного раствора (раствор, в котором растворена 1 грамм-молекула вещества в 1 л воды) соответствует 1,86 °С. Подставив значения в уравнение Клапейрона, получаем величину осмотического давления крови, равную ≈ 7,6-8,0 атм [8].
Осмотическое давление изолированных клеток, например эритроцитов, измеряют методом плазмолиза. Для этого исследуемые клетки помещают в растворы с разными концентрациями NaCl. Растворы с осмотическим давлением большим, чем осмотическое давление содержимого эритроцитов (гипертонические растворы), вызывают их сморщивание (плазмолиз) вследствие выхода воды из клетки, растворы
с осмотическим давлением более низким, чем осмотическое давление эритроцита (гипотонические растворы), вызывают разбухание клеток с последующим разрушением (гемолиз) из-за перехода воды из растворов в клетку. Раствор с осмотическим давлением, равным осмотическому давлению эритроцитов – изотонический, он не влияет на объём клетки. Зная концентрацию такого раствора, осмотическое давление в эритроците вычисляют по уравнению Вант-Гоффа: ОД=сRT, где ОД – осмотическое давление, с – концентрация раствора (в молях на 1 л раствора), Т – температура по абсолютной шкале, R – постоянная (0,08205 л·атм/град·моль) [6].
Показателем прочности эритроцитов служит их осмотическая стойкость, т.е. способность противостоять понижению осмотического давления. Мерой осмотической стойкости эритроцитов является концентрация NaCl, при которой начинается гемолиз. У человека это происходит в 0,4%-ном растворе NaCl (минимальная осмотическая резистентность), а в 0,34%-ном растворе разрушаются все эритроциты и наступает полный гемолиз крови (максимальная осмотическая резистентность) [4]. Эритроциты в крови каждого индивидуума по критерию осмотической стойкости распределены по закону Гаусса. Поэтому одним из главных параметров, характеризующих осмотические свойства эритроцитов в суспензии, является среднее значение т.н. осмотической хрупкости, численно равное концентрации NaCl, при которой происходит лизис 50% клеток [7].
Настоящая статья посвящена разработке математической модели эритроцитов с целью получения оценки упругих и морфологических свойств эритроцитов, а также сравнения численных расчетов с экспериментальными данными, полученными атомно-силовой микроскопией и методом Культера.
1. Атомно-силовая микроскопия эритроцитов и метод Культера
Атомно-силовая микроскопия (АСМ) в изучении биологических объектов приобретает всё большее значение, поскольку позволяет не только в трехмерном виде анализировать морфологию клеток, но и получать дополнительную информацию об их функциональном состоянии. Применяя различные режимы АСМ, можно измерять ригидность или упругость, вязкость, адгезию и другие свойства мембран клеток [10]. Работа АСМ-микроскопа основана на измерении сил взаимодействия кантилевера и поверхности клеток. Перемещаясь относительно поверхности и реагируя на силовое взаимодействие, АСМ регистрирует ее рельеф. На основании прибора укреплен цилиндр, в котором находится сканер из пьезоэлектрической керамики, изменяющей свои размеры при приложении электрического поля. В верхней части цилиндра крепится исследуемый образец, который сканер может перемещать в трех взаимно перпендикулярных направлениях. В горизонтальной плоскости образец сканируется по строкам: пройдя одну, он смещается на следующую строчку [2]. В зависимости от типа взаимодействия АСМ может работать в одном из нескольких режимов. Исследование биологических образцов происходит в основном в полуконтактном режиме, который отличается тем, что производит минимальное воздействие на образец и, соответственно, белковые структуры.
Кондуктометрический метод Культера основан на измерении амплитуды электрического сигнала при прохождении одиночной клеткой измерительного канала, т.е. этот метод также проводит измерение над одной клеткой, собирая информацию в памяти компьютера и определяя интегральные значения. Для определения среднего объёма эритроцитов строится гистограмма. Для этого система прибора умножает число эритроцитов в каждом измерительном канале на размер эритроцитов, проходящих данный канал, затем суммирует полученные значения для всех каналов между 36 fL и 360 fL, делит сумму на общее число эритроцитов между 36 fL и 360 fL, умножает полученное значение на калибровочную константу и выражает MCV в фемтолитрах. Кроме объёма, с помощью метода Культера можно определить и другие морфофункциональные характеристики циркулирующего пула эритроцитов: их число, уровни гемоглобина и гематокрита, среднее содержание и среднюю концентрацию гемоглобина в эритроците.
2. Результаты исследования
Для получения информации о взаимосвязи морфологии с упругими свойствами мембраны и осмотическим давлением внутри и вне эритроцитов с помощью атомно-силовой микроскопии исследован мазок крови больной бронхиальной астмой, в котором были обнаружены эритроциты с нормальной и изменённой формами. На рис. 1 представлен скан эритроцитов пациентки С., у которой была диагностирована смешанная бронхиальная астма с тяжёлым неконтролируемым течением, диффузный пневмосклероз и хроническая дыхательная недостаточность II степени. На скане видны эритроциты с нормальной формой, а также большое количество морфологически изменённых эритроцитов с отсутствием вогнутости мембраны и другими морфологическими изменениями.
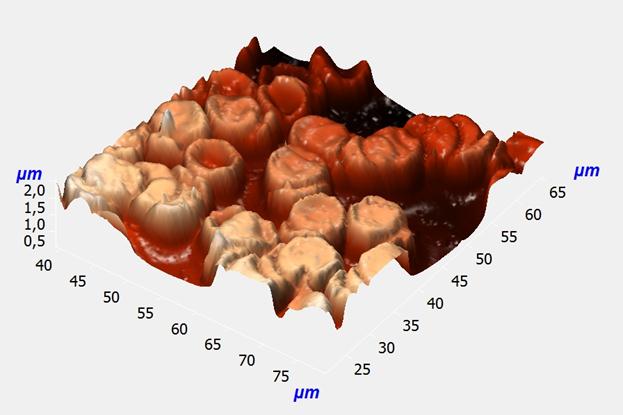
Рис. 1. Скан размером 40x40 мкм2 мазка крови больной бронхиальной астмой.
Для анализа взаимосвязи морфологии и упругих свойств эритроцитов было проведено исследование разрезов эритроцитов через их центр вдоль линий симметрии. Полученные разрезы представлены на рис. 2. Определяя геометрические характеристики разрезов эритроцитов, мы обратили внимание на то, что высота и ширина нормальных по форме двояковогнутых эритроцитов составляют 0,6-0,8 мкм и 8 мкм соответственно. У морфологически изменённых эритроцитов при отсутствии впадин эти величины составили 0,8-1,1 мкм и 8-10 мкм соответственно. Таким образом, данные эритроциты изменили свою форму и увеличились в размерах.
Эти данные согласуются с результатами исследования методом Культера морфофункциональных характеристик эритроцитов у больных бронхиальной астмой. В частности, авторами выявлено, в ответ на снижение оксигенации крови из-за персистирующего воспаления дыхательных путей и возникающей бронхиальной обструкции компенсаторно увеличивается объём эритроцитов в сочетании с увеличением уровня гематокрита. Однако отдача кислорода в ткани при этом замедляется [2].
а) 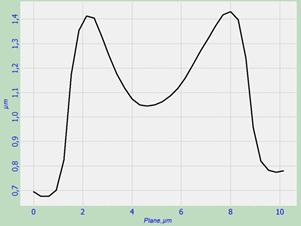 б)
б) 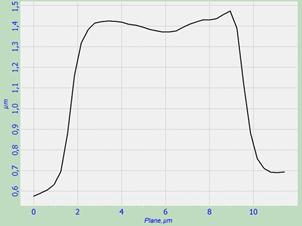
в) 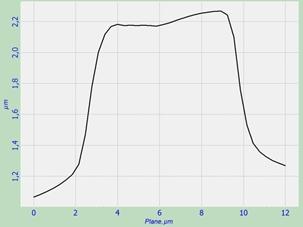
Рис. 2. Разрез эритроцитов со скана на рис. 1: а – эритроцит в норме, б и в – эритроциты с измененной морфологией.
Средний объем эритроцитов, измеренный методом Культера, составил у обсуждаемой больной С. 97 фемтолитров или 97 мкм3. Методом атомно-силовой микроскопии были рассчитаны объёмы эритроцитов, находящихся в воздушной среде. Объём эритроцита, представленного на рис. 2а, составил 34 мкм3, а на рисунках 2б и 2в – 38 и 46 мкм3 соответственно. Объем морфологически изменённых эритроцитов оказался примерно на 12-35% больше объёма двояковогнутых эритроцитов нормальной формы объёма из-за наличия у них впадины. Таким образом, при высыхании объём эритроцитов уменьшился примерно в 2-3 раза, сохранив при этом исходные соотношения основных геометрических характеристик, что позволяет, по мнению ряда авторов, с успехом использовать метод атомно-силовой микроскопии для оценки морфологии красных клеток крови [12].
В работе [9] была показана корреляция между толщиной клеток крови и содержанием в них гемоглобина, что связывалось с разрушением мембраны эритроцитов при различных состояниях и методах подготовки к измерениям. При этом во многих работах [9; 11; 12] , описывающих результаты морфологических измерений на воздухе методами АСМ, изменение объема эритроцитов связывается с процессами изменения их плотности из-за высыхания и механического влияния кантилевера на эритроцит. Причем степень влияния в контактном режиме измерения существенно выше, чем в полуконтактном. Измерения, приведенные на рис. 1 и 2, были проведены нами в полуконтактном режиме для исключения указанных механических влияний на мембрану.
Полученные с помощью атомно-силовой микроскопии клеток крови экспериментальные данные позволили нам построить простую механическую модель эритроцитов, основанную на анализе состояния упругости мембраны для косвенной оценки факторов, в том числе осмотического давления в эритроцитах, влияющих на их морфологию.
3. Математическая модель эритроцита
В первом приближении в модели было учтено только влияние упругости мембраны на форму и состояние эритроцита, что в дальнейшем позволило добавить в модель дополнительные элементы и учесть другие влияния. Основополагающим в разработанной модели явилось то, что влияние упругих свойств мембраны эритроцита, зависящее от состояния её цистоскелета и осмотического давления как в самом эритроците, так и в плазме крови, рассматривалось в качестве одного из ведущих факторов изменения его формы. Переходя в цилиндрические координаты, мы ввели оси симметрии в геометрическую модель эритроцита. Горизонтальную ось обозначили буквой ![]() , а вертикальную – буквой
, а вертикальную – буквой ![]() . Для решения задачи методом конечных элементов ввели область её определения, которая обладает аксиальной симметрией относительно оси
. Для решения задачи методом конечных элементов ввели область её определения, которая обладает аксиальной симметрией относительно оси ![]() . На рис. 3а показано радиальное сечение эритроцита, при этом полная форма получается поворотом на
. На рис. 3а показано радиальное сечение эритроцита, при этом полная форма получается поворотом на ![]() вокруг оси
вокруг оси ![]() и отражением в горизонтальной плоскости. Для задания начальных данных были взяты максимальные значения: исходный радиус эритроцита
и отражением в горизонтальной плоскости. Для задания начальных данных были взяты максимальные значения: исходный радиус эритроцита ![]() , и толщина
, и толщина ![]() . По данным работы [1] коэффициент упругости (коэффициент ригидности или модуль Юнга) мембраны эритроцитов в норме равен 1,7 кПа, при этом в работе [5] указывается, что ригидность в центре и на краю эритроцита отличается на 25-40%. С целью учета этого экспериментального факта в модель была введена зависимость модуля Юнга по формуле:
. По данным работы [1] коэффициент упругости (коэффициент ригидности или модуль Юнга) мембраны эритроцитов в норме равен 1,7 кПа, при этом в работе [5] указывается, что ригидность в центре и на краю эритроцита отличается на 25-40%. С целью учета этого экспериментального факта в модель была введена зависимость модуля Юнга по формуле:
![]() ,
,
где масштабный множитель ![]() .
.
Модуль Юнга при удалении от оси плавно нарастал от 1000 до 1632 Па. Данное изменение модуля Юнга обеспечило плавность контура эритроцита в деформированном состоянии при линейном изменении модуля с возникновением резкого угла по отношению к оси. Коэффициент Пуассона был равен ![]() , при этом давление на стенки эритроцита варьировало от 0,1 до 2 кПа.
, при этом давление на стенки эритроцита варьировало от 0,1 до 2 кПа.
4. Результаты расчетов изменения морфологии с ростом давления
Было проведено моделирование морфологии эритроцитов методом конечных элементов при различных давлениях, действующих на мембрану. Начальная форма эритроцита без внешнего давления представлена на рис. 3а, сетка конечных элементов показана на рис. 3б. При этом начальный размер формы эритроцита был равен 2 и 8 мкм по осям z и ![]() Далее модель эритроцита нагрузили внешним давлением от 500 до 2000 Па. При расчетах предполагалось, что давление
Далее модель эритроцита нагрузили внешним давлением от 500 до 2000 Па. При расчетах предполагалось, что давление ![]() приложено однородно по всей поверхности эритроцита, так что изменение морфологии связано только с внутренними характеристиками эритроцита, которые заложены в модель.
приложено однородно по всей поверхности эритроцита, так что изменение морфологии связано только с внутренними характеристиками эритроцита, которые заложены в модель.
а)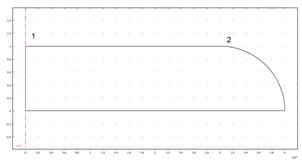 б)
б)
в)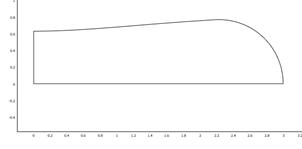 г)
г)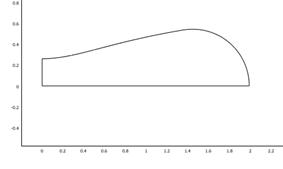
Рис. 3. Геометрическая модель эритроцита: а) недеформированная геометрия эритроцита с размерами 1 на 4 мкм. Цифры 1 и 2 обозначают место измерения смещения эритроцита относительно начального положения; б) сетка конечных элементов; в) изменение морфологии эритроцита при приложении внешнего давления величиной 1000 Па. Эритроцит с размерами 0,8 на 3 мкм; г) морфология эритроцита при приложении внешнего давления величиной 2000 Па. Эритроцит с размерами 0,6 на 2 мкм.
На рис. 3 (в и г) показано изменение морфологии эритроцитов в зависимости от роста давления на мембрану. Видно, что при приложении небольших давлений (рис. 3в), сравнимых с величиной упругости мембраны, форма эритроцита практически не изменяется и близка к начальной форме (рис. 3а). Данная форма характерна для эритроцитов с нарушенными функциями обмена веществ и, соответственно, с низкой разницей давлений внутри и вне мембраны эритроцита (рис. 2 б и в).
При этом сравнение форм эритроцитов по данным атомно-силовой микроскопии и модели, представленных на рис. 2 и 3, необходимо проводить с учетом изменения формы при осаждении эритроцита на подложку. Действительно, эритроцит в модели и в физическом растворе является полностью симметричным объектом. При осаждении на подложку возникают два эффекта, изменяющие форму эритроцита. Во-первых, это прилипание мембраны эритроцита на подложку и связанное с этим «растекание» с видимым удлинением формы. Во-вторых, впадины эритроцита сверху и снизу по причине прилипания к поверхности подложки превращаются в одну впадину с глубиной, равной сумме двух впадин эритроцита, не осажденного на подложку.
С учетом сделанных замечаний проведено сравнение морфологии эритроцитов, полученной в расчетах и при измерении методами АСМ. На рис. 2а представлен эритроцит в норме, имеющий глубину впадины 0,3-0,4 мкм, диаметр 7-8 мкм и ширину 0,7 мкм. Данной форме соответствует модель эритроцита, представленная на рис. 3г, с глубиной впадины, равной 0,52 мкм, диаметром 4 мкм, шириной 1,06 мкм. Поскольку модель не учитывает процессы адгезии и прилипания эритроцита к поверхности, происходящие при измерении методами АСМ, данные в расчетах отличаются от данных АСМ. Если представить, что за счет прилипания эритроцит, сохраняя свой объем, вытянется, значения его толщины и глубины впадины должны соответственно уменьшиться.
Исходя из равенства объемов до и после адгезии, можно предположить, что в этом случае отношение квадратов диаметров должно равняться отношению толщин. Видно, что отношение квадратов диаметров равно примерно 3-4, а отношение толщин и глубин около 1,5. Таким образом, видно, что разработанная модель, даже с учетом процессов адгезии, не может объяснить изменение морфологии эритроцита. Однако предложенная модель позволяет проследить изменение морфологии эритроцита при высыхании и сравнивать результаты данного процесса с экспериментальными данными, полученными методами атомно-силовой микроскопии.
Необходимо сделать несколько замечаний по модели и сравнению полученных расчетных данных с экспериментальными. Модель эритроцита исходит только из предположения о зависимости упругости мембраны от расстояния до центра, на основании проведенных расчетов видно, что модель на качественном уровне описывает изменение морфологии в зависимости от состояния мембраны. При этом мембрана эритроцита выполняет функцию регулятора ионных каналов и содержания ионов калия и других веществ в эритроците, таким образом, меняя величину осмотического давления внутри. Содержание гемоглобина в эритроците также влияет на величину онкотического давления и состояния мембраны и морфологии эритроцита. Поэтому разница давлений в модели эритроцита отражает эти величины в совокупности. Однако у эритроцитов на воздухе при измерении методами АСМ величина осмотического давления должна существенно уменьшиться, а величина онкотического давления остаться без изменений. Именно поэтому величина разницы давлений внутри и вне мембраны в модели эритроцита, равная 2 кПа, близка к онкотическому давлению (0,03–0,04 атм или 3-4 кПа) крови.
Предположение о зависимости упругости мембраны от расстояния до центра, положенное в основу модели, имеет, с одной стороны, экспериментальное подтверждение в ряде работ по атомно-силовой микроскопии [1; 5], с другой стороны, имеет важное следствие. Поскольку модель косвенно подтверждает наличие изменений упругости по поверхности мембраны, возникает естественный вопрос, чем обусловлена эта зависимость упругости. Учитывая, что цитоскелет мембраны эритроцитов состоит из филаментной сети, образованной белком спектрина, а также то, что за упругие свойства мембраны в основном отвечает связующий белок полосы 3, данные моделирования свидетельствуют в пользу следующего предположения. В центре мембраны эритроцита упругие свойства эритроцита примерно в 1,5 меньше, чем на краю, что может быть обусловлено меньшей концентрацией белка полосы 3, а также более разряженной, по сравнению с краем эритроцита, сеткой цитоскелета. Атомно-силовая микроскопия позволяет определять тонкую структуру цитоскелета мембраны [9], по данным которой структура состоит из ячеек с размерами 50-70 нм. Сложность определения рельефа такого масштаба на биологических объектах до сих пор не позволила определить степень изменения тонкой структуры по поверхности мембраны. Таким образом, в рамках модели стоит задача определения изменений тонкой структуры мембраны по поверхности эритроцита с удалением от его центра, с другой стороны, изменение концентрации белка полосы 3.
Заключение
В работе предложена математическая модель эритроцита, позволяющая рассчитать упругие свойства и оценить морфологию эритроцитов. Модель представляет эритроцит в виде однородного упругого тела с упругостью, зависящей от расстояния до центра симметрии эритроцита. Расчет упругих свойств выполнен методом конечных элементов, получена зависимость морфологии эритроцита от давления на мембрану. Внешнее давление менялось в диапазоне 0,5-2 кПа, что позволило оценить значение факторов, влияющих на форму эритроцитов. Проведено сравнение расчетных данных с данными атомно-силовой микроскопии, что позволило сделать вывод о состоятельности модели и ее развитии за счет добавления новых составляющих. Модель также позволяет сделать косвенные оценки разницы давлений внутри и вне мембраны эритроцитов, связав ее с онкотическим давлением. Кроме этого, модель позволяет предположить изменение тонкой структуры цитоскелета в зависимости от расстояния до центра эритроцита, что может быть связано с концентрацией белка полосы 3 или с размерами ячеек филаментной сети.
Работа выполнена при поддержке ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы (соглашение № 14.B37.21.0228). Автор благодарит к.ф.-м.н., доцента Дышловенко П.Е. за проведение расчетов.
Рецензенты:
Потатуркина-Нестерова Наталия Иосифовна, доктор медицинских наук, профессор ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск.
Остапенко Геннадий Иванович, доктор химических наук, профессор ФГБОУ ВПО «Тольяттинский государственный университет», г. Тольятти.



