Введение
С каждым годом во всем мире растет потребность в чистой пресной воде, что связано, прежде всего, с бурным ростом промышленных производств. На сегодняшний день промышленностью используется около 30% устойчивого стока всех земных рек. Возвращаются эти воды в виде так называемых сточных вод, содержащих большое количество вредных веществ.
К наиболее распространенным загрязнителям относятся ионы тяжелых металлов, попадающие в естественные водоемы в составе сточных вод гальванических производств. Попытки создания установок для нейтрализации сточных вод гальванических производств не дают положительных результатов, потому что на нейтрализацию направляют смешанные стоки, содержащие целый «букет» особо опасных тяжелых металлов. Из-за повышенного загрязнения природных водоисточников традиционно применяемые технологии обработки воды стали недостаточно эффективными [1; 2; 9].
К одному из наиболее перспективных направлений очистки воды следует отнести электрохимические методы, и в частности электрохимические методы очистки воды на переменном токе промышленной частоты.
Однако большое потребление электроэнергии и использование растворимых электродов ограничивают применение электрохимических процессов на практике.
В Сибирском государственном аэрокосмическом университете разработан способ очистки воды и водных растворов от анионов и катионов электрохимическим методом с применением нерастворимых электродов и переменного асимметричного тока [3-8].
Методика исследований
Для реализации предлагаемого способа процесс очистки воды проводят в электролизере из чередующихся электродов, выполненных в виде пластин. Материал электродов: нержавеющая сталь 12Х18Н10Т, титановый сплав ОТ 4-0. Расстояние между электродами 12 мм. Объем заливаемой воды 1 л. Электроды подключались параллельно к источнику переменного тока частотой 50 Гц; боковые стенки при использовании электролизера являлись рабочими. Температура очищаемой воды 20-25 °С. Переменный электрический ток пропускался через воду в течение 10 минут при силе тока 0,5 А и напряжении на клеммах электродов 4,1 В.
Обработке подвергалась вода, содержащая ионы кадмия (II), меди (II), никеля (II) и хрома (VI). Начальная концентрация каждого иона в растворе 0,5 мг/л.
После пропускания переменного электрического тока в воду вводился хорошо растворимый коагулянт – сернокислое железо FeSO4·7H2O, далее вода отстаивалась. При введении в воду коагулянта происходило его растворение и электролитическая диссоциация с последующим образованием малорастворимого гидрата окиси железа (III), выпадающего в осадок в виде хлопьев и выступающего в качестве комплексообразователя. Соотношение начальных концентраций иона комплексообразователя и удаляемого иона (![]() ) изменялось от 1:1 до 2,5:1. Время отстаивания воды (��отс) изменялось от 1 до 10 суток.
) изменялось от 1:1 до 2,5:1. Время отстаивания воды (��отс) изменялось от 1 до 10 суток.
Количественный анализ ионов, содержащихся в водном растворе после очистки, проводился на масс-спектрометре Agilent 7500 ICP -MS.
Принципиальная схема экспериментальной установки представлена на рис. 1.
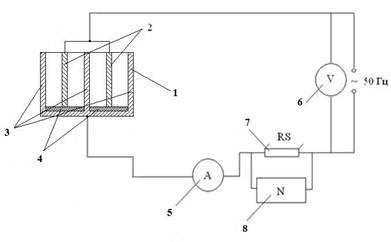
Рис. 1. Принципиальная схема экспериментальной установки:
1 – корпус; 2 – титановые электроды ОТ4-0; 3 – стальные электроды 12Х18Н10Т; 4 – пластины диэлектрические (оргстекло); 5 – амперметр; 6 – вольтметр; 7 – шунт измерительный; 8 – осциллограф С1-83.
Степень очистки определялась по формуле, %:
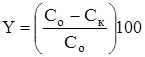 ,
,
где ![]() ,
, ![]() – начальная и конечная концентрации удаляемого иона металла, мг/л.
– начальная и конечная концентрации удаляемого иона металла, мг/л.
Удельные энергозатраты W определялись по формуле, (кВт·ч)/м3:
![]() ,
,
где I – сила тока, А;
U – напряжение на клеммах электродов, В;
![]() – время пропускания электрического тока, ч;
– время пропускания электрического тока, ч;
V – объем заливаемой воды, м3;
10-3 – переводной коэффициент из Вт в кВт.
Результаты исследований и их обсуждение
Исследование влияния соотношения начальных концентраций иона комплексообразователя и удаляемого иона на степень очистки проводилось при постоянном времени отстаивания (10 суток).
Результаты экспериментальных исследований представлены в таблице 1 и на рис. 2.
Таблица 1 – Результаты экспериментальных исследований влияния соотношения начальных концентраций иона комплексообразователя и удаляемого иона на степень очистки
|
Ион металла |
|
Со, мг/л |
Ск, мг/л |
Y, % |
|
Cd2+ |
1:1 |
0,5 |
0,308 |
38,4 |
|
1,75:1 |
0,247 |
50,6 |
||
|
2,5:1 |
0,180 |
64,0 |
||
|
Cu2+ |
1:1 |
0,5 |
0,250 |
50,0 |
|
1,75:1 |
0,175 |
65,0 |
||
|
2,5:1 |
0,098 |
80,4 |
||
|
Ni2+ |
1:1 |
0,5 |
0,390 |
22,0 |
|
1,75:1 |
0,339 |
32,2 |
||
|
2,5:1 |
0,292 |
41,6 |
||
|
Cr6+ |
1:1 |
0,5 |
0,319 |
36,2 |
|
1,75:1 |
0,179 |
64,2 |
||
|
2,5:1 |
0,031 |
93,8 |
||
|
Fe2+ |
1:1 |
2 |
0,800 |
60,0 |
|
1,75:1 |
3,5 |
0,697 |
80,1 |
|
|
2,5:1 |
5 |
0,040 |
99,2 |
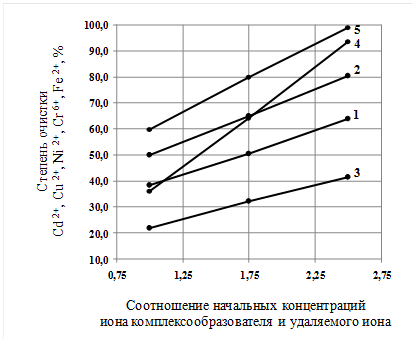
Рис. 2. Зависимость степени очистки ионов металлов от соотношения начальных концентраций иона комплексообразователя и удаляемого иона. Степень очистки: 1 – кадмия; 2 – меди; 3 – никеля; 4 – хрома; 5 – железа.
Исследование влияния времени отстаивания на степень очистки проводилось при постоянном соотношении начальных концентраций иона комплексообразователя и удаляемого иона (2,5:1).
Результаты экспериментальных исследований влияния времени отстаивания на степень очистки представлены в таблице 2 и на рис. 3.
Таблица 2 – Результаты экспериментальных исследований влияния времени отстаивания на степень очистки
|
Ион металла |
��отс, сутки |
Со, мг/л |
Ск, мг/л |
Y, % |
|
Cd2+ |
1 |
0,5 |
0,280 |
44,0 |
|
5 |
0,236 |
52,8 |
||
|
10 |
0,180 |
64,0 |
||
|
Cu2+ |
1 |
0,5 |
0,276 |
44,8 |
|
5 |
0,197 |
60,6 |
||
|
10 |
0,098 |
80,4 |
||
|
Ni2+ |
1 |
0,5 |
0,341 |
31,8 |
|
5 |
0,319 |
36,2 |
||
|
10 |
0,292 |
41,6 |
||
|
Cr6+ |
1 |
0,5 |
0,121 |
75,8 |
|
5 |
0,081 |
83,8 |
||
|
10 |
0,031 |
93,8 |
||
|
Fe2+ |
1 |
2 |
0,900 |
55,0 |
|
5 |
3,5 |
0,886 |
74,7 |
|
|
10 |
5 |
0,040 |
99,2 |
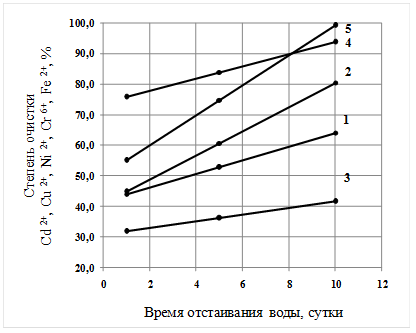
Рис. 3. Зависимость степени очистки ионов металлов от времени отстаивания воды. Степень очистки: 1 – кадмия; 2 – меди; 3 – никеля; 4 – хрома; 5 – железа.
Из графиков видно, что увеличение соотношения начальных концентраций иона комплексообразователя и удаляемого иона и времени отстаивания воды приводит к значительному увеличению степени очистки рассматриваемых ионов при малых удельных энергозатратах (0,34 кВт·ч/м3).
При увеличении соотношения начальных концентраций от 1:1 до 2,5:1 степень очистки увеличивается для кадмия в 1,7 раза, меди – 1,6, никеля – 1,9, хрома – 2,6 и железа – 1,7.
При увеличении времени отстаивания воды от 1 до 10 суток степень очистки увеличивается для кадмия в 1,5 раза, меди – 1,8, никеля – 1,3, хрома – 1,2 и железа – 1,8.
Выводы
Экспериментальные исследования показали, что наибольшая степень очистки для всех рассматриваемых ионов металлов достигается при пропускании через очищаемую воду переменного асимметричного тока с использованием нерастворимых электродов (нержавеющая сталь 12Х18Н10Т, титановый сплав ОТ 4-0), введением коагулянта – сернокислого железа FeSO4·7H2O в соотношении начальных концентраций иона комплексообразователя и удаляемого иона 2,5:1 и отстаиванием воды в течение 10 суток. При этом степени очистки равны: для кадмия 64%, меди – 80,4%, никеля – 41,6%, хрома – 93,8% и железа – 99,2%. Удельные энергозатраты составляют W = 0,34 (кВт·ч)/м3. В то время как при очистке электрохимическим способом с применением нерастворимых электродов и переменного тока удельные энергозатраты составляют 1,5-2 (кВт·ч)/м3.
Рецензенты:
Петров Михаил Николаевич, д-р техн. наук, профессор, зав. кафедрой «Электронная техника и телекоммуникации», Сибирский государственный аэрокосмический университет им. академика М.Ф. Решетнева (СибГАУ), г. Красноярск.
Смирнов Николай Анатольевич, д-р техн. наук, профессор, зав. кафедрой «Теоретическая механика», Сибирский государственный аэрокосмический университет им. академика М.Ф. Решетнева (СибГАУ), г. Красноярск.



