Ретровирусы отличаются рядом особенностей жизненного цикла, которыми являются: наличие стадии обратной транскрипции (и, таким образом, чередование форм вирусного генома РНК – ДНК – РНК) и стадии интеграции вирусного ДНК-генома в геном зараженной клетки. Проникновение ретровируса в клетку начинается с взаимодействия белка оболочки с клеточным рецептором. После взаимодействия вируса с клеточным рецептором происходит проникновение нуклеокапсида в цитоплазму (путем слияния мембран вируса и клетки). В цитоплазме происходит обратная транскрипция, продуктом которой является двухцепочечная ДНК-копия РНК-генома вируса (провирус). Провирус интегрируется в геном зараженной клетки, этот процесс обеспечивается вирусной интегразой и рядом клеточных белков [6].
После интеграции провирус ведет себя как обычный клеточный ген – транскрибируется клеточной РНК-полимеразой II с участием клеточных факторов транскрипции, однако уровень его транскрипции зависит от вирусных регуляторных последовательностей, локализованных в длинных концевых повторах (LTR) провируса. После синтеза вирусных белков происходит сборка вириона и отпочковывание его от цитоплазматической мембраны клетки, после чего инфекционный цикл повторяется [6].
Было показано, что в осуществление первичного связывания многих простых и сложных ретровирусов с клеткой вовлечены расположенные на внешней стороне клеточной мембраны гепарансульфаты и протеогликаны, находящиеся на поверхности вирусных частиц. Контакт ретровируса с первичными рецепторами необходим для последующего прочного взаимодействия с рецептором/корецептором, специфичным для разных ретровирусов. Таким образом, поиск эффективных ингибиторов, подавляющих взаимодействие ретровирусов с гепарансульфатами, расположенными на клеточной мембране, является актуальной задачей, решение которой может привести к созданию препарата широкого спектра действия, эффективного в отношении различных групп патогенных ретровирусов, а также ряда других патогенных вирусов, использующих гепарансульфаты в качестве первичных неспецифических рецепторов.
Гепарансульфаты – компоненты плазматических мембран клеток, где они могут функционировать как рецепторы и участвовать в клеточной адгезии и межклеточных взаимодействиях. По своей структуре гепарансульфаты, как и гепарин, относятся к группе гликозоаминогликанов, которые представляют собой длинные неразветвленные цепи гетерополисахаридов, построенные из повторяющихся дисахаридных единиц. Основные составляющие этих полимеров – гексуроновая кислота (D-глюкуроновая кислота или L-идуроновая) и N-ацетилглюкозамин. Основное отличие гепарина от гепарансульфата состоит в меньшей степени сульфирования. Наличие сульфатных, а также карбоксильных групп определяет существенный отрицательный заряд этих биополимеров в нейтральных условиях. Известно, что сульфированные полисахариды проявляют высокую антивирусную активность, препятствуя проникновению в клетку ДНК- и РНК-содержащих вирусов (вирус простого герпеса, цитомегаловирус человека, вирус Синдбис, ВИЧ, вирус лейкоза мышей) [2; 3; 7; 8].
За последние 20 лет было показано, что сульфированные полисахариды обладают широким спектром противовирусной активности in vitro. Огромное структурное многообразие этих макромолекул, тем не менее, создает серьезные препятствия для установления взаимосвязи их структуры и активности. Однако, на основе накопленных данных, выявлено несколько структурных элементов, которые предположительно очень важны для противовирусной активности.
Степень сульфирования имеет большое влияние на противовирусную активность полисахаридов. Для отдельных классов полусинтетических полисахаридов (например, декстран сульфат) известно, что чем больше степень сульфирования, тем выше противовирусная активность [10]. Предполагается, что чем длиннее полисахаридная цепь, тем более вероятно узнавание и взаимодействие с несколькими вирусными белками, которые отвечают за взаимодействие вируса с клеткой-мишенью [5].
Мы использовали ранее разработанную модельную систему на основе лентивирусных векторов [1], чтобы установить, как сульфированные полисахариды действуют на проникновение вируса в клетку. Псевдолентивирусы представляют собой препараты рекомбинантных лентивирусных частиц, созданные на основе ВИЧ-1. Они содержат набор структурных белков и ферментов ВИЧ-1, но при этом псевдолентивирусы не являются репликационно-компетентными, поскольку вместо вирусных генов несут в своем геноме маркерный ген зеленого флуоресцентного белка, и по сути это «одноразовые» вирусы, что делает безопасной работу с ними. Мы использовали псевдолентивирусные частицы, содержащие на мембране белок оболочки gp120+gp41 ВИЧ-1 или белок G оболочки вируса везикулярного стоматита (ВВС). Выбор белков оболочки обусловлен тем, что у этих вирусов различный механизм проникновения в клетку: у ВИЧ-1 клеточными рецепторами для первичного неспецифического связывания вируса с клеткой служат гепарансульфаты, в то время как ВВС проникает в клетку путем эндоцитоза, опосредованный контактом белка G оболочки с фосфолипидами клеточной мембраны [4]. Опыты проводили на клетках линии Jurkat (Т-лимфобластный лейкоз человека), содержащих специфические рецептора ВИЧ-1.
Для определения адекватности системы для исследования и тестирования потенциальных противовирусных препаратов, был использован описанный в литературе препарат – декстран сульфат [5].
Экспериментальная часть
Культура клеток
В работе использовали клетки почки эмбриона человека линии HEK293, растущие на стандартной среде DMEM, содержащей 10% эмбриональной сыворотки крупного рогатого скота (СЭ КРС), 4мM L-глутамина, 1мM пирувата натрия, стрептомицин/пенициллин в концентрации 100 мкг/мл и 100 ед/мл, соответственно, и клетки Т-лифобластного лейкоза человека линии Jurkat, которые культивировали на среде RPMI-1640, содержащей 20% СЭ КРС, 4мM L-глутамина, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина. Клетки растили при температуре 37 °С в атмосфере 5% СО2.
Получение псевдолентивирусных частиц
В качестве упаковывающих клеток, в которых осуществляется сборка рекомбинантных лентивирусных частиц и их секреция в культуральную среду, использовали клетки HEK293, которые за 12-14 часов до начала трансфекции высевали на чашки Петри диаметром 100 мм в количестве 3.0–3.5×106 клеток на чашку.
ДНК лентивирусного вектора, содержащего маркерный ген зеленого флуоресцирующего белка, вместе с плазмидами, направляющими синтез белков, необходимых для формирования псевдовирусных частиц, вводили в клетки HEK293 методом Ca-фосфатной трансфекции. Инфекционные псевдовирусные частицы начинали собирать через 24 часа после трансфекции с интервалами 10-12 часов [1].
Титрование вируса проводили на клетках Jurkat, за 14–16 часов до заражения высеянных в лунки 24-луночных планшетов (3×105 клеток на лунку). Измерение уровня флуоресценции клеток проводили на проточном цитофлуориметре Epics 4XL Beckman Coulter (США) через 48 часов после заражения. Титр вируса рассчитывали по формуле T = N×P/V, где N – количество высеянных клеток, P – доля инфицированных клеток в популяции, V – количество добавленного супернатанта, содержащего псевдо-ВИЧ-1 частицы, T – титр вируса. В работе использовали сборы с титрами вируса в пределах 5.4×106мл-1.
Определение цитотоксичности исследуемых соединений
Цитотоксичность препаратов для неинфицированных клеток Jurkat определяли по изменению морфологии и количеству жизнеспособных клеток методом окрашивания раствором трипанового синего (Invitrogen Corporation, США). Для этого в культуральную среду вносили препарат полисахарида до концентрации 10 и 100 мкг/мл. Через 48 ч клетки ресуспендировали в среде и окрашивали 0,4%-ным раствором трипанового синего в течение 5 мин. Затем подсчитывали число жизнеспособных (неокрашенных) и нежизнеспособных (окрашенных) клеток в камере Ньюбауэра. Количество живых клеток в популяции оценивали по количеству неокрашенных клеток в процентах от общего числа клеток.
Определение противовирусной активности исследуемых соединений
Активность препаратов против псевдолентивирусных частиц определяли на клетках линии Jurkat, к которым добавляли различные количества испытуемых препаратов в объеме 20 мкл на лунку перед добавлением препарата псевдолентивирусных частиц. Измерения количества флуоресцирующих клеток проводились через 48 ч после заражения на проточном цитофлуориметре. Полученные данные обрабатывали по методу Фишера-Стьюдента. Различия считали достоверными при p<0,05. В эксперименте использовали сукциноилхитозан, сульфосукцинилхитозан, сульфат хитозана, декстран сульфат натриевые соли в концентрациях 0.01, 0.1, 1, 10, 100 мкг/мл раствора на лунку.
Результаты
Исследованные соединения не проявили цитотоксического воздействия на клетки линии Jurkat в концентрации до 100 мкг/мл.
Показано, что декстран сульфат ингибирует лентивирусную трансдукцию клеток-мишеней, полученная нами величина IC50 составила 0,095 мкг/мл, что согласуется с данными литературы по активности этого соединения, по которым IC50 составляет 0,01–0,23 мкг/мл [2; 5; 9]. Эти данные позволяют утверждать, что представленная экспресс-система адекватна и может быть использована для анализа потенциальной противовирусной активности других полисахаридов.
Было установлено, что сульфат хитозана препятствует трансдукции клеток псевдолентивирусными частицами с белком оболочки gp120+gp41 (ВИЧ-1), его эффективность сравнима с эффективностью декстран сульфата. Сульфосукцинилхитозан малоактивен, а сукцинилхитозан практически не активен.
Ни один из препаратов не проявил противовирусной активности в отношении псевдолентивирусных частиц, псевдотипированных белком G оболочки ВВС. Результаты исследований представлены в таблице 1 и на рисунке 1.
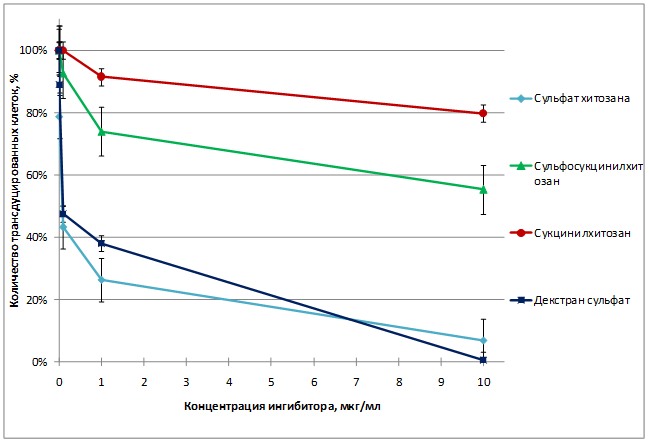
Рис. 1. Противовирусная активность препаратов на клеточной линии Jurkat через 48 ч после добавления псевдолентивирусных частиц, псевдотипированных белком оболочки gp120+gp41 ВИЧ-1.
Таблица 1 – Противовирусная активность сульфированных полисахаридов на псевдовирусных частицах с белком оболочки ВИЧ-1 или белком оболочки вируса везикулярного стоматита (ВВС), показанная на клетках T-лимфобластного лейкоза человека линии Jurkat
|
Соединение |
IC50, мкг/мл |
|
|
ВИЧ-1 |
BBC |
|
|
Декстрансульфат натриевая соль, Sigma D6924, МW 9.0--20.0 кДа, степень замещения 2.3 |
0.0950 ± 0.0025 |
> 100 |
|
Сульфат хитозана, МW 100 кДа, СЗ 1.5 |
0.02 ± 0.015 |
> 100 |
|
Сульфосукцинилхитозан, МW 16.9 кДа, СЗ 0.64 |
12,00 ± 0,95 |
> 100 |
|
Сукцинилхитозан, МW 9.6 кДа, СЗ 0.55 |
> 100 |
> 100 |
IC50 – концентрация ингибитора, при котором уровень заражения снижается на 50% относительно контрольных клеток, не подвергавшихся действию ингибитора.
На основании полученных результатов можно сделать вывод, что противовирусная активность исследованных препаратов зависит от вида белка оболочки вируса, исследованные препараты специфично препятствуют проникновению в клетку вирусов, первичными рецепторами которых являются клеточные гепарансульфаты.
Мы можем утверждать, что использованная в настоящей работе система пригодна для специфического поиска ингибиторов проникновения ВИЧ-1 в клетку, препятствующих взаимодействию вируса с первичными рецепторами на поверхности клетки-мишени.
Авторы выражают благодарность д.х.н., профессору С.Н. Михайлову за обсуждение результатов.
Исследование выполнено при поддержке Министерства образования и науки Российской Федерации, соглашение № 8270, и Программ фундаментальных исследований Президиума РАН «Молекулярная и клеточная биология» и «Основы фундаментальных исследований нанотехнологий и наноматериалов».
Рецензенты:
Рубцов П.М., д.б.н., заведующий лабораторией молекулярной эндокринологии Федерального государственного бюджетного учреждения науки «Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук» (ИМБ РАН), г. Москва.
Белжеларская С.Н., д.б.н., старший научный сотрудник Федерального государственного бюджетного учреждения науки «Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук» (ИМБ РАН), г. Москва.



