Введение
До настоящего времени дискутируется вопрос о роли отдельных видов условно-патогенных микроорганизмов в формировании нормальной микрофлоры тела человека, участии их в этиологии и патогенезе ряда заболеваний [1,7,10]. Энтерококки, входящие в состав нормальной микрофлоры пищеварительного тракта человека, играют важную роль в обеспечении колонизационной резистентности слизистых [2,5,9]. В то же время они являются представителями группы условно-патогенных бактерий, способных вызывать аутоинфекцию, а при накоплении в окружающей среде – приводить к экзогенному инфицированию [3].
Анализ направленности межмикробных взаимоотношений позволяет прояснить патогенез широкого спектра заболеваний, правильно оценить происхождение тех или иных аномалий в структуре микросимбионтов, приводящих к изменению их типичных или проявлению новых биологических свойств [3].
В последние годы в России официально регистрируется более 1,2 миллионов больных различными паразитоценозами, среди которых отмечается рост заболеваемости кишечными протозоозами. В связи с этим особую актуальность приобретает широко распространенная протозойная инвазия, обусловленная паразитированием в толстом кишечнике простейших Blastocystis spp. [6,8,11].
Возбудитель бластоцистной инвазии является микроорганизмом, к усилению агрессии которого, с одной стороны, могут приводить факторы, снижающие защитные силы макроорганизма, а с другой стороны – микроорганизмы, входящие в состав биоценоза. Установлено, что, находясь в кишечнике, бластоцисты участвуют в формировании микробиоценоза данного биотопа. Нарушая баланс микроорганизмов, эти возбудители способствуют созданию благоприятных условий для развития патологических процессов [4].
В течение последних лет наблюдается увеличение удельного веса инфекционных заболеваний, вызванных ассоциациями условно-патогенных микроорганизмов, колонизирующих кишечник человека [2,3]. Эти инфекции характеризуются выраженным клиническим полиморфизмом, связанным с одновременным воздействием нескольких агентов, что затрудняет интерпретацию результатов, поскольку каждая из составляющих культур обладает рядом характеристик, сочетание которых может определять высокий патогенный потенциал возбудителей в целом [2, 9].
В настоящее время наименее изучены механизмы, обеспечивающие симбиотические связи в формировании протозойно-бактериальных ассоциаций кишечника. Известен ряд механизмов взаимодействий между бактериями и простейшими, ключевым моментом которых является нарушение нормального процесса фагоцитоза и сохранение жизнеспособности бактерий в теле протистов [3,5].
Поскольку в последние годы повсеместно отмечается тенденция увеличения ассоциированных инфекций, проведение комплексных исследований, направленных на выявление изменений биологических свойств ассоциированных микросимбионтов в протозойно-бактериальных сообществах, является весьма актуальным [3].
В связи с этим целью работы является изменение биологических свойств энтерококков в условиях межмикробного взаимодействия с простейшими бластоцистами.
Материалы и методы
Изучение паразитоценоза гастроэнтерологических больных проводили в соответствии с Методическим указанием МУК 4.2.735-99 «Паразитологические методы лабораторной диагностики гельминтозов и протозоозов», утвержденных главным государственным санитарным врачом РФ 25.02.1999 г.
Состояние микроценоза, количественную и качественную оценку его состава проводили с использованием метода количественного и качественного выделения видов и вариантов микроорганизмов согласно приказу Минздрава России от 09.06.2003 г. №231 «Об утверждении отраслевого стандарта «Протокол ведения больных. Дисбактериоз кишечника» (Ост 91500.11.0004-2003).
Объектом для изучения послужили культуры Еnterococcus faecalis, выделенные у лиц с заболеваниями ЖКТ, инвазированных бластоцистами. Для выделения чистых культур энтерококков использовали энтерококк агар (НПЦ, г. Оболенск) с последующим накоплением на Columbia agar (Bio-Rad, Франция) с кровью и идентификацией на среде Diskinson Oxoid (Himedia, Индия).
Для получения изолятов бластоцист фекалии собирали в чисто вымытые флаконы, не содержащие следов химических реактивов, дезинфицирующих веществ и антибиотиков. Пробы фекалий заливали равным объемом (1:1) физиологического раствора, суспензировали и фильтровали. Фильтрат в объеме 0,5-1,0 мл вносили в пробирку с питательной средой Suresh, засевали одновременно 5–6 пробирок, и культивирование проводили в течение трех суток, при температуре 37 оС (Сахарова, 1997).
Вирулентность микроорганизмов определяли путем внутрибрюшинного введения белым мышам массой 16–18 г 0,5 мл взвеси суточной культуры микроорганизмов. Взвеси готовили путем серийных разведений различной концентрации от 101 КОЕ/мл до 109 КОЕ/мл. На каждый исследуемый штамм делали шесть таких разведений, которые затем вводили внутрибрюшинно беспородным белым мышам. Через сутки у каждого штамма определяли величину LD50. В соответствии с результатами проведенных экспериментов к высоковирулентным относили штаммы с LD50 от 101 до 103 КОЕ/мл, к умеренновирулентным – от 103 до 106 КОЕ/мл, а штаммы c LD50 свыше 106 КОЕ/мл считали слабовирулентными (Костюкова и соавт., 1996).
Для изучения антилизоцимной активности (АЛА) энтерококков использовали фотометрический метод, предложенный О. В. Бухариным с соавт. (1997). Антилактоферриновую активность (АЛфА) микроорганизмов изучали по описанной методике О. В. Бухарина с соавт. (2005). Количество лактоферрина определяли методом твердофазного иммуноферментного анализа с использованием наборов «Лактоферрин – стрип», ЗАО «Вектор – Бест» г. Новосибирск. Рассчитывали антилактоферриновую активность по формуле и выражали в нг инактивированного лактоферрина на мл супернатанта (нг/мл). Антигистоновую активность исследуемых микроорганизмов определяли фотометрическим методом (Бухарин О.В. и др., 2003). Для осуществления способа использовали препарат гистонов из коровьего тимуса, производства фирмы «Sigma» (США), в виде лиофилизированного порошка, содержащего общую фракцию гистонов.
Статистическую обработку данных проводили при помощи программы «Statistica for Windows» [6].
Результаты и их обсуждения
Обследовано 896 гастроэнтерологических больных. Из них у 503 (56,14±5,4 %) в фекалиях были обнаружены простейшие Blastocystis spp. Проведенными исследованиями установлено нарушение стабильности ассоциативного симбиоза толстого кишечника при инвазии простейшими бластоцистами. На фоне снижения колонизационной резистентности нормальной микробиоты отмечалось значительное повышение частоты встречаемости условно-патогенных микроорганизмов.
Наиболее выраженные изменения указанных показателей были выявлены у представителей рода Enterococccus spp. В связи с этим представлялось интересным изучение видового спектра энтерококков, выделенных у обследованных.
Показано, что в составе микроценоза кишечника были выделены два вида энтерококков E.faecium и E.faecalis. Наиболее часто в культуре всречался E.faecalis, он был выделен в 61,38![]() 3,2 % случаях (255 штаммов), E.faecium обнаружен в 38,03
3,2 % случаях (255 штаммов), E.faecium обнаружен в 38,03![]() 1,7 % (137 штаммов), совместно оба штамма выявлялись в 5,59
1,7 % (137 штаммов), совместно оба штамма выявлялись в 5,59![]() 0,4 % (24 штамма) обследуемых лиц. Показатели обсемененности E.faecium и E.faecalis при инвазии Blastocystis spp. составили lg 8,2±0,3 и lg 8,5±0,4 КОЕ/г соответственно (р<0,01).
0,4 % (24 штамма) обследуемых лиц. Показатели обсемененности E.faecium и E.faecalis при инвазии Blastocystis spp. составили lg 8,2±0,3 и lg 8,5±0,4 КОЕ/г соответственно (р<0,01).
Поскольку энетерококки относят к нормальной микрофлоре кишечника человека, становится очень интересным факт их резкого количественного увеличения при инвазированности кишечника бластоцистами. Несомненно, интересным представляется дальнейшее изучение ассоциации простейших Вlastocystis spp. с представителями родов Enterococcus и изучение глубины качественных и количественных изменений внутри симбиотической микрофлоры кишечника обследованных в зависимости от показателей вирулентности простейших бластоцист.
Анализ изучения обсемененности кишечника энтерококками в зависимости от степени вирулентности бластоцист выявил существенные изменения. При усилении вирулентности бластоцист от LD50/lg 0 до 6,4±0,5 статистически достоверно резко изменялась обсемененность кишечника штаммами E.faecalis и E.faecium (рис. 1). Значения их колонизации изменялись от lg 2,7±0,3, lg 2,1±0,3 до lg 8,6±0,3, 8,2±0,1 КОЕ/г соответственно (р<0,001).
Поскольку наиболее часто встречаемым оказался представитель вида E.faecalis, все дальнейшие исследования были направлены на изучение биологических свойств данного представителя.
Изучение частоты встречаемости Е.faecalis у гастроэнтерологических больных позволило выявить существенные различия. У лиц с бластоцистной инвазией энтерококки высевались в 67,40![]() 3,7 % случаев, у обследованных не инвазированных простейшими показатель составил 27,34
3,7 % случаев, у обследованных не инвазированных простейшими показатель составил 27,34![]() 1,8 %. В группе контроля он не превышал 5,26
1,8 %. В группе контроля он не превышал 5,26![]() 0,7 %.
0,7 %.
Проведенные исследования выявили значительные различия и в плотности колонизации Е.faecalis в кишечном биотопе гастроэнтерологических больных, инвазированных и не инвазированных бластоцистами.
Установлено, что обсемененность энтерококками была значительно выше у больных с бластоцистозом и составила 7,6![]() 0,2 lg KOE/мл, чем у лиц без бластоцистной инвазии (4,7
0,2 lg KOE/мл, чем у лиц без бластоцистной инвазии (4,7![]() 0,4 lg KOE/мл). В контрольной группе плотность колонизации энтерококками не превышала 2,5
0,4 lg KOE/мл). В контрольной группе плотность колонизации энтерококками не превышала 2,5![]() 0,3 lg KOE/мл.
0,3 lg KOE/мл.
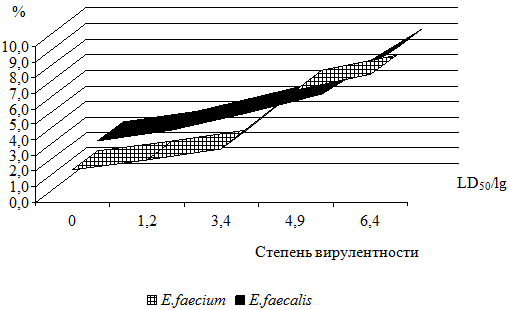
Рис. 1. Характеристика связи вирулентности Blastocystis spp. с уровнями высеваемости бактерий родов: 1 – E.faecium, 2 – E.faecalis
Сравнительный анализ частоты встречаемости и плотности колонизации энтерококков у больных с различными формами заболеваний ЖКТ с бластоцистозом и без инвазии простейшими бластоцистами представлен в таблице 1.
Таблица 1
Показатели частоты встречаемости и плотности колонизации E. faecalis лиц с заболеваниями ЖКТ
|
Заболевания |
Лица с заболевания ЖКТ с бластоцистозом |
Лица с заболевания ЖКТ без бластоцистоза |
||
|
Частота встречаемости (%) |
Плотность колонизации (lg КОЕ/мл) |
Частота встречаемости (%) |
Плотность колонизации (lg КОЕ/мл) |
|
|
ЯБЖ |
66,57 |
9,3±0,4* |
52,61 |
7,8±0,4* |
|
ЯБД |
75,58 |
8,2±0,4* |
68,69 |
7,4±0,3* |
|
ХГ |
53,59 |
7,0±0,3* |
42,31 |
6,8±0,4 |
|
ХХ |
23,78 |
6,7±0,3* |
18,19 |
6,2±0,2* |
|
ЖКБ |
15,39 |
6,9±0,3* |
10,41 |
6,7±0,8 |
|
Здоровые |
46,61 |
6,4±0,2* |
46,58 |
6,4±0,3* |
Примечание: * – достоверность различия показателя по сравнению с группой контроля (р<0,05).
Из таблицы видно, что при всех нозологических формах заболеваний частота встречаемости и плотность колонизации энтерококков значительно выше у больных, инфицированных бластоцистами.
Наиболее выраженные указанные изменения были у больных ЯБЖ, ЯБД и ХГ. У этой группы пациентов по сравнению с больными без бластоцистоза и здоровыми людьми частота встречаемости и обсемененность энтерококками была высокой, что является прогностически не благоприятным признаком.
Следующим этапом работы явилось изучение вирулентности клинических изолятов E. faecalis. Результаты исследования вирулентности изолятов Е. faecalis методом внутрибрюшинного заражения мышей показали, что из 416 штаммов энтерококков, выделенных у лиц с заболеваниями ЖКТ, только 318 (73,78±3,6 %) вызывали гибель животных, показатель LD50 /lg этих штаммов варьировал от 3,6±0,1 до 5,7±0,6. В зависимости от величины данного показателя штаммы были разделены на три группы. LD50/lg изолятов энтерококков первой группы (59 штаммов) составлял 3,6±0,1- 4,4±0,3; второй группы – 4,5±0,4-5,0±0,5 (156 штаммов) и третьей группы - 5,1±0,7–5,7±0,6 (103 штамма).
Таким образом, установлено, что только 73,78±3,6 % клинических изолятов Е. faecalis были вирулентными. Их показатели вирулентности варьировали в пределах от 3,6±0,1 до 5,7±0,6 LD50 /lg, наибольшее количество изолятов (49,05±2,3 %) обладало умеренно выраженной степенью вирулентности.
Изменение биологических свойств условно-патогенных энтеробактерий, в частности усиление вирулентности, рассматривают в качестве одной из причин изменения этиологической структуры патологических состояний инфекционного генеза [2]. Тем не менее исследования количественных и качественных изменений штаммов E.faecalis в протозойно-бактериальных ассоциациях по показателю вирулентности не проводилось.
Учитывая сказанное, следующим этапом нашей работы явилось изучение патогенного потенциала клинических изолятов E.faecalis при ассоциативном симбиотическом взаимодействии с Blastocystis spp. in vivo и при их сокультивировании in vitro.
У штаммов E.faecalis, изолированных из ассоциативных симбиозов с высоковирулентными бластоцистами, данный показатель был самым высоким и составил LD50/lg 6,4±0,3 – 7,2±0,5. Для энтерококков, выделенных в консорциуме с умеренновирулентыми Blastocystis spp. LD50/lg, равнялся 4,6±0,5-6,3±0,3. В ассоциации со слабовирулентными Blastocystis spp. энтерококки имели самые низкие значения, которые колебались в пределах 1,3±0,2 до 3,4±0,2 LD50/lg. В контроле вирулентность штаммов энтерококков находилась в пределах – 1,1±0,2 до 1,3±0,5 LD50/lg.
Таким образом, нами было установлено, что штаммы E.faecalis, выделенные после сокультивирования с бластоцистами, характеризовались как высоко-, так и умеренновирулентными свойствами. Показатель вирулентности штаммов энтерококков, выделенных из ассоциативных микросимбиоценозов с высоковирулентными бластоцистами, в 1,3 и 2,5 раза был выше, чем с умеренно- и слабовирулентными простейшими соответственно.
Анализируя полученные материалы, следует отметить, что выявленная неоднородность по указанному признаку популяций клинических штаммов E.faecalis является отражением тенденции изменения патогенности на генетическом уровне, а именно – структурной модификации бактериальной ДНК, и требует дальнейшего изучения.
Далее в работе были изучены персистентные свойства E. faecalis, выделенных у инвазированных бластоцистами больных. Для изучения изменения биологических свойств бактерии были отобраны 90 штаммов Е.faecalis.
Анализ выраженности персиситентных характеристик у штаммов Е.faecalis показал, что более 80,00±3,6 % (72 культуры) обладают АЛА.
Исследуемые штаммы энтерококков были разделены на 3 группы в зависимости от выраженности данного признака. Среднее значение АЛА составило 2,4±0,02 мкг/мл. На долю штаммов с высокими значениями признака (2,7±0,05 мкг/мл) приходилось 26,38±2,3 % (19 культур), со средними и низкими значениями (2,1±0,02 мкг/м и 1,7±0,03мкг/мл), 34,72±1,7 % (25 культур) и 38,90±1,3 % (28 культур) соответственно.
Далее была изучена антилактоферриновая активность энтерококков. Анализ результатов показал, что из 90 исследуемых штаммов Е.faecаlis 87 (96,66±7,3 %) проявляли данное свойство. Все исследуемые культуры, Е.faecаlis также как и в предыдущем случае были разделены на 3 группы. Первую группу составили штаммы энтерококков, проявляющие высокие значения АЛфА, на их долю приходилось более половины исследуемых культур 51,72±2,3 % (45 штаммов), 15 культур Е.faecаlis (17,24±1,3 %) и 27 (31,04±2,4 %) проявляли средние и низкие значения изучаемого признака соответственно.
При анализе АГА энтерококков установлено, что этот признак проявлялся не у всех штаммов исследуемых культур энтерококков и в значительной степени имел низкую частоту встречаемости в отличие от АЛА и АЛфА.
Из таблице видно, что 63,21±4,3 % (55) культур Е.faecаlis обладали данным свойством. Большая часть культур энтерококков имела средние и низкие значения, их величина составила 2,8-4,0±0,05 мкг/мл – 20 культур (36,36±2,9%) и 1,7-2,8±0,05 мкг/мл – 26 культур (47,28±2,7%) соответственно.
Заключение
Таким образом, показано, что в составе микробиоценоза кишечника при инвазии бластоцистами были выделены два вида энтерококков E.faecium и E.faecalis. Наиболее часто в культуре встречался E.faecalis. При усилении вирулентности Blastocystis spp. статистически достоверно резко изменялась обсемененность кишечника штаммами E.faecium и E.faecalis. Значение их колонизации изменялось от lg 2,7±0,3, lg 2,1±0,3 до lg 8,6±0,3, 8,2±0,1 КОЕ/г соответственно (р<0,01).
Определение вирулентности изолятов Е. faecalis показало, что из 431 штаммов энтерококков только 318 (73,78±3,6 %) вызывали гибель животных, показатели их вирулентности варьировали в пределах от 3,6±0,1 до 5,7±0,6 LD50 /lg. Установлено, что штаммы E.faecalis, выделенных после сокультивирования с бластоцистами, характеризовались как высоко-, так и умеренновирулентными свойствами. Показатель вирулентности штаммов энтерококков, выделенных из ассоциативных микросимбиоценозов с высоковирулентными бластоцистами, в 1,3 и 2,5 раза был выше, чем с умеренно- и слабовирулентными простейшими соответственно.
При изучении персистирующей активности (АЛА, АЛфА и АГА) штаммов Е.faecаlis был обнаружен разнонаправленный характер проявления свойств персистенции. Наиболее выраженной оказалось АЛфА штаммов энтероккоков, она обнаружена в 96,66±7,3 % случаев, АЛА и АГА выявлены у 80,00±3,6 % и 63,21±4,3 % культур соответственно.
Рецензенты:
Ильина Н. А., д.б.н., профессор, первый проректор – проректор по науке, ФГБОУ ВПО «УлГПУ им. И. Н. Ульянова», г. Ульяновск.
Слесарев С. М., д.б.н., профессор, зав. кафедрой биологии и биоэкологии ФГБОУ ВПО «УлГУ», г. Ульяновск.
Шифр специальности: 03.02.03 микробиология.



