Введение
Одним из важнейших биохимических механизмов развития эндотоксикоза при онкологических заболеваниях является активация процессов свободнорадикального окисления. Повреждение структуры мембран, на которых локализованы важнейшие ферментные системы, и нарушение их функций в результате активации перекисного окисления липидов (ПОЛ) приводят к тяжелым нарушениям жизнедеятельности клеток, которые, в свою очередь, сопровождаются развитием патологических состояний на уровне целого организма. Окислительная модификация ненасыщенных жирнокислотных остатков мембранных фосфолипидов увеличивает проницаемость гидрофобного бислоя мембраны, что приводит к постепенному уменьшению ионного градиента на поврежденной мембране. В подобных условиях клетке приходится затрачивать повышенное количество АТФ для поддержания необходимого ионного равновесия. Запускается порочный круг нарушения ионного гомеостаза и биоэнергетики, который, если его не разорвать, неумолимо ведет клетку к гибели [2].
В обычных условиях процессы ПОЛ в клетке поддерживаются на низком уровне мощной антиокислительной системой, но в условиях патологического процесса антиоксидантых возможностей клетки оказывается явно недостаточно. В таких условиях обоснованным представляется применение антиоксидантов, в том числе и у пациентов со злокачественными новообразованиями. Учеными нашего университета изучены гепатопротекторное и миелопротекторное действие производных 3-оксипиридина с циклофосфаном,
5-фторурацилом, доказано отсутствие снижения противоопухолевой эффективности цитостатиков и повышение их антиметастатической эффективности при использовании изученных комбинаций на фоне роста некоторых перевиваемых опухолей [4,5,8,9]. Выполненная работа явилась продолжением комплексной программы исследований Мордовского государственного университета «Фармакологическая коррекция повреждений, возникающих при гипоксических, токсических и радиационных воздействиях».
Цель исследования
Изучить влияние комбинации производных 3-оксипиридина (мексидол, эмоксипин) и противоопухолевого препарата этопозид на некоторые показатели эндотоксикоза и роста опухоли, а также на продолжительность жизни мышей с карциномой легких Льюис (LLC).
Материал и методы исследования
Экспериментальная часть работы проводилась в лаборатории экспериментальной фармакологии ФГБОУ ВПО «МГУ им. Н. П. Огарёва». Все исследования выполнены в соответствии с требованиями Хельсинской декларации, правилами GCP, одобрены локальным этическим комитетом ФГБОУ ВПО «МГУ им. Н. П. Огарёва» (протоколы №21 от 24.10.2007, №54 от 02.09.2011). В работе исследованы следующие препараты: этопозид амп. 100 мг/5 мл (Ластет, «Ниппон Кайяку», Япония) 6,5 мг/кг в/м через 1 день, 5 раз со 2-х суток после перевивки опухоли; эмоксипин амп. 1%-1мл (Московский эндокринный завод) 17 мг/кг в/м ежедневно с 21 по 35 сутки; мексидол 5% - 2мл, р-р д/инъекц. (ООО «Фармасофт») 33 мг/кг в/м ежедневно с 21 по 35 сутки. Контрольную группу составили 20 мышей, получающих 0,9% р-р NaCl - 0,5 мл в/м с 21 по 35 сутки. Для моделирования опухолевого роста использован перевиваемый опухолевый штамм – карцинома легких Льюис (опухолевый банк НИИ Экспериментальной диагностики и терапии опухолей ГУ РОНЦ им. Н.Н. Блохина РАМН). Перевивка LLC осуществлялась в лаборатории ГУ РОНЦ им. Н.Н. Блохина РАМН половозрелым мышам самкам линий BDF1 путем подкожной инъекции 7´106 опухолевых клеток в 0,2 мл среды 199. Эксперименты были проведены на 116 мышах-самках линии BDF1. Животные содержались в стандартных условиях вивария с постоянным доступом к питьевой воде и брикетированному корму. Животных всех опытных серий забивали путем декапитации под эфирным наркозом на 15 сутки после перевивки опухоли.
В эксперименте выраженность эндотоксикоза оценивали по содержанию молекул средней массы в плазме крови – D254 и D280 (Габриэлян Н.И., 1981); по величине индекса токсичности (ИТ=ОКА/ЭКА–1), характеризующего накопление токсических продуктов в плазме и резерву связывания альбумина (РСА=ЭКА/ОКА), отражающего свободную от токсинов часть молекулы альбумина, измерения общей (ОКА) и эффективной (ЭКА) концентраций альбумина производили на флюориметре «Зонд-3» [3]; по критериям интоксикации (КИ), отражающим дисбаланс между накоплением и связыванием токсинов в плазме крови: КИ1=(D254/ЭКА)×1000; КИ2=(D280/ЭКА)×1000; по индексу лейкоцитарной интоксикации (ИЛИ), рассчитываемому по формуле, предложенной Кальф-Калифом Я.Я. в 1941 г. Гематологические методы исследования включали определение содержания гемоглобина в крови, СОЭ, количества лейкоцитов, тромбоцитов. Для подсчета лейкоцитарной формулы мазки крови окрашивали по методу Романовского-Гимза, клеточный состав просчитывали с использованием бинокулярного микроскопа.
Кроме того, в плазме крови, эритроцитах, гомогенатах печени, почек, ткани сердца, легких и кишечника, а также ткани опухоли определяли содержание малонового диальдегида по методу С. Г. Конюховой [6] при спонтанном (МДА) и индуцированном железом окислении (FeМДА). Оценивалась активность ферментов антиокислительной защиты – каталазы по методу М. А. Королюк с соавт. [7], активность супероксиддисмутазы [10]. Антиокислительная активность (АОА), рассчитывалась как FeМДА–МДА [1]. Рассчитывали резерв липидов для перекисного окисления по формуле [РЛПО=(FeМДА–МДА)/МДА] (Кузьменко Д. И., Лаптев Б. И., 1999). Для оценки изменений в метаболическом звене гомеостаза определяли уровень креатинина по цветной реакции Яффе, мочевины по диацетилмоноксимному методу, активность аланиновой (АлТ) и аспарагиновой (АсТ) трансаминаз методом Райтмана-Френкеля (1980), содержание глюкозы – глюкооксидазным методом по окислению О-толуидина (Меньшиков В.В., 1987), содержание общего белка и альбуминов. В плазме крови определяли некоторые показатели электролитного состава: содержание хлора (Cl), магния (Mg), калия (К), натрия (Na).
По завершении эксперимента оценивали массу животных опухоленосителей, массу опухоли и печени, индекс массы опухоли (ИМО) и печени (ИМП), рассчитанных как отношение массы этих тканей к массе животного и выраженных в процентах. Противоопухолевый эффект оценивали по индексу торможения роста опухоли
ИТРО=(Mк–Мо)/Мк×100, где Мк и Мо – средняя масса опухоли соответственно в контрольной и опытных группах.
Результаты исследований обрабатывали методами вариационной статистики с использованием программ Microsoft Office Excel, Primer of Biostatistics for Windows. Вычисляли среднюю арифметическую выборочную (М), ошибку средней арифметической (m) и стандартное отклонение. Значимость отличий средних величин выборок при нормальном распределении оценивали с помощью параметрического t-критерия Стьюдента, а при распределении признака, отличного от нормального, и при малых выборках – непараметрический критерий Манна-Уитни (Mann-Whitney U-test). При сравнении долей, выраженных в процентах, применялся критерий согласия χ2 Пирсона. Различия средних величин признавались значимыми при уровне значимости р<0,05. Полученные данные представлены в виде M±m, р.
Результаты исследования и их обсуждение
Комбинированное применение эмоксипина с этопозидом позволило увеличить продолжительность жизни мышей линии ВDF1 при росте карциномы Льюис LLC на 63%, а мексидола на 83%, по сравнению с показателями контрольной группы (рис. 1).
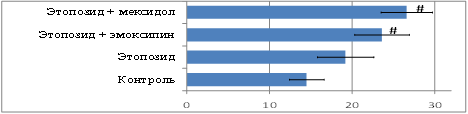
Рис. 1. Влияние комбинированного применения этопозида, эмоксипина и мексидола на продолжительность жизни мышей линии ВDF1 с карциномой легких Льюис, в сутках (# - достоверность различия р<0,05 с данными контрольной группы).
Применение этопозида в изученной дозе позволило снизить массу первичного опухолевого узла карциномы Льюис на 32%, но также снижалась собственная масса животных на 13%. Комбинация этопозида и эмоксипина не оказала достоверного влияния по сравнению с монотерапией этопозидом на массу опухоли, но за счет роста собственной массы тела животных ИМО снижалась на 31% от показателей контроля. А применение комбинации мексидола и этопозида привело к увеличению ИТРО на 86% по сравнению с показателями монотерапии этопозидом (рис. 2).
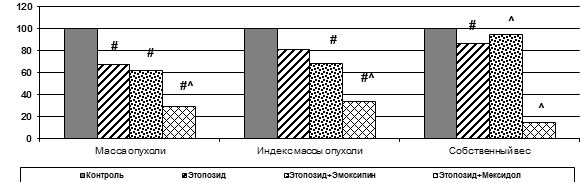
Рис. 2. Влияние этопозида, эмоксипина и мексидола на некоторые показатели роста LLC в эксперименте, в % к данным контрольной группы (# - достоверность различия p<0,05 к показателям контрольной группы; ^ – к данным на фоне введения этопозида в виде монотерапии).
Введение этопозида в изученной дозе снижало количество митозов в ткани опухоли на 27% по сравнению с контрольной группой. Комбинированное применение этопозида и эмоксипина еще на 37%, а этопозида и мексидола – на 56% по сравнению с данными группы, получающей только этопозид.
В условиях экспериментальной неоплазии и введения цитостатического препарата наблюдались увеличение показателей цитолитического синдрома, рост содержания общего белка, альбуминов, изменения некоторых показателей электролитного состава сыворотки крови мышей линии BDF1 – снижалось содержание хлора на 13% (р<0,05), магния – на 38% (р<0,05), калия – на 26% (р<0,01), развивалась гипернатриемия (р<0,05). При введении этопозида наблюдалось дальнейшее увеличение активности трансаминаз и рост мочевины, а также снижение содержания креатинина, общего белка и глюкозы, но этопозид купировал гипохлоремию и снижал уровень натрия (р<0,05) на фоне роста карциномы Льюис. На фоне комбинированного применения этопозида и эмоксипина, по сравнению с монотерапией этопозидом, снижалась активность АЛТ – на 74%, АСТ – на 58%, наблюдался рост креатинина, нормализация содержания общего белка и глюкозы, восстанавливалось содержание натрия. Комбинированное применение этопозида и мексидола привело к восстановлению всех изученных показателей электролитного обмена до уровня данных интактной группы, а также снижению активности АЛТ на 69%, АСТ - на 44%, содержания альбуминов на 23%, увеличению содержания креатинина на 51%, общего белка – на 10%, глюкозы – на 42% (рис. 3).
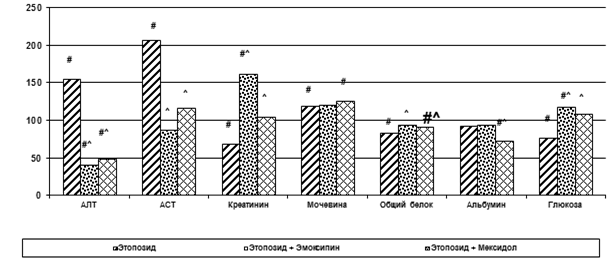
Рис. 3. Влияние комбинированного применения этопозида, эмоксипина и мексидола на некоторые биохимические показатели сыворотки крови на фоне роста карциномы Льюис, % к показателям контрольной группы (# – достоверность различия p<0,05 с показателями контрольной группы; ^ – с данными серии с введением этопозида)
Дополнительное применение производных 3-оксипиридина оказало влияние на некоторые показатели процессов перекисного окисления липидов и антиоксидантной защиты ткани опухоли. На фоне введения этопозида в ткани карциномы Льюис содержание МДА увеличивалось на 72%. При комбинации этопозида и эмоксипина показатель снижался по сравнению с введением только этопозида на 30%, а этопозида с мексидолом – на 38% (р<0,001) по сравнению с данными группы монотерапии этопозидом, но к тому же снижались АОА и РЛПО.
Некоторые изменения изученных показателей ПОЛ наблюдались и в тканях внутренних органов. Так, на фоне роста карциномы Льюис регистрировался рост содержания МДА в легких (на 38%), рост АОА на 32% в печени, на 20% в миокарде, снижение РЛПО в легких на 36%, рост активности каталазы на 77-79% и угнетение активности СОД на 12%-14% в изученных средах по сравнению с показателями интактной группы (р<0,05).
По сравнению с данными контроля, введение этопозида в изученной дозе привело к росту содержания МДА в ткани печени на 30%, росту активности СОД в печени и легких, снижению активности каталазы в миокарде на 23%, в легких – на 27%, снижению РЛПО в печени и росту показателя в тканях легких на 30%, снижению АОА на 23% и 20% в печени и миокарде.
Комбинированное применение этопозида и эмоксипина на фоне роста карциномы Льюис, по сравнению с монотерапией этопозидом, привело к росту содержания МДА в миокарде на 21%, в легких – на 22%, росту активности каталазы в миокарде на 19% и в легких – на 16%; к снижению РЛПО в миокарде на 49%, в легких на 40%, к снижению АОА в тканях печени на 13%, в миокарде – на 33%, в легких – на 20%.
При комбинации этопозида с мексидолом наблюдалось снижение АОА в печени на 32%, в миокарде и легких – на 22%; снижение РЛПО в печени на 34%, в миокарде – на 44%, в легких – на 34%; снижение активности каталазы в печени на 17%. При использовании обеих комбинаций в легких предотвращалось угнетение активности СОД – показатель сохранялся на уровне интактных животных.
Комбинация этопозида с производными 3-оксипиридина позволила в значительной степени ограничить изменения клеточного состава периферической крови, развивающиеся на фоне курсового введения цитостатиков. На фоне роста карциномы Льюис в контрольной группе по сравнению с интактными животными наблюдалось увеличение количества лейкоцитов на 49% (с 10,7±0,8 ×109 до 15,9±1,0 ×109, р<0,05), тромбоцитов на 69% (281,2±31,6 ×109 до 474,0±48,0 ×109, р<0,05), эритроцитов на 18% (р<0,05). Введение этопозида привело к развитию лейкопении (до 4,97±0,71 ×109, р<0,05) (рис. 4).
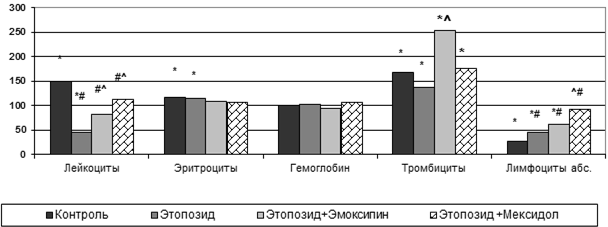
Рис. 4. Влияние комбинированного введения этопозида, эмоксипина и мексидола на некоторые показатели периферической крови мышей линии BDF1 при росте карциномы Льюис, % к данным интактных животных (* – достоверность различия р<0,05 к данным интактной группы; # – к показателям контрольной группы; ^ – к данным на фоне введения этопозида в виде монотерапии)
На фоне комбинации этопозида и эмоксипина в изученных дозах наблюдался рост содержания лейкоцитов на 80% (до 8,93±0,75 ×109 ) по сравнению с показателями на фоне введения этопозида в виде монотерапии (р<0,001). Наблюдался рост содержания тромбоцитов на 88% (р<0,05). Комбинация этопозида с мексидолом по сравнению с введением этопозида также способствовала росту количества лейкоцитов в 2,4 раза (12,07±0,84 ×109, р<0,001), достигнув уровня интакных животных. Содержание эритроцитов и уровень гемоглобина не менялись (р>0,05), содержание тромбоцитов повышалось на 28% (493,5±26,3 ×109, р<0,05).
Выводы
Таким образом, дополнительное применение производных 3-оксипиридина на фоне введения этопозида в условиях роста карциномы Льюис в эксперименте позволяет оптимизировать противоопухолевое действие этопозида и оказывает определенное корригирующее влияние на метаболические показатели и клеточный состав периферической крови.
Комбинация эмоксипина или мексидола с этопозидом при карциноме Льюис увеличивает продолжительность жизни мышей линии BDF1 в отличие от цитостатика, вводимого в изученной дозе в виде монотерапии. Комбинация этопозида с производными
3-оксипиридина повышает его противоопухолевый эффект на фоне роста карциномы (мексидол) и снижает содержание малонового диальдегида, активность супероксиддисмутазы и количество митозов в ткани опухоли. Комбинация эмоксипина с этопозидом ограничивает лейкопению и повышает количество тромбоцитов при росте карциномы, не оказывает влияния на электролитный обмен, способствует ограничению цитолиза по сравнению с монотерапией этопозидом. Комбинация этопозида и мексидола предотвращает развития лейкопении и увеличивает количество тромбоцитов (при росте карциномы), а также способствует восстановлению показателей электролитного обмена, снижает активность трансаминаз, нормализует содержание креатинина, глюкозы и ограничивает рост альбумина по сравнению с монотерапией этопозидом в изученных дозах.
Рецензенты:
Инчина Вера Ивановна, доктор медицинских наук, профессор, заведующая кафедрой фармакологии с курсом клинической фармакологии Медицинского института ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», г.Саранск.
Балыкова Лариса Александровна, доктор медицинских наук, профессор, заведующая кафедрой педиатрии Медицинского института ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», г.Саранск.



