Введение
В настоящее время онкологические заболевания в России занимают одно из ведущих мест в списке причин смертности населения. Для того чтобы изменить данную ситуацию, необходимо разрабатывать новые методы ранней диагностики и эффективной терапии онкологических заболеваний. Чтобы достичь требуемого результата, необходимо знать механизмы процессов, которые сопровождают рост злокачественных новообразований в организме. С этой целью используются различные модельные системы, позволяющие изучить данные заболевания с различных сторон.
Удобной для исследования оказалась асцитная гепатома Зайделя, трансплантированная в брюшную полость крыс линии Вистар. Ранние исследования [1,2] на этой модели показали значительную роль врождённого иммунитета и, в частности, систем генерации активных метаболитов кислорода (АФК) в патогенезе данной опухоли. Однако помимо АФК в гуморальный ответ фагоцитирующих клеток в качестве оружия неспецифического иммунитета входит также и система генерации оксида азота (NO). На разных этапах роста опухолей АФК и NO вырабатываются разными клетками (макрофагами, нейтрофилами, миелоидными супрессирующими клетками и др.) для разных целей (внутриклеточная сигнализация, регуляторная модификация функциональных белков, индукция апоптоза). Различными исследованиями была показана роль NO в индукции генотоксического повреждения, в продвижении опухоли и прогрессии ее роста от посреднических важных процессов, в том числе ангиогенеза и инвазии [3, 4, 5,7]. Высокие уровни NO обладают сильной генотоксичностью через образование канцерогенных нитрозаминов или путём повреждения систем репарации ДНК [6]. Однако NO также способен и уменьшать воздействие активных форм кислорода на ДНК [8]. При этом оксид азота является важным компонентом иммунной реакции организма на рост некоторых типов опухолей, например, защищает от рака толстой кишки у мышей [9]. В связи с этим изучение изменения количественного и качественного состава продуцируемых в организме различных метаболитов NO как в зоне роста опухоли, так и в крови является актуальной задачей для понимания роли врождённого иммунитета в процессе роста и патогенеза злокачественных новообразований.
Материалы и методы исследования
В работе использовали крыс-самцов линии Вистар массой 200–220 г. Крыс содержали в условиях вивария на стандартном рационе при свободном доступе к воде и пище, при 16–20 °С в режиме естественной освещенности. Для формирования экспериментальной опухоли использовали клетки асцитной гепатомы Зайделя, отбираемой у крыс опухоленосителей на 5-е сутки развития опухоли. Трансплантацию клеток асцитной гепатомы Зайделя проводили в брюшную полость животного в объеме 0.8 мл (107 кл./мл). Исследования метаболитов NO проводились в плазме крови и асцитной жидкости. Форменные элементы удалялись центрифугированием при 400g в течение 10 мин. До проведения непосредственно измерений образцы плазмы и асцита хранили при температуре -27 °С.
Концентрацию нитритов/нитратов измеряли спектрофотометрическим методом. Для этого содержащиеся в асцитной жидкости белки осаждали раствором сульфата цинка и депротонизировали 1М раствором гидроксида натрия. Затем образовавшийся осадок, содержащий белки и гидроксид цинка, удаляли центрифугированием. К супернатанту добавляли небольшое количество стружек кадмия и помещали на мешалку на 3 часа для проведения реакции восстановления нитратов, затем кадмий удаляли центрифугированием. Количество нитритов в супернатантах измеряли с использованием реактива Грисса, содержащего смесь 0,1 %-ого раствора N-1-нафтилэтилендиамин дигидрохлорида в 2,5 % фосфорной кислоте и 1 %-ого раствора сульфаниламида в 2,5 %-ной фосфорной кислоте, в соотношении 1:1. К 150 мкл супернатанта, перенесенного в лунку в 96-луночного плоскодонного планшета, добавляли 100 мкл свежеприготовленного реактива Грисса и следили за развитием цветной реакции в течение 40 мин при комнатной температуре. Затем измеряли оптическую плотность при длине волны – 546 нм. Калибровку проводили относительно стандартных растворов NaNO2.
Концентрацию S-нитрозотиолов определяли с помощью метода, основанного на спектрофотометрическом измерении нитрита, образующегося при разрушении S- нитрозотиолов в присутствии Hg2+. Выделяемый NO2– определяется с помощью реактива Грисса при 546 нм. Для этого к 150 мкл исследуемого образца, перенесенного в 96-луночный плоскодонный планшет, добавляли 50 мкл свежеприготовленного 0,2 % HgCl2 в 1 % растворе сульфаниламида и 50 мкл 0,2 % раствора N-1-нафтилэтилендиамина. В течение 40 мин следили за развитием цветной реакции при комнатной температуре. Для исследуемого образца также определяли концентрацию нитритов (150 мкл исследуемого образца, 50 мкл 1 % раствора сульфаниламида и 50 мкл 0,2 % раствора N-1-нафтил-этилендиамина). Затем измеряли оптическую плотность обоих образцов при длине волны – 546 нм. Калибровочная кривая была построена с использованием стандартных растворов нитрита натрия NaNO2. Концентрацию нитрозотиолов определяли как разность концентраций нитритов в образцах, обработанных и необработанных HgCl2.
Концентрацию нитротирозина определяли иммуноферментным методом с помощью набора фирмы «HBT» (Нидерланды).
Результаты исследования и их обсуждение
Невозможность проведения экспериментов на человеке делает актуальными вопросы моделирования злокачественных опухолей на лабораторных животных. Широкий спектр применяемых моделей онкогенеза позволяет изучить данные заболевания с различных сторон, выявить общие закономерности для человека и животных и создать теоретическое обоснование для разработки методов терапии опухолей [Попова Н. А., 2000]. Наиболее часто используемыми моделями являются перевиваемые опухоли. Наиболее широкое распространение среди различных модификаций трансплантации новообразований получила прививка опухолей в брюшную полость животных с последующим получением так называемых асцитных новообразований, т. е. опухолей, растущих в брюшной полости животных в виде размножающихся клеток в накапливающейся перитонеальной жидкости. Такой тип модели опухолевого роста был использован в данном исследовании, а именно асцитная гепатома Зайделя.
Первостепенной задачей при исследовании опухолевого процесса при развитии асцитной гепатомы Зайделя являлось изучение динамики роста опухолевых клеток и изменение объема асцитной жидкости.
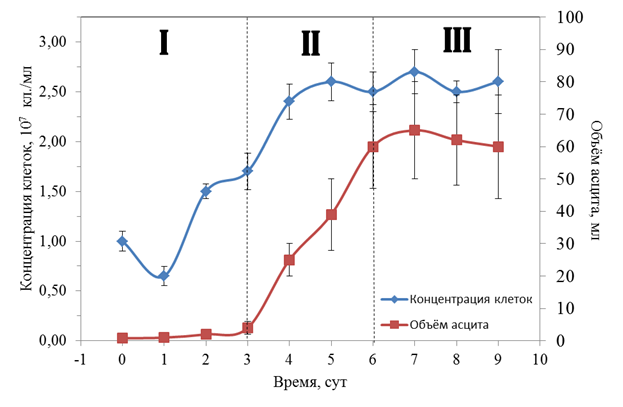
Рис. 1. Изменение объема асцитной жидкости и концентрации опухолевых клеток в процессе развития опухоли. (n=10). Римскими цифрами отмечены фазы развития гепатомы Зайделя: I –начальная фаза; II – фаза экспоненциального роста; III – терминальная фаза. 0 сутки – здоровое животное
На рис.1. представлена динамика изменения концентрации опухолевых клеток (синяя кривая) в асците в процессе роста опухоли. Зависимость имеет обычный вид кривой с насыщением с максимальной скоростью в интервале 1–4 суток после трансплантации. Процесс возрастания числа опухолевых клеток сопровождается увеличением объема асцитной жидкости, который может достигать 60–70 мл (рис.1, красная кривая). При этом объём крови/плазмы и масса опухоленосителя в течение эксперимента значительно не изменяются.
Анализируя график динамики изменения объёма асцита и концентрации опухолевых клеток (рис. 1), можно выделить три фазы. Первая фаза – (I) латентная (1–3 сут), в течение которой не происходит заметного роста объёма асцита. Вторая фаза – (II) фаза линейного роста объёма асцита (3–6 сут) и, наконец, третья фаза – (III) характеризуется замедлением роста объёма асцита (6–9 сут). В первом приближении итоговую, нелинейную кривую изменения объёма асцита можно разбить на три квазилинейных участка – I, II и III, в пределах которых скорость роста асцита имеет постоянную величину. При этом рост концентрации опухолевых клеток опережает динамику объёма асцитной жидкости примерно на сутки (рис. 1). В дальнейшем метаболиты оксида азота изучались на середине каждой стадии роста.
Исследования динамики метаболитов оксида азота в плазме крови и асцитной жидкости проводили в пробах, отобранных у декапитированных животных на разных фазах опухолевого роста – на 3-и сутки после трансплантации опухоли для первой фазы, на 5 сутки – для второй фазы и на 8 сутки – для третьей фазы. В качестве контроля использовалось здоровое животное.
Установлено, что начальная стадия роста опухоли сопровождается повышением уровня NO-модифицированных белков в крови опухоленосителя, а именно S-нитрозотиолов (RS-NO) с 6,5 µМ до 11 µМ и особенно нитротирозина (Tyr-NO2 – маркера пероксинитрита) с 4 nM до 12 nM (рис. 2). Такой прирост пероксинитрита и нитрозотиолов, по-видимому, связан с воспалительной реакцией в ответ на трансплантацию опухоли и обусловлен не столько увеличением синтеза NO в кровяном русле, сколько созданием более благоприятных условий для реакции нитрования и нитрозилирования белков. Данные условия могут сформироваться при условии увеличения концентрации АФК, что и происходит за счёт активации клеток неспецифического иммунитета, в частности, полиморфноядерных лейкоцитов.
Во II фазе развития гепатомы Зайделя в спектре метаболитов NO в крови начинают преобладать S-нитрозотиолы. Их концентрация увеличивается в 2–2,5 раза, достигая максимального значения в 12,5 µМ. В этот же период концентрация нитротирозина (Tyr-NO2) и нитратов/нитритов (NOx) незначительно отличается от уровня здорового животного (рис. 2).
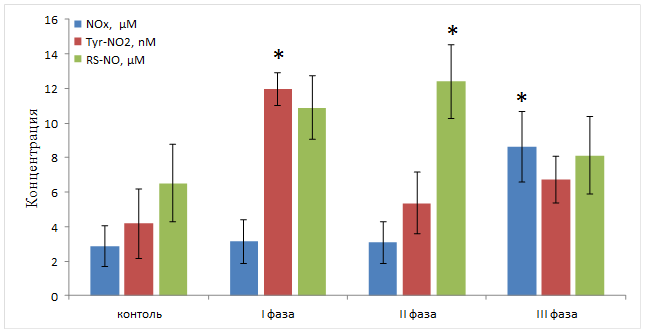
Рис. 2. Изменения спектра основных внеклеточных метаболитов оксида азота в плазме крови в зависимости от фазы оухолевого роста (n=7). * – P <0,05 отноcительно здорового животного
Терминальная стадия опухоли (III фаза) характеризуется падением концентрации NO-модифицированных белков. Однако наблюдается заметное увеличение доли низкомолекулярных метаболитов (NOx), что может быть связано с расходованием мишеней взаимодействия NO с белками, в том числе за счет значительного их окисления вследствие развития окислительного стресса. NO преимущественно метаболизируется в NO2- и NO3-. NOx также могут поступать из иного источника.
Зона роста опухоли для гепатомы Зайделя характеризуется составом асцитной жидкости, которая является производной от процессов, протекающих как в плазме крови, так и непосредственно в зоне патологии. Состав асцита также зависит от скорости обмена между компонентами плазмы и асцита, которая зависит от природы и свойств диффундирующих веществ.
Нами установлено, что концентрации низкомолецулярных метаболитов NO в асцитной жидкости (NOx) на первых двух фазах развитя опухоли (рис. 3) превышают таковые в крови примерно на 4 µМ. Однако на терминальной (III фазе) роста опухоли эти значения сравниваются. Так как начальные стадии характеризуются премущественно накоплением обьёма асцитной жидкости, а на III фазе наблюдается стационарное состояние, то вероятно, что в конце роста опухоли развивается равновестное состояние, при котором низкомолекулярные соединения, в частности NOx, могут равномерно распределятся между плазмой и асцитом. Данный процес приводит к наблюдаемому выравниванию концентрации NOx в крови и асците на заключительной, III фазе. Более высокий уровень NOx на первых двух фазах может быть обусловлен как работой иммунной системы, в частности, макрофагов, так и сниженной скоростью утилизации веществ из асцита ввиду тока жидкости, направленного в сторону брюшной полости.
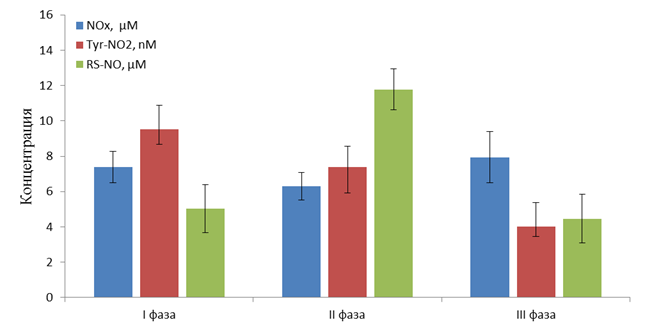
Рис. 3. Изменения спектра основных внеклеточных метаболтов оксида азота в асцитной жидкости в зависимости от фазы оухолевого роста (n=7)
В зоне роста опухоли (рис. 3) наблюдается постепенное снижение концентрации нитротирозина (Tyr-NO2) от 9–10 пМ до 3–4,4 пМ. Максимальная концентрация S-нитрозотиолов в 11,5 µМ отмечена во II фазе роста опухоли, что коррелирует с результатами по нитрозотиолам в плазме крови в этот период. Учитывая то, что скорость роста объёма асцита и, следовательно, транспорт веществ из крови в брюшную плолость максимален именно во второй фазе опухолевого роста, то можно заключить, что основным источником NO-модифицированных белков в асцитной жидкости является кровь, где имеется значительный источник NO в виде эндотелиальных клеток и созданы условия для протекания процесов нитрования и нитрозилирования белков.
Таким образом, оценивая уровень метаболитов NO в ходе развития асцитной опухоли в организме животного, можно заключить, что в плазме крови развивается нитрозилирующий стресс. Причём его проявления в ходе роста опухоли различны. Так, на начальных этапах опухоли в плазме наблюдается значительное накопление продуктов модиффикации белков, причём первая фаза характеризуется преимущественно накоплением нитротирозина, а вторая – S-нитрозотиолов. Терминальная стадия выделяется увеличением концентации нитритов/нитратов. Модифицированные белки с током жидкости затем транспортируются в зону роста опухоли – в асцитную жидкость.
Работа выполнена при поддержке ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009 – 2013годы, соглашение 14.B37.21.1120.
Рецензенты:
Новоселова Елена Григорьевна, доктор биологических наук, профессор, ведущий научный сотрудник лаборатории механизмов рецепции ФГБУН Института биофизики клетки РАН, г. Пущино.
Асланиди Константин Борисович, доктор физико-математических наук, ведущий научный сотрудник лаборатории биофизики внутриклеточной регуляции ФГБУН Института теоретической и экспериментальной биофизики РАН, г.Пущино.



