Введение
Для повышения урожайности в сельском хозяйстве часто используются разно-образные инсектициды, обладающие высокой токсичностью и избирательным действием, значительная часть которых попадает в продукты растениеводства и животноводства. Для обеспечения безопасности населения необходимо контролировать остаточные микроколичества инсектицидов в продуктах питания, почве, воде. Одним из наиболее часто используемых инсектицидов в агропромышленности является карбофос – высокотоксичный фосфорорганический пестицид, хорошо проникающий через кожу.
Одним из свойств токсического действия карбофоса является способность угнетать действие фермента ацетилхолинэстеразы. Это приводит к накоплению ацетилхолина, который парализует проведение нервных импульсов в холинергических синапсах центральной нервной системы, соматических нервных волокнах, синапсах двигательных нейронов, парасимпатических и некоторых симпатических нервных окончаниях. Таким образом, карбофос является ядом с действием, направленным на центральную и вегетативную нервные системы.
На сегодняшний день важным направлением в аналитической химии является создание тест-систем, направленных на контроль окружающей среды. При этом важными параметрами таких систем являются простота и удобство в применении, высокая чувствительность и надежность. Одним из перспективных методов анализа является ферментативный, с использованием иммобилизованных ферментов, что обусловлено высокой чувствительностью, селективностью и мягкими условиями проведения анализа.
В работе Стойковой Е. Е. изучен процесс стабилизации препаратов ферментов бутирил-холинэстеразы, микробиальной карбоксилэстеразы и щелочной фосфатазы путем включения в водорастворимые полимерные пленки на основе η-фталилхитазана, β-декстрана и полиглюкина, с целью получения биосенсоров для анализа фосфорорганических инсектицидов, ионов тяжелых металлов, α-аминофосфонатов и гидразониевых солей диакилдитиофосфатов в различных экспериментальных условиях. При таком типе иммобилизации ферментативная активность остается практически постоянной в течение полугода при использовании полиглюкина и декстрана и более года для фталилхитозана [4].
Ковалев Г. Н., Яновский Ю. Г., Карнет Ю. Н., Снегирева Н. С. также провели исследования по использованию в качестве носителей пористых пленок из нитрата целлюлозы для создания биосенсоров на основе композиционных материалов [3].
Ильичева Н. Ю. и др. в своей работе изложили технологию получения биосенсора на основе бутирилхолинэстеразы, иммобилизованной в нитратцеллюлозную мембрану [2].
На сегодняшний день актуальной задачей является иммобилизация ферментов в композиционные материалы на основе природных полимеров и разработка на их основе биосенсорных тест-систем для биохимического определения токсикантов в объектах внешней среды.
Цель исследования: иммобилизация фермента ацетилхолинэстеразы в структуру композиционного материала с целью разработки биосенсорной тест-системы для обнаружения остаточных количеств карбофоса в объектах внешней среды.
Материалы и методы исследования
В работе использовали фермент ацетилхолинэстеразу (ацетилхолин-ацетилгидролазу КФ 3.1.1.7). Анализ определения фосфорорганических пестицидов основан на количественном определении уксусной кислоты (УК), образующейся изацетилхолинхлорида в ферментативной реакции, катализируемой ацетилхолинэстеразой, с ингибированием карбофосом. Уксусная кислота сдвигает pH инкубационной смеси в кислую область, что выявляется с помощью индикатора и количественно определяется колориметрическим методом.
Для анализа активности растворимого и иммобилизованного фермента ацетилхолинэстеразы была доработана методика с использованием в качестве субстрата ацетилхолин хлорида [5]. Суть методики состоит в следующем: к 0,1 мл раствора фермента ацетилхолинэстеразы (15 мг в 10 мл дистиллированной воды) добавляли 2 мл буферного раствора (рН 8,4) и термостатировали 30 минут при 37 ℃. Параллельно термостатировали 2 %-ый водный раствор ацетилхолин хлорида, используемого в качестве субстрата. Для постановки ферментативной реакции к анализируемому раствору ацетилхолинэстеразы добавляли 0,5 мл 2 %-ого водного раствора ацетилхолин хлорида, смесь инкубировали в течение 30 минут при температуре 37 ℃. Ферментативную реакцию останавливали, добавляя по 0,2 мл 1%-ого водного раствора карбофоса. В качестве опытной пробы использовали смесь, в состав которой ингибитор вносили перед термостатированием. По окончании реакции в каждую пробу вносили по 2,1 мл дистиллированной воды и по 0,3 мл индикатора фенолового красного (0,02 %-ый водный раствор). Выделившееся количество уксусной кислоты оценивали по малиновой окраске на ФЭК–КФК-2 при длине волны 540 нм в кювете с толщиной слоя 10 мм. Количество выделившейся кислоты определяли по разности экстинкции контрольной и опытной пробы с учетом калибровочной кривой в координатах оптическая плотность / количество кислоты (мг).
Активность рассчитывали по формуле:
![]() , мг УК/г фермента , (1)
, мг УК/г фермента , (1)
где mУК – масса уксусной кислоты, мг;
mфермента – масса фермента, мг; 1000 – единица перевода мг в г.
Композиционные материалы формовали методом свободного растекания на гладкую стеклянную поверхность желаемой формы толщиной 2–3 мм с испарением растворителя в течение 36–48 часов при температуре 20–24 ℃. Способ получения композиций изложен в работе Андрусенко С. Ф. и др. [1].
Для иммобилизации ацетилхолинэстеразы в структуру композиционного материала использовали 0,15 %-ый водный раствор фермента. Фермент вводили в раствор компонентов, входящих в состав композиции, в объеме 0,1 мл.
Результаты исследования и их обсуждение
Для построения биосенсорных тест-систем необходимо учесть все факторы, влияющие на активность фермента. Для объективного анализа влияния рН, температуры, времени ферментативной реакции, времени ингибирования, соотношения количества фермента, количества субстрата на ферментативную активность использовали 2 %-ый раствор карбофоса, при этом фермент ацетилхолинэстераза сохраняет 21 % удельной активности.
Исследуемые пробы для фермента, иммобилизованного в композиционные материалы, имели состав: 1 мл раствора композиции (0,049 г пленки содержащей 0,6 мг фермента, растворяли в 4 мл дистиллированной воды); 1 мл буферного раствора с рН=8,4; 1,4 мл дистиллированной воды. Полученные образцы термостатировали 30 минут при 37 ℃. В контрольную пробу ингибитор добавляли после термостатирования. Пробы колориметрировали на ФЭК-КФК-2 с зеленым светофильтром при длине волны 540 нм в кюветах с толщиной слоя 10 мм. Полученные данные представлены в таблице 1.
Таблица 1. Оптимизация факторов и анализ активности растворимого и иммобилизованного фермента ацетилхолинэстеразы
|
Наименование показателя |
Фермент, иммобилизованный в композиционный материал |
Фермент без носителя |
|
Удельная активность, ммоль уксусной кислоты/г фермента |
43,1 |
44,7 |
|
Сохранение удельной активности при иммобилизации, % |
95-98 |
100 |
|
Сохранение активности во времени (через 3 месяца), % |
75 |
8,4 |
|
рН |
8,4 |
8,4 |
|
Температура, ℃ |
37 |
37 |
|
Время анализа, мин |
60 |
60 |
Были проведены исследования по выявлению оптимального содержания фермента в составе тест-системы в присутствии и отсутствии ингибитора. С этой целью были использованы иммобилизованный фермент ацетилхолинэстераза в количествах 0,01; 0,05; 0,10; 0,15; 0,20; 0,25 и 0,30 мг. Полученные данные свидетельствуют о том, что количество фермента 0,2 мг соответствует оптимуму разности удельной активности ацетилхолинэстеразы без ингибирования и с ингибированием при определении карбофоса (рисунок 1).
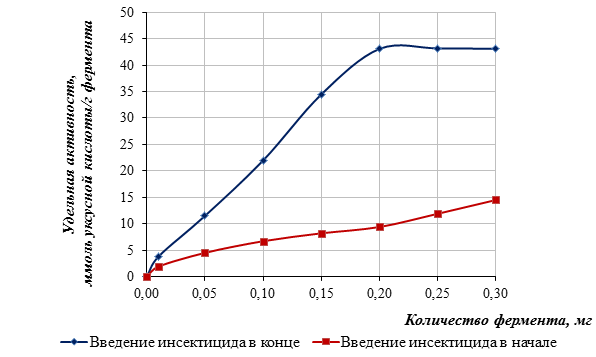
Рисунок 1. Влияние количества фермента на удельную активность иммобилизованного фермента ацетилхолинэстеразы
Апробацию разработанных биосенсорных тест-систем проводили на модельных системах, которые представляли собой почву с внесенными количествами карбофоса: 0,76×10-3 ммоль; 3,8×10-3 ммоль; 8,5×10-3 ммоль; 15×10-3 ммоль; 30×10-3 ммоль; 45×10-3 ммоль.
Анализ проводили в следующей последовательности. Образцы почвы массой 5 г, предварительно обработанные раствором карбофоса, помещали в коническую колбу V=250 мл и заливали 20 мл дистиллированной воды. Колбу с суспензией встряхивали на аппарате для встряхивания с частотой 50 Гц в течение 60 минут. После декантации отбирали аликвоту (V = 2,6 мл) для анализа. В каждую исследуемую аликвоту помещали тест-систему, содержащую фермент в количестве 0,2 мг и индикатор в количестве 0,02 мг (масса композиции 37 мг). Далее смесь термостатировали 30 минут при 37 ℃. После термостатирования прибавляли 2 %-ый раствор субстрата в объеме 0,5 мл, 2 мл буферного раствора (рН = 8,4), смесь снова термостатировали 30 минут при 37 ℃. По истечении времени фиксировали изменение окраски исследуемого раствора на ФЭК-КФК-2.
Полученные данные представлены на рисунках 2, 3.
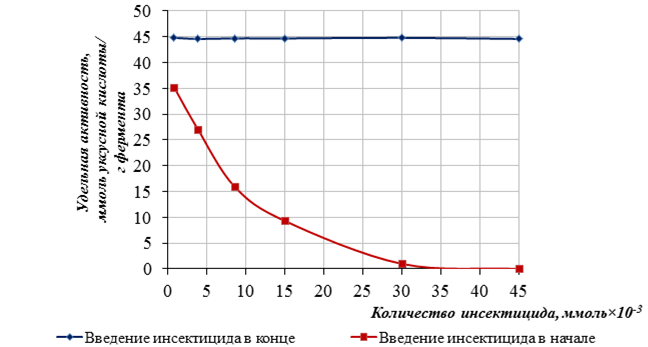
Рисунок 2. Влияние количества карбофоса на растворимый фермент ацетилхолинэстераза
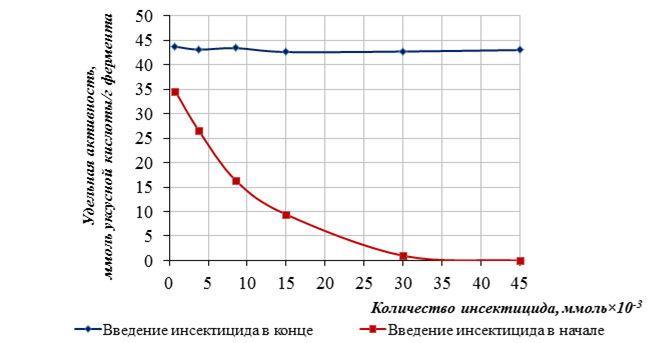
Рисунок 3. Влияние количества карбофоса на иммобилизованный фермент ацетилхолинэстераза
Из полученных данных видно, что при иммобилизации фермент ацетилхолинэстераза сохраняет 95–98 % удельной активности. Количество карбофоса равное 0,76×10-3 ммоль снижает удельную активность растворимого и иммобилизованного фермента ацетилхолинэстеразы на 21,4 %- и 20,8% соответственно. Дальнейшее увеличение количества инсектицида с 0,76×10-3 до 45×10-3 ммоль полностью угнетает действие фермента. Таким образом, чувствительность определения концентрации инсектицида карбофоса лежит в диапазоне от 0,76×10-3 до 45,0×10-3ммоль для разработанной тест-системы следующего состава: композиционный материал (m = 37 мг), содержащий фермент ацетилхолинэстеразу (m = 0,2 мг) и индикатор феноловый красный (m = 0,02 мг) в исследуемой пробе V = 2,6 мл.
Заключение
Процесс построения биосенсорной тест-системы для обнаружения карбофоса предполагал разработку и оптимизацию метода иммобилизации фермента ацетилхолинэстеразы в высокомолекулярные композиционные материалы. Для определения активности растворимого и иммобилизованного фермента был разработан метод, где в качестве субстрата использовали ацетилхолин хлорид. Оптимизированы параметры, при которых разность удельной активности в контрольной и опытной пробах максимальна: количество фермента ацетилхолинэстеразы – 0,2 мг; количество субстрата ацетилхолин хлорида – 0,055 ммоль; рН буферного раствора – 8,4; температура – 37 ℃; время ингибирования – 30 минут; время постановки ферментативной реакции – 30 минут. Сохранение удельной активности иммобилизованного фермента составило 95–98 %.
На основе полученных композиций разработана биосенсорная тест-система для детекции остаточных количеств карбофоса в объектах окружающей среды. Диапазон определяемых концентраций карбофоса составляет от 0,76×10-3 ммоль до 45×10-3 ммоль. Минимальное определяемое количество карбофоса (0,76×10-3 ммоль) снижает удельную активность растворимого и иммобилизованного фермента на 21,4 и 20,8 % соответственно.
Рецензенты:
Орлова Ирина Георгиевна, доктор биологических наук, старший научный сотрудник по специальности, профессор кафедры медицинской биохимии, клинической лабораторной диагностики и фармации ФГАОУ ВПО «Северо-Кавказский федеральный университет», г. Ставрополь.
Лодыгин Алексей Дмитриевич, доктор технических наук, доцент, заведующий кафедрой прикладной биотехнологии ФГАОУ ВПО «Северо-Кавказский федеральный университет», г. Ставрополь.



