Введение. Острый калькулезный холецистит (ОКХ) на сегодняшний день остается одним из наиболее часто встречающихся заболеваний в абдоминальной хирургии и занимает второе по частоте возникновения место в структуре хирургической патологии после острого аппендицита. По данным различных авторов во всем мире заболеваемость населения желчнокаменной болезнью (ЖКБ) составляет около 10–15 %. На сегодняшний день проблема острого холецистита связана с гнойными интраоперационными и послеоперационными осложнениями данного заболевания. По данным авторов, осложнения острого холецистита наблюдаются в среднем у 65–70 % пациентов. Лапароскопическая холецистэктомия (ЛХЭ) является «золотым стандартом» лечения калькулезного холецистита [2, 3]. В настоящее время наибольшее распространение при выполнении ЛХЭ получило применение монополярной коагуляции. К плюсу данной методики можно отнести простоту использования, высокую скорость рассечения тканей и достаточную надежность гемостаза. В свою очередь, существенным недостатком монополярного режима является риск получения ожога под пассивным электродом при малой площади контакта вследствие недостаточно плотного его прилежания к телу больного [8]. Нередким осложнением использования монополярной электрокоагуляции является так называемый феномен туннелизации тока, т.е. аномальное проведение тока по сосудам, спайкам, трубчатым образованиям, к которым относятся внепеченочные желчные протоки. Однако развитие современных хирургических технологий позволяет использовать другие источники энергии для диссекции, коагуляции и пересечения тканей, в частности – ультразвуковой скальпель (УЗС) [1, 4, 6].
Цель исследования – улучшение результатов хирургического лечения больных с осложненными формами ЖКБ путем использования ультразвукового гармонического скальпеля при ЛХЭ как средство профилактики интраоперационных и ранних послеоперационных осложнений.
Материалы и методы. В клинике хирургических болезней на базе Ростовского государственного медицинского университета проведен анализ результатов лапароскопической холецистэктомии у 95 пациентов с ЖКБ, в том числе и с осложненными формами. Больные были разделены на 2 группы в зависимости от способа выделения и обработки ложа желчного пузыря. 1 группа – 44 пациента, выделение желчного пузыря и обработка его ложа производились электрокоагуляцией. 2 группа – 51 пациент, выделение желчного пузыря и обработка ложа выполнялись при помощи гармонического (ультразвукового) скальпеля Harmonic Ultracision (Ethicon, США). При воздействии ультразвука в биологических тканях происходит несколько физических явлений: 1) поглощение; 2) отражение колебаний; 3) выделение тепла; 4) возбуждение колебаний; 5) возникновение потоков биологических жидкостей. Тепловое повреждение тканей незначительно. Кроме того, ультразвуковой скальпель не предполагает прохождения электрического тока через тело пациента, что особенно важно при наличии имплантированного водителя ритма. Основой действия гармонического скальпеля Ultracision является ультразвук. Гемостатическое действие достигается за счет коагуляции при температуре от 50 °С до 100 °С, при этом происходит закупоривание сосудов коагулированными белками, а при использовании электрохирургических и лазерных инструментов коагуляция наступает при температуре от 150 °С до 400 °С. При этом происходит высушивание и окисление (обугливание) тканей, образование струпа, покрывающего зону кровотечения [5, 7]. Оригинальная конфигурация крючка скальпеля позволяет коагулировать сосуды более 1–2 мм в диаметре. С помощью ультразвукового скальпеля осуществляется рассечение тканей с одновременным гемостазом.
Лабораторное исследование заключалось в определении показателей общего анализа крови (ОАК), общего анализа мочи (ОАМ), определяли уровень общего, прямого и непрямого билирубина, АЛТ, АСТ, амилазы, креатинина и мочевины, общего белка. Всем больным выполняли ультразвуковое исследование органов брюшной полости, стандартную электрокардиографию. ЛХЭ выполнялась в условиях пневмоперитонеума до 14 мм рт. ст. из 4 точек по общепринятой методике. Для проведения операции использовали эндоскопические стойки и инструментарий фирм «Carl Storz» (Германия), «Медфармсервис» (Россия).
Результаты исследования и их обсуждение. При использовании ультразвукового скальпеля задымление было меньше, чем при использовании электрокоагуляции (ЭК). Дополнительного гемостаза ложа желчного пузыря, отделенного при помощи УЗС, не потребовалось ни в одном случае, тогда как при использовании ЭК у 8 пациентов наблюдалось интенсивное кровотечение из ложа желчного пузыря, которое потребовало дополнительного гемостаза. При работе монополярным электродом-крючком на отечных тканях в области ложа желчного пузыря высокочастотная энергия из-за большого количества жидкости в области воздействия становилась неуправляемой. Глубина термического повреждения тканей колебалась от 2 до 10 мм, что приводило к значительному термическому повреждению печеночной паренхимы, либо к перфорации стенки желчного пузыря с последующим поступлением содержимого в свободную брюшную полость. Прогнозировать глубину проникновения тепловой энергии было крайне сложно. Уменьшение мощности генератора приводило к ослаблению гемостатического эффекта коагуляции и снижению скорости диссекции.
На инфильтрированных тканях скорость работы электродом-крючком снижалась, в связи с уменьшением гемостатического эффекта приходилось увеличивать мощность электрохирургического генератора. В ходе операции на рабочую поверхность инструмента налипало большое количество коагулируемых тканей. Во время отделения желчного пузыря у больных с перивезикальным инфильтратом приходилось от 4 до 10 раз приостанавливать операцию с целью очищения рабочей поверхности электрода-крючка, что пролонгировало оперативное вмешательство. Увеличение мощности коагулятора сопровождалось образованием большого количества дыма, который значительно ухудшал видимость в области операции, что являлось причиной остановки оперативного вмешательства с целью аспирации дыма из брюшной полости с последующей инсуфляцией углекислого газа. Эта манипуляция являлась причиной увеличения времени оперативного вмешательства. Перфорация желчного пузыря имела место у 10 больных первой группы, среди пациентов второй группы данный вид осложнения отсутствовал. После выполнения ЛХЭ в раннем послеоперационном периоде у больных, оперированных с использованием гармонического скальпеля, следует отметить наличие ранней реабилитации, уменьшение болевого синдрома, по сравнению с больными, которым ЛХЭ производилась с использованием монополярной электрокоагуляции. Продолжительность стационарного лечения после лапароскопической холецистэктомии в I группе составила от 7 до 16 суток, в среднем 8,86±1,1 суток, в отличие от II группы, где продолжительность лечения составила от 5 до 10 суток после проведения оперативного вмешательства, в среднем 6,34±0,23 суток. Гипертермия у пациентов с использованием электрокоагуляции и ультразвука в первые сутки послеоперационного периода не имела достоверных различий и составила 38,4±0,19 0С и 38,3±0,24 0С соответственно. Однако в дальнейшем у первой группы клинических наблюдений гипертермия была достоверно больше (р<0,05), составив на 2-е сутки 37,5±0,21 0С у первой группы и 37,0±0,08 0С у второй. Продолжительность гипертермии также была достоверно больше (р<0,05) после ЛХЭ с использованием электрокоагуляции, составив в среднем 3,46±0,78 суток, во второй группе – 2,1±0,44 суток. Динамика температурной реакции представлена на рис. 3.
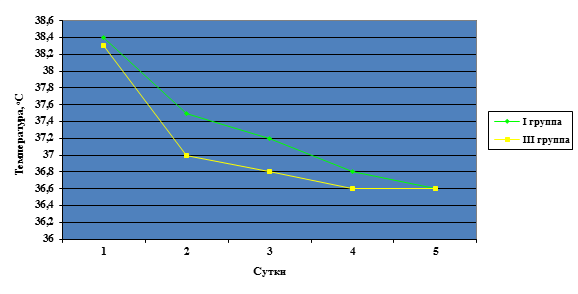
Рис. 3. Температурная реакция у пациентов I и II групп после ЛХЭ
Сроки дренирования ложа желчного пузыря в первой группе были достоверно (р<0,05) больше, чем во II группе, и составили 3,7±1,1 суток и 1,87±0,46 суток соответственно.
Сравнительная динамика изменения количества лейкоцитов в периферической крови представлена на рисунке 1.
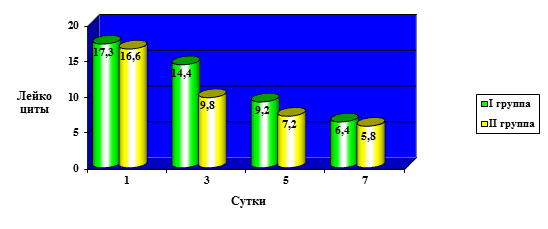
Рис. 1. Сравнительная динамика изменения количества лейкоцитов в периферической крови у I и II групп клинических наблюдений
Анализируя динамику изменения количества лейкоцитов в периферической крови, как следует из рисунка 1, мы не обнаружили достоверно значимых различий в данном показателе на первые сутки послеоперационного периода, однако стоит отметить, что в обеих группах данный показатель был достоверно (р<0,05) выше верхней границы нормы (10,2∙109/л), составив 17,3±3,14∙109/л у больных первой группы и 16,9±2,78∙109/л у пациентов II группы клинических наблюдений. На 3-и сутки отмечается достоверно значимая разница количества лейкоцитов в первой и второй группах, 14,4±2,06∙109/л и 9,8±0,16∙109/л (р<0,05), при этом во второй группе ни в одном случае количество лейкоцитов не превысило допустимую норму. В первой группе снижение количества лейкоцитов происходит только на 5-е сутки послеоперационного периода.
Динамика изменения количества палочкоядерных нейтрофилов (ПЯН) в периферической крови представлена на рисунке 2.
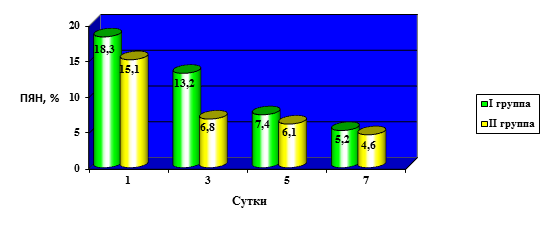
Рис. 2. Сравнительная динамика изменения количества палочкоядерных нейтрофилов после ЛХЭ
Как следует из рисунка 2, в обеих группах клинических наблюдений на 1-е сутки отмечается достоверно (р<0,05) значимое увеличение палочкоядерных нейтрофилов относительно нормы (до 8 %) до 18,3±4,34 % в первой группе и до 15,1±2,41 % во второй группе клинических наблюдений. Однако уже на третьи сутки у II группы больных отмечается снижение данного показателя до 6,8±0,62 %, ни в одном случае не превышая норму, тогда как в первой группе уровень палочкоядерных нейтрофилов по-прежнему остается высоким и составляет 13,2±2,76 % и нормализуется только к 7-ым суткам после ЛХЭ, составляя в среднем 5,2±1,48 % (р<0,05).
Значительно менее выраженная воспалительная реакция в периферической крови после ЛХЭ с использованием ультразвукового скальпеля Harmonic (Ultracision), в отличие от электрокоагуляции, связана, по нашему мнению, с минимальной воспалительной реакцией тканей в ложе желчного пузыря после воздействия аппарата.
Показатели активности аминотрансфераз сыворотки крови пациентов в первые сутки у I группы больных значительно превысили норму (до 0,19 мкмоль/л), АЛТ в 4,8 раза, составив 0,86±0,16 мкмоль/л, и АСТ в 4,5 раза, составив 0,72±0,17 мкмоль/л, в то время как во второй группе активность АЛТ составила 0,28±0,07 мкмоль/л и АСТ – 0,27±0,06 мкмоль/л, превысив норму в 1,65 и в 1,68 раза, соответственно (р<0,05). Показатели активности трансаминаз в первой группе клинических наблюдений оставались достоверно выше нормальных показателей на 3-и, 5-е сутки, составляя для АЛТ 0,74±0,18 и 0,46±0,09 мкмоль/л, а для АСТ 0,61±0,17 и 0,32±0,08 соответственно, нормализуясь только к 7-м суткам (р<0,05). У пациентов второй группы нормализация показателей активности трансаминаз наблюдалась на 4 – 5-е сутки, что свидетельствует об обширном термическом повреждении печени в первой группе при использовании электрокоагулятора и об интактности на функцию печени ультразвука во второй. У 2 пациентов первой группы в послеоперационном периоде наблюдалось желчеистечение по дренажу из ложа желчного пузыря. У пациентов второй группы этих осложнений не наблюдалось.
Проведенное исследование показало, что при выполнении холецистэктомии с использованием УЗС у пациентов наблюдается более благоприятное течение послеоперационного периода, менее выражена реакция организма на операционную травму по сравнению с ЭК. Ультразвук оказывает более щадящее действие на органы, одновременно выполняется кавитация, коагуляция, диссекция тканей, что предупреждает некроз тканей, повреждение мелких кровеносных сосудов и внепеченочных желчных путей. Таким образом, лапароскопическая холецистэктомия с использованием ультразвукового скальпеля позволяет снизить количество интраоперационных и ранних послеоперационных осложнений.
Рецензенты:
Грошилин В. С., д.м.н., зав. кафедрой хирургических болезней № 2 ФПК и ППС ГБОУ ВПО РостГМУ Минздравсоцразвития России, г. Ростов-на-Дону.
Хоронько Ю. В., д.м.н., зав. кафедрой оперативной хирургии и топографической анатомии ГБОУ ВПО РостГМУ Минздравсоцразвития России, г. Ростов-на-Дону.



